产前皮质类固醇激素给药至分娩的时间间隔对双胎早产儿呼吸系统结局的影响
2021-01-10李俊慧李宇丹
李俊慧,李宇丹,李 冬
(1.大连医科大学 研究生院,辽宁 大连 116044;2.大连市妇女儿童医疗中心 新生儿科,辽宁 大连116037)
近年来,双胎妊娠的发病率在全球范围内稳步上升[1],早产是双胎妊娠中最重要的问题之一,导致新生儿并发症的风险增高[2-3]。预期早产前的产前皮质类固醇激素(antenatal corticosteroids,ACS)治疗是针对早产儿改善其新生儿结局的重要产前治疗手段之一,自美国国立卫生研究院于1994年发表共识声明后,ACS使用已有数十年的历史[4],其在单胎早产儿的有效性已得到广泛证实[5-8]。关于ACS在双胎妊娠中的有效性信息很少,尚无指南[9]。一些研究报告表明,ACS可以改善双胎早产儿的结局[10-12],基于临床证据及皮质类固醇在单胎早产儿中的有效性,美国妇产科学院建议妊娠24 0/7周至33 6/7周的双胎孕妇也应使用单疗程的ACS[13]。
ACS有效性的一个重要问题是最佳时间间隔,临床研究表明当分娩发生在完成一个完整疗程后的24 h至7 d之间时,单疗程ACS的效果最佳,而当ACS距分娩间隔超过7 d时,其益处会降低[14]。然而根据Adams等[15]的研究,在有早产指征的患者中,只有48%的孕妇在接受ACS治疗7 d内分娩,对于ACS使用时机控制不当,是影响早产儿预后的重要原因。目前ACS治疗距分娩的最佳时间间隔的证据主要是基于单胎妊娠的研究[14,16-17],单胎妊娠中ACS最佳时间间隔是否适用于双胎妊娠尚不清楚。本研究旨在评估单疗程ACS给药至分娩的时间间隔,对妊娠28 0/7周至34 6/7周的双胎早产儿呼吸系统疾病发生率的影响,比较临床呼吸治疗是否存在差异,为探讨双胎早产儿ACS给药的最佳时间间隔提供参考。
1 资料与方法
1.1 研究对象
回顾性分析2018—2019年入住大连市妇女儿童医疗中心新生儿重症监护室(neonatal intensive care unit,NICU)的双胎早产儿的临床资料。纳入标准:(1)出生胎龄28 0/7周至34 6/7周;(2)产母分娩前完成单疗程ACS治疗;(3)病例资料完整。排除标准:(1)胎儿先天异常;(2)双胎之一在子宫内死亡;(3)三胎妊娠;(4)单羊膜胎盘及双胎输血综合征;(5)生后36 h内死亡。
1.2 资料收集
产母资料:产母年龄、妊娠方式、分娩方式、BMI、初产、胎膜早破、妊娠期高血压、胎盘早剥、妊娠期糖尿病、胎盘绒毛膜羊膜炎。
早产儿资料:出生胎龄、使用ACS时的胎龄(第1剂)、出生体重、性别、小于胎龄儿、Apgar评分(1、5 min)、产房呼吸支持情况(气管插管、复苏囊正压通气、低流量吸氧)、肺表面活性物质(pulmonary surfactant,PS)使用、机械通气时间、持续气道正压通气时间(continuous positive airway pressure,CPAP)、氧气吸入时间、咖啡因使用时间、合并症[新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、肺出血、败血症、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、颅内出血、肺炎、新生儿湿肺]、住院天数。 小于胎龄儿、RDS、BPD、肺出血、湿肺、肺炎、NEC、败血症、颅内出血等诊断标准参照第5版《实用新生儿学》[18]。
1.3 分 组
单疗程的ACS定义为肌肉注射地塞米松4次,每次6 mg,间隔12 h。根据末次给予ACS至分娩的时间间隔分为两组,第1组为ACS给药后7 d内分娩组(<7 d组),第2组为ACS给药后超过7 d分娩组(≥7 d组)。对两组的产母特征和新生儿呼吸结局进行比较。
1.4 统计学方法
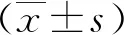
2 结 果
2.1 一般资料
2018—2019年本院共娩出105对胎龄28 0/7周至34 6/7周的双胎早产儿,最终纳入57对(114例),其中男56例,女58例,男女比例为0.97∶1。出生胎龄M=33.6周,平均出生体重为(1 963.3±422.8)g。排除:胎儿先天缺陷异常2对,一个胎儿在子宫内死亡6对,双胎输血1对,生后36小时内死亡1对,未入住NICU病例8对,未使用ACS或使用部分及重复疗程ACS治疗病例30对。
114例早产儿中,ACS给药至分娩的时间间隔<7 d组56例,≥7 d组58例。两组间胎龄分布情况见表1。

表1 两组患儿胎龄分布
2.2 早产儿资料比较
两组早产儿出生体重、辅助生殖、性别(男)、小于胎龄儿、Apgar评分(1、5 min)、产房呼吸支持(气管插管、复苏囊正压通气、低流量吸氧)等资料比较,差异无显著性意义(P>0.05)。<7 d组出生胎龄(M=33.5周)低于≥7 d组(M=34.0周),差异有显著性意义(P<0.05)。使用ACS时的胎龄<7 d组(M=32.9周)明显高于≥7 d组(M=30.4周),差异有显著性意义(P<0.05)。胎盘绒毛膜羊毛膜炎的发生率<7 d组(55.4%)明显低于≥7 d组(79.3%),差异有显著性意义(P<0.05),见表2。
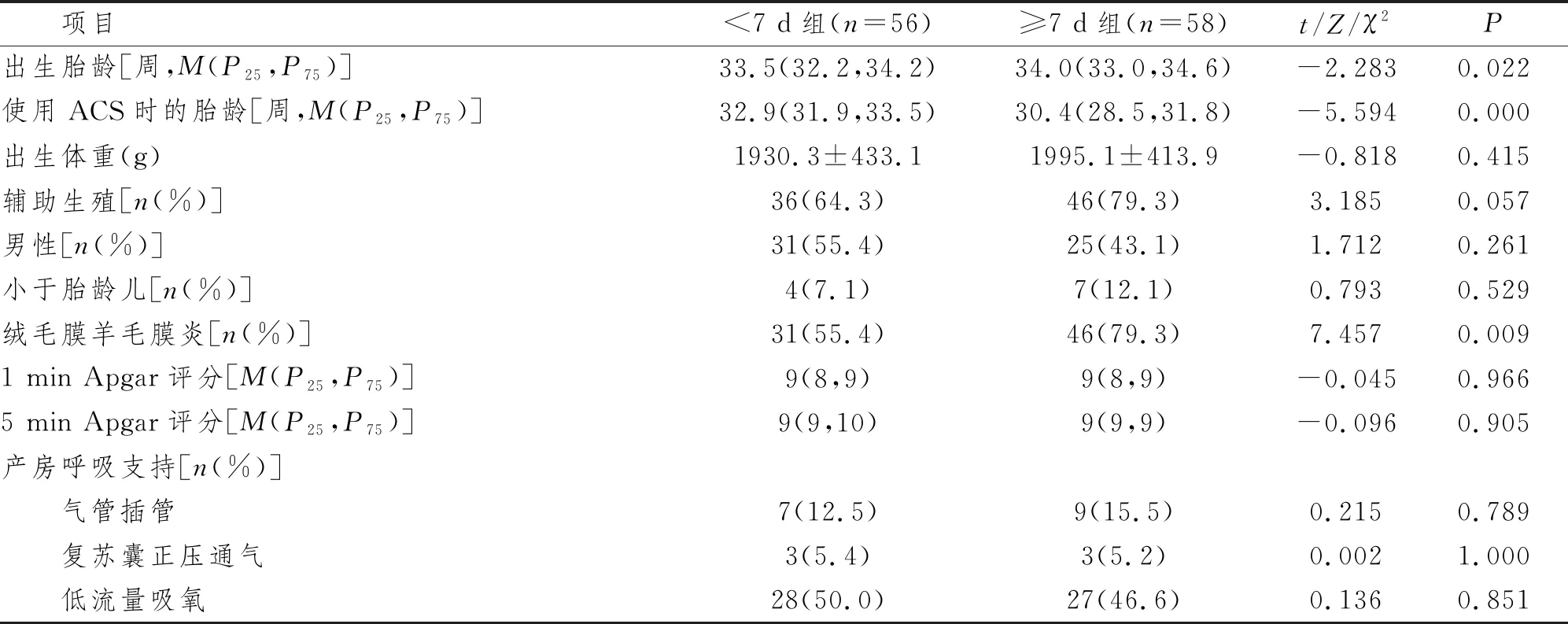
表2 早产儿相关因素比较
2.3 产母资料比较
两组产母年龄、分娩方式(剖宫产)、BMI、初产、合并症发病率(胎膜早破、妊娠期高血压、胎盘早剥、妊娠期糖尿病)等资料差异均无显著性意义(P>0.05)。见表3。

表3 产母因素比较
2.4 临床呼吸治疗情况比较
机械通气使用率(19.6%)在<7 d组明显低于≥7 d组(37.9%),差异有显著性意义(P<0.05)。两组在PS使用率、机械通气时间、CPAP使用率及时间、氧气吸入使用率及时间、咖啡因使用天数、住院天数方面,差异均无显著性意义(P>0.05),见表4。

表4 临床呼吸治疗情况比较
2.5 临床合并症比较
RDS发生率<7 d组(35.7%)显著低于≥7 d组(56.9%),差异有显著性意义(P<0.05)。其他临床并发症,包括BPD、肺出血、湿肺、肺炎、NEC、败血症、颅内出血的发生率差异均无显著性意义(P>0.05),见表5。
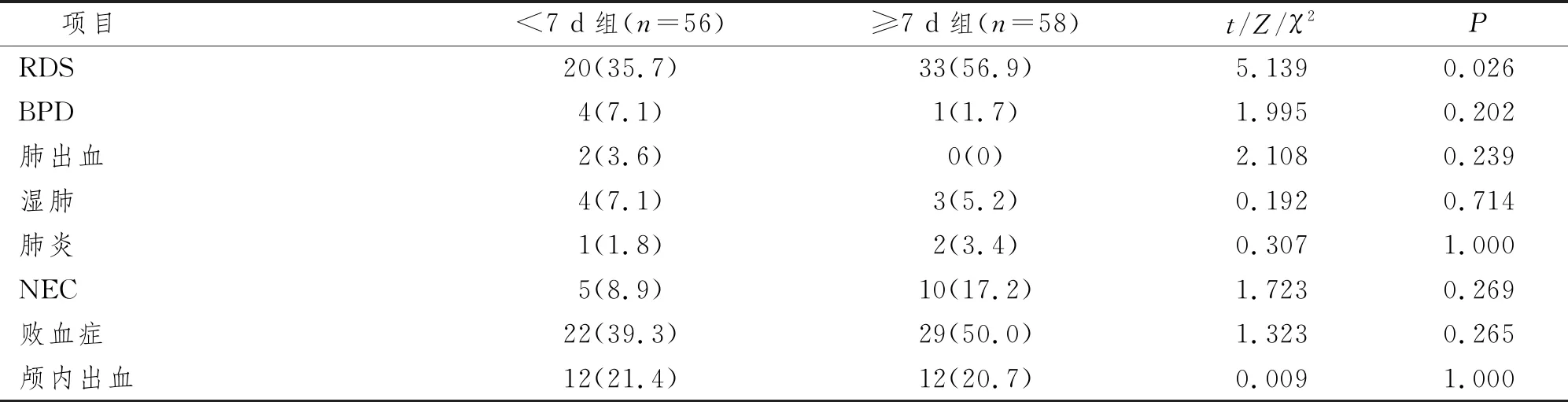
表5 临床合并症情况比较
2.6 RDS的多因素Logistic回归分析
两组资料比较差异有显著性意义的变量:胎龄、胎盘病理,以及ACS给药至分娩的时间间隔纳入Logistic回归分析RDS的危险因素,结果显示胎龄和ACS给药至分娩的时间间隔为RDS发生的独立危险因素,胎龄越小、ACS给药至分娩的时间间隔≥7 d会增加RDS的发生率。见表6。

表6 RDS的多因素Logistic回归分析
3 讨 论
随着辅助生殖技术的广泛开展双胎妊娠的出生率逐渐增加[19]。早产作为双胎妊娠的独立危险因素,在双胎妊娠中占有相当的比例。目前中国每年早产儿人数已过100万,是新生儿发病和死亡的主要原因,呼吸系统并发症是早产儿不良结局的主要因素。在减少早产儿并发症的干预措施中,ACS治疗是目前最成熟的方法之一,ACS治疗最初主要用于降低RDS的发病率。Roberts等[20]研究证实单疗程ACS治疗使RDS风险降低34%,脑室内出血风险降低46%,NEC的风险降低54%,生后48 h内的感染风险降低44%,呼吸支持和NICU住院的需求也相对减少。同时该研究也表明,需要进一步的研究来支持在多胎妊娠中使用ACS。目前虽然没有足够的数据证明ACS治疗在多胎妊娠中的益处,但鉴于在单胎妊娠中使用ACS有明显益处,大多数专家建议将其用于早产多胎妊娠[11,13]。
产前应用ACS的目的是增加胎儿体内皮质类固醇浓度,促进各器官尤其是肺脏成熟,为生后过渡做准备[21]。ACS对胎儿肺组织的主要作用是导致肺的结构和生理变化,改善肺部气体交换,加速诱导肺泡Ⅱ型上皮细胞的分化,增加肺顺应性及PS的释放,降低血管通透性,及增强胎儿肺部抗氧化酶活性[22-23]。ACS常用药物为倍他米松和地塞米松,两者均为氟化的皮质类固醇激素,可穿过胎盘转化为活性形式,具有类糖皮质激素活性而没有盐皮质激素作用[5,24]。两者均具有相对的疗效和安全性,而地塞米松具有更好的可用性和更低的成本,目前国内多用[25]。本研究单一疗程的ACS治疗即使用地塞米松磷酸,间隔12 h肌肉注射4剂(6 mg)[8]。
目前临床对ACS治疗方案的胎龄限制不同,美国妇产科学院建议妊娠24 0/7周至33 6/7周,7 d内有早产风险的孕妇(包括多胎妊娠)使用单疗程的ACS[7]。皇家妇产科学院建议对胎龄24 0/7周至34 6/7周有早产风险的妇女提供单疗程的ACS治疗[26],目前中国尚无ACS治疗的相关指南。本研究对胎龄28 0/7周至34 6/7周接受单疗程ACS治疗的双胎早产儿进行呼吸结局评估,ACS给药至分娩的时间间隔范围为2~51 d,其中<7 d组间隔时间为(4.1±1.5)d,≥7 d组间隔时间为(22.7±12.0)d。在<7 d组中,使用ACS时的胎龄明显高于≥7 d组,分析原因可能与≥7 d组辅助生殖受孕的双胎早产儿更多,由于其产母自身的状态导致孕期进行保胎治疗,更早的使用ACS有关。
RDS是早产儿生后最常见的呼吸系统疾病,其原因是由于早产儿肺发育未成熟,肺泡Ⅱ型上皮细胞合成分泌的PS不足所致。而PS是一种天然存在的磷脂,可以降低肺泡的表面张力,防止肺泡塌陷。PS在妊娠24~25周开始合成,直到胎龄35周左右才迅速增加[18]。因此,胎龄越小,越容易发生RDS。本研究多因素回归分析显示胎龄是RDS发生的独立危险因素(OR:0.424;95%CI:0.279,0.646),结果与临床相符。
有关ACS与RDS发生的相关性,本研究结果显示<7 d组RDS的发生率明显低于≥7 d组(35.7% vs. 56.9%,P<0.05),多因素回归分析显示ACS给药至分娩的时间间隔<7 d是降低RDS发生率的独立影响因素(OR:0.223;95%CI:0.089,0.563)。同时,<7 d组机械通气使用率明显低于≥7 d组(19.6% vs. 37.9%),结果证实ACS给药至分娩的时间间隔对呼吸系统结局至关重要。临床多项研究也证明:如果在分娩前7 d以上给予ACS,效果可能会较差[12,21,27-30]。Kuk等[31]比较了未接受ACS治疗与ACS给药至分娩的时间间隔为<2 d,2~7 d和>7 d的双胎早产儿RDS发病率,表明未接受ACS治疗的双胎早产儿RDS的发生率与ACS给药至分娩的时间间隔<2 d和>7 d相似,但ACS给药至分娩的时间间隔为2~7 d的双胎早产儿RDS的发生率明显降低。Blickstein等[32-33]也发现在分娩前24 h至7 d之间给予完整疗程的ACS,与部分治疗(给药<24 h或>7 d分娩)或不接受ACS治疗相比,RDS的发生率显著降低。
ACS给药距分娩时间间隔7 d以上的有效性降低导致重复给药的问题,在单胎中,已证明重复ACS疗程对呼吸结局无益处,且与平均出生体重和头围较低有关[34-36]。Murphy等[37]进行的一项队列研究在双胞胎中观察到了类似的趋势。Choi等[38]研究也表明重复疗程ACS不能减少双胎早产儿RDS的发生率,重复疗程未显示对新生儿结局的有益影响,其长期影响尚需要进一步研究。
本研究显示两组间PS使用率、BPD等其他呼吸相关结局差异无显著性意义。我国早产儿RDS流行病学调查协作组关于ACS治疗对早产小于胎龄儿BPD发生率的影响与此结果一致[39]。虽然对于单胎早产儿,在国外2016年的一项多中心研究证实了ACS在降低PS治疗的必要性、降低BPD方面的有效性[40],但目前在双胎早产儿中尚未见文献报道。本研究显示BPD的发生率在<7 d组略高,其原因可能与出生胎龄更低和样本量相对较少相关,两组中发生BPD的早产儿出生胎龄均<30周,<7 d组出生胎龄<30周的早产儿占75%,该组早产儿出生胎龄相对更低。且由于本研究为回顾性研究,无法在开始这项研究之前计算样本量,因此样本量的限制和样本存在偏倚的原因,可能存在一定误差,尚不足以显示新生儿远期呼吸系统结局的显著差异。基于本研究和既往研究得出的共同结论提示:有关ACS对双胎早产儿生后结局的影响尚需要高质量、进一步的长期随访研究,以明确ACS治疗的有效性以及双胎妊娠ACS的最佳时间间隔。
综上,在胎龄28 0/7周至34 6/7周之间出生的早产双胞胎中,单疗程ACS给药至分娩的时间间隔<7 d时RDS发生率及机械通气使用率明显降低,提示单疗程ACS给药至分娩的时间间隔与早产儿呼吸系统结局有一定相关性,在分娩前7 d内完成单疗程ACS治疗可能效果更佳。因此,使用单疗程ACS时应更谨慎,以期在分娩前7 d内完成治疗,保证ACS的疗效。
