超小剂量地西他滨治疗中高危骨髓增生异常综合征患者的疗效及相关因素分析
2021-01-09常炳庆胡蓉华惠吴函赵弘苏力孙婉玲
常炳庆 胡蓉华 惠吴函 赵弘 苏力 孙婉玲
骨髓增生异常综合征(MDS)是起源于造血干细胞的一组异质性髓系克隆性疾病,特点为髓系细胞发育异常,表现为无效造血、难治性血细胞减少,转化为急性髓系白血病(AML)的风险较高[1-2]。MDS患者的男女比约为2∶1,以中老年人多见,50岁以上者约占50%~70%。MDS患者自然病程和预后的差异性较大,治疗应根据预后分层并采取个体化原则。异基因造血干细胞移植(allo-HSCT)是治愈中高危MDS患者唯一的方法,但由于患者发病年龄较高且常合并其他疾病,大部分MDS患者没有移植机会[3]。目前,以地西他滨为代表的去甲基化药物(HMAs)为治疗MDS的核心药物,广泛应用于无法进行allo-HSCT的中高危MDS患者。地西他滨治疗的标准剂量为20 mg·(m2)-1·d-1×5 d,但其治疗相关的感染及心脏不良反应的发生率较高,治疗依从性较差。因此本研究旨在分析超小剂量地西他滨[6 mg·(m2)-1·d-1×10 d]治疗中高危MDS患者的疗效特点及其影响因素。
对象与方法
1.对象:2014年7月1日~2018年12月31日于首都医科大学宣武医院血液科和北京航天总医院血液科住院的、接受超小剂量地西他滨治疗的中高危MDS患者19例,其中男13例,女6例,年龄47~79岁,中位年龄61岁。所有患者均根据2006年维也纳MDS最低诊断标准及2016年世界卫生组织(WHO)MDS修订分型标准进行诊断与分型。其中,MDS伴多系造血异常(MDS-MLD)4例、MDS伴原始细胞增多-1(MDS-EB-1)5例、MDS伴原始细胞增多-2(MDS-EB-2)10例。末次随访日期为2018年12月31日,随访时间3~47个月,中位随访时间13个月。
2.方法
(1)治疗方法:含超小剂量地西他滨的治疗方案:包括地西他滨单药[6 mg·(m2)-1·d-1静脉滴注,7~10 d]和地西他滨联合CAG方案[DCAG方案,即地西他滨6 mg·(m2)-1·d-1静脉滴注,5~10 d;阿柔比星10 mg/d静脉滴注,7~10 d;阿糖胞苷10 mg·(m2)-1·d-1皮下注射,每12 h 1次,10~14 d;重组人粒细胞集落刺激因子(G-CSF)150 μg皮下注射,每12 h 1次]。对于一般情况不佳、合并疾病严重、无法耐受细胞毒性药物治疗的患者选择单药地西他滨治疗;一般情况尚可、无合并疾病或合并疾病短时间内控制、无脏器功能不全的患者选择DCAG方案治疗。用药期间给予止吐、水化、碱化等对症支持治疗;PLT计数<20×109/L或有出血表现时,给予输注单采PLT;Hb<70 g/L或活动后乏力、心悸、胸闷时,给予输注悬浮少白细胞红细胞。出现感染征象时,积极寻找感染诊断证据并给予抗感染治疗,根据血培养、痰培养、G试验、GM试验、胸部CT等检查结果调整抗生素的使用。肝功能受损予以保肝降酶对症处理。
(2)疗效评价:根据2006年国际工作组(IWG)提出的MDS疗效判断标准[4],将MDS患者的治疗目标分为两个方面:改善生活质量和改变疾病自然病程。据此提出了4组疗效标准:①改变疾病自然病程;②细胞遗传性反应;③生活质量;④血液学改善(HI)。本研究重点关注改变疾病自然病程及HI两方面。改变疾病自然病程反应包括:完全缓解(CR)、部分缓解(PR)、骨髓CR(mCR)、疾病稳定(SD)、治疗失败及疾病进展(PD)。改变疾病自然病程反应总有效(OR)率=(CR+mCR+PR)/总例数×100%。HI包括:红系反应(HI-E)、血小板反应(HI-P)、中性粒细胞反应(HI-N)及HI后进展或复发。根据WHO化疗药物不良反应分级标准对不良反应情况进行评定。
(3)生存评价:无进展生存(PFS)时间是指从第一次应用含超小剂量地西他滨方案治疗至病情进展或末次随访时间。总生存(OS)时间是指从第一次应用含超小剂量地西他滨方案治疗至末次随访或死亡的时间。

结 果
1.临床资料:19例患者应用HMAs前接受支持治疗、免疫调节治疗、生长因子治疗。治疗前中位WBC计数2.55(1.12~25.29)×109/L,中位中性粒细胞绝对值(ANC)0.66(0.17~14.19)×109/L,中位Hb 63(36~118)g/L,PLT计数37(7~162)×109/L,中位骨髓原始细胞百分比7.5%(1.0%~19.0%),中位外周血原始细胞百分比0(0~12%)。其中ANC<0.5×109/L的患者5例(26.32%);Hb<60 g/L患者8例(42.11%);PLT计数<20×109/L患者5例(26.32%)。19例患者中6例(31.58%)存在细胞遗传学改变,其中3例(15.79%)为复杂核型改变。17例患者(89.47%)检出基因突变,涉及基因包括:WT1(7例)、TET2(4例)、SRSF2(3例)、PRAME(2例)。依据国际预后评分系统(IPSS)分组:中危-1组11例、中危-2组8例;依据修订的IPSS(IPSS-R)分组:低危组1例、中危组2例、高危组10例、极高危组6例;基于WHO分类的预后评分系统(WPSS)分组:高危组18例、极高危组1例。共13例(68.42%)患者存在合并疾病,其中合并1种疾病7例(36.84%),合并2种疾病2例(10.53%),合并3种疾病4例(21.05%)。常见合并疾病包括高血压、糖尿病、冠心病、慢性阻塞性肺疾病(COPD)、原发性肺动脉高压(PAH)、间质性肺病(ILD)。见表1。

表1 纳入患者的临床资料
2.改变疾病自然病程的疗效:19例中高危MDS患者中,共11例获得改变疾病自然病程的改善,临床有效率为57.89%;其中CR 5例(26.31%),mCR 6例(31.58%);达到最佳疗效的中位疗程数为2(1~5)个周期,显效持续中位时间为5(2~20)个月,出现疾病进展中位疗程数为5(3~9)个周期。将所有患者分为年龄<65岁组(11例)和年龄≥65岁组(8例)进行比较结果显示,年龄<65岁患者的OR率及CR率均明显高于年龄≥65岁者(P<0.05),见表2。
3.HI情况:19例患者中,15例(78.95%)获得HI,其中有10例(52.63%)获得HI-N,显效中位疗程为2(2~4)个周期,中位持续时间为5(2~30)个月;11例(57.89%)获得HI-E,显效中位疗程为2(2~4)个周期,中位持续时间为5(1~27)个月;13例(68.42%)获得HI-P,显效中位疗程为2(2~3)个周期,中位持续时间为5(1~24)个月。与年龄≥65岁患者比较,年龄<65岁者更易获得HI-E(P<0.05),见表2。与相对低危(IPSS积分为中危-1)患者比较,相对高危(中危-2)患者治疗后更易获得HI-P,差异有统计学意义(5/11比8/8,P=0.018)。
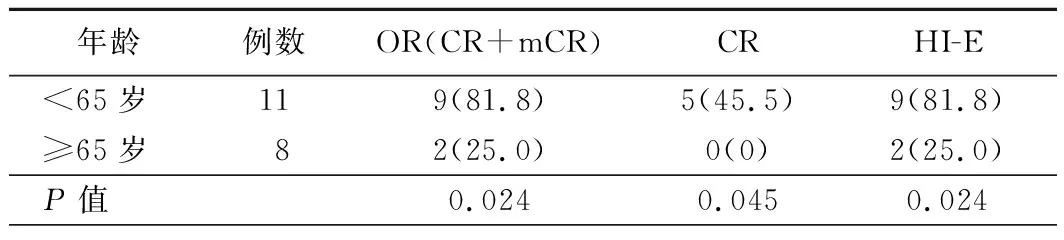
表2 不同年龄患者的疗效比较[例,(%)]
3.生存评价:19例患者中位PFS时间为11(2~22)个月,中位OS时间为11(2~32)个月。发病时外周血无原始细胞的患者治疗后OS及PFS时间明显延长(P值分别为0.015、0.011),见图1。治疗后出现自然病程改善改变的患者与未出现改变的患者相比,PFS时间比较差异无统计学意义(P=0.388)、OS时间明显延长(P=0.043),见图2;治疗后出现输血依赖改善的患者与未出现的患者PFS时间比较差异无统计学意义(P=0.212)、OS时间明显延长(P=0.008),见图3;发病年龄≥65岁的患者较<65岁患者,PFS及OS时间比较差异均无统计学意义(P分别为0.262、0.168),见图4;有合并疾病患者较无合并疾病的患者,PFS及OS时间比较差异均无统计学意义(P值分别为0.551、0.579),见图5。
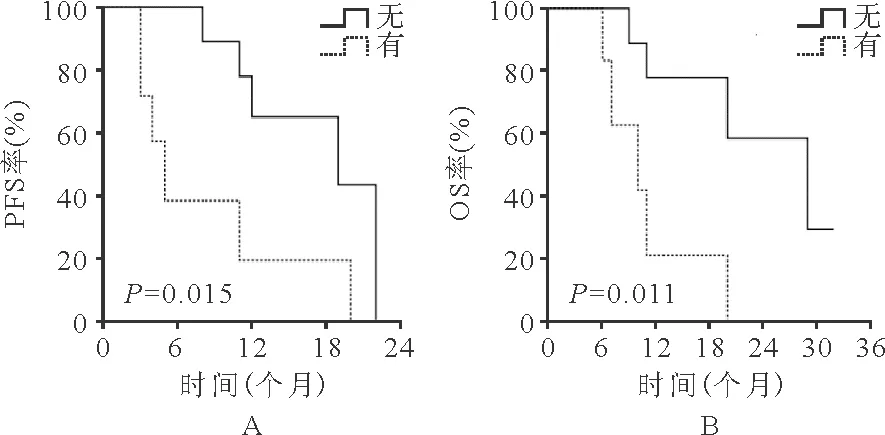
图1 外周血有无原始细胞患者地西他滨治疗后的PFS和OS(A:PFS;B:OS)

图2 治疗后是否出现自然病程反应患者的PFS和OS(A:PFS;B:OS)
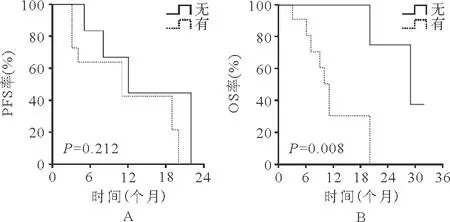
图3 治疗后是否出现输血依赖改善患者的PFS和OS(A:PFS;B:OS)
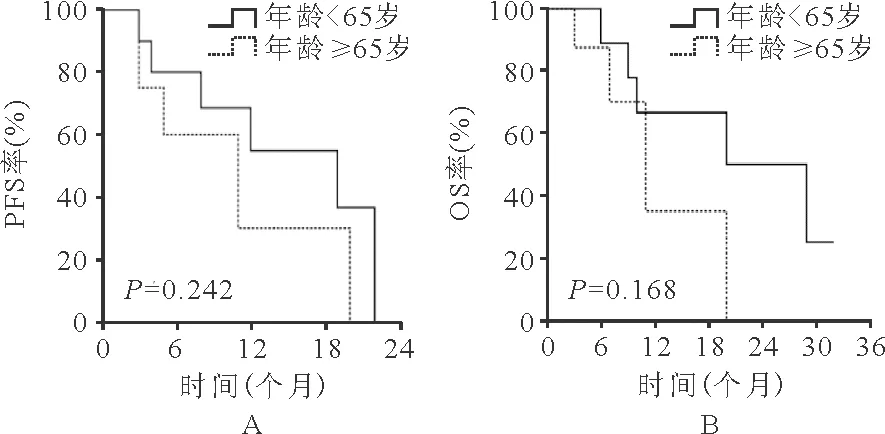
图4 不同年龄患者的PFS和OS(A:PFS;B:OS)
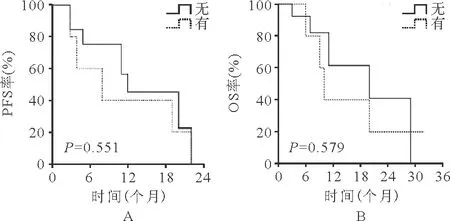
图5 是否存在合并疾病患者的PFS和OS(A:PFS;B:OS)
4.不良反应:19例患者共行81周期含超小剂量地西他滨的治疗,过程中出现感染42例次(51.85%),肝功能异常4例次(4.94%),心律失常1例次(1.23%)。感染部位以肺部多见(30/42例次,71.43%),病原微生物以细菌为主,3例患者出现深部真菌感染。治疗过程中,4例患者出现轻-中度肝功能异常(转氨酶升高≤4倍正常上限),经治疗后好转;1例患者出现室上性心动过速,经药物治疗后复律。治疗过程中的出血多表现为皮肤出血及鼻黏膜出血,未发生消化道及颅内出血等脏器出血。
讨 论
人类基因转录调控区附近存在一些富含双核苷酸“CG”的区域,一旦发生甲基化,会出现基因表达异常甚至基因沉默[5]。抑癌基因启动子高甲基化使抑癌基因表达受阻,不能发挥抑癌效应,是MDS的主要发病机制[6-7]。DNA甲基化通过DNA甲基转移酶(DNMTs)介导,HMAs通过共价结合DNMTs去除DNA的高甲基化状态、恢复抑癌基因功能,使MDS患者获得临床改善。地西他滨作为HMAs广泛应用于中高危MDS患者的治疗之中。地西他滨存在双重作用机制,即在较高剂量时发挥细胞毒性效应;低剂量时通过抑制DNMTs拮抗的表观遗传学异常[8-9]。
地西他滨的标准治疗剂量为20 mg·(m2)-1·d-1×5 d,28天为1个疗程。Kantarjian等[10]报道标准剂量地西他滨组获得CR的患者比例明显高于小剂量[10 mg·(m2)-1·d-1×10 d]组(39%比24%,P<0.05)。然而近年来研究结果发现,减低剂量地西他滨±小剂量化疗疗效与标准剂量单药地西他滨接近,但不良反应较少,更适合中国患者[11-14]。Li等[15]的研究结果显示,地西他滨[15 mg·(m2)-1·d-1×5 d]单药治疗中高危MDS患者的总有效率为43/79(76.1%)。Ye等[16]的研究结果显示,81例MDS难治性贫血伴原始细胞增多(MDS-RAEB)患者中应用地西他滨[20 mg·(m2)-1·d-1×3 d]序贯小剂量化疗与单纯化疗相比,总有效率(75.0%比51.2%,P=0.027)和CR率更高(55.0%比29.3%,P=0.019)。Li等[17]的研究结果显示,地西他滨[6 mg·(m2)-1·d-1×7 d]单药治疗中高危MDS患者的总有效率为67.7%。Jeong等[18]研究结果显示,MDS患者应用标准剂量地西他滨[20 mg·(m2)-1·d-1×5 d]单药治疗后,61%的治疗有效患者初始疗效发生在第二周期。
本研究结果显示,中高危MDS患者应用含有地西他滨方案[6 mg·(m2)-1·d-1×10 d]±CAG方案治疗后总有效率为78.95%(15/19),出现改变自然病程的临床有效率为57.89%(11/19),其中CR 5例(26.31%),mCR 6例(31.58%),显效的中位周期为第二周期,与上述疗效接近,但由于本研究病例数量有限,无法进行统计学比较。
Lübbert等[19]的研究结果显示,减低剂量地西他滨[45 mg·(m2)-1·d-1×3 d]治疗中高危MDS患者的中位OS时间为10.1个月,中位PFS时间为6.6个月。Ye等[16]的研究结果显示,减低剂量地西他滨[20 mg·(m2)-1·d-1×3 d]联合低剂量化疗治疗MDS-RAEB患者的中位OS时间为11个月。本研究纳入患者的中位OS时间与之接近,PFS则优于上述研究,同时部分病例仍处于继续治疗随访之中,因此本方案治疗后的生存获益较其他减低剂量地西他滨方案更加明显。本研究中发病时外周血无原始细胞的患者应用本方案治疗后,其OS及PFS时间明显延长,临床获益明显。对于是否将外周血中原始细胞状况可作为预后评估的指标目前尚无明确结论。由于本研究病例数量较少,其是否为独立的预后因素尚需扩大样本量进一步验证。
减低剂量地西他滨治疗后的不良反应主要表现为骨髓抑制所致的感染和出血[20]。本研究中感染的发生率为51.85%,以肺部感染多见;出血多表现为皮肤黏膜出血,未发生严重脏器出血;治疗过程中4例患者出现肝功能异常、1例出现室上性心动过速,均经治疗后好转,未影响后续治疗。由此可见超小剂量地西他滨方案治疗的不良反应主要为感染,而严重出血和非血液学毒性的发生率较低。
本研究结果还发现,与年龄≥65岁患者比较,年龄<65岁患者治疗后改变疾病自然病程反应总有效率、CR率及HI-E的发生率均明显升高,但两者治疗后PFS及OS时间比较差异均无统计学意义。提示老年MDS患者应用此方案治疗后虽然临床疗效不及<65岁患者,但治疗后的生存时间均无明显缩短。伴有合并疾病的患者应用此方案治疗后,生存时间也无明显缩短。MDS患者以老年人多发,易合并其他基础疾病,多数患者治疗耐受性差,而此方案不缩短治疗后生存时间,且严重不良事件发生率较低,安全可控,可作为老年中高危MDS患者可选择的治疗方案之一。
此外,本研究结果显示,患者最佳疗效的中位疗程数为2个,显效持续中位时间为5个月,出现疾病进展中位疗程数为5个,提示应用含超小剂量地西他滨的方案治疗后,患者可获得较好的临床疗效,但疗效不持久,部分患者在治疗后半年左右出现疾病进展。因此,对于已获得临床疗效的患者,其生活质量和疾病状态有所改善,机体对化疗的耐受性可能增加,可酌情加用强度更大的化疗,以获得更显著、更持久的临床效果。
由于本研究入组患者数量有限,且部分患者在研究终止时尚处于继续治疗及随访阶段,不能全面反映疾病的特点,今后尚需继续随访观察并扩大样本量进行研究。
