特发性非硬化性门脉高压的病理表现
2021-01-09张誉杨永峰
张誉 杨永峰
特发性非硬化性门脉高压(INCPH)是一种相对少见的血管性肝病,特点是出现脾大、食管胃底静脉曲张、侧支循环形成等门脉高压症的表现,而没有肝硬化的存在。其病因尚不明确,且没有统一诊断标准,只有在排除肝硬化、门静脉血栓形成、先天性肝纤维化等其他引起门脉高压的病因后,才考虑INCPH的诊断。目前尚无有效的血清学、影像学检查用于鉴别INCPH和肝硬化。INCPH常被误诊为肝硬化,因此,肝脏组织病理学检查在诊断中尤为重要。INCPH的病理特征包括汇管区纤维化、门静脉闭塞、肝窦扩张等。本文着重对INCPH的病理表现进行概述。
一、INCHP的简介
INCHP是一种以出现门脉高压而无肝硬化为主要特点的疾病,临床特征包括食管胃底静脉曲张出血、脾肿大伴脾功能亢进、上腹部不适、乏力等。少部分患者出现腹腔积液,而肝性脑病和肝肺综合征较为罕见。随着对该疾病的深入了解,发现在疾病的早期阶段,患者可表现为长期不明原因的肝功能异常,而没有门脉高压表现,有学者称之为INCPH临床前期。在印度,这种病被称为非肝硬化门脉纤维化,近年来其患病率较前下降,但仍然很高,约占所有门脉高压患者的15%~34%[1]。日本的一项全国性研究结果也显示INCPH的发病率逐渐下降,可能与卫生条件改善有关。欧洲国家INCPH的发病率似乎比印度、日本更低[1]。在日本,INCPH在中年女性中最常见,男女患者比例约1∶3,而在西方发达国家,男性发病率更高。
INCPH的病因尚不明确,门静脉血流窦前阻力增大及脾脏血流量增多被认为是引起门脉高压的直接原因。引起这种改变的危险因素包括感染、化学物质作用、免疫紊乱、凝血功能异常、先天性或遗传性疾病五类[2]。在发展中国家,肠道或腹腔感染引起感染性栓塞,进而导致门静脉损伤是最常见的诱因。有动物实验结果表明,肠道菌群通过门静脉血流向肝内迁移,可引起门脉周围纤维化[3]。在发达国家,凝血功能异常及药物、毒物引起的血管损伤更为常见。门静脉末梢血栓形成、蛋白C或S缺乏可能与此类疾病相关。一些药物如硫唑嘌呤、奥沙利铂、司他夫定等也能引起门静脉病变[1]。此外,约10%的INCPH患者出现各种免疫相关疾病,如先天性或获得性免疫缺陷病、自身免疫性疾病、原发性低丙种球蛋白血症等。
二、INCPH的诊断
目前INCPH的诊断尚无金标准,支持诊断的主要依据包括以下3项:(1)排除慢性肝病引起的肝硬化,排除其他原因引起的门脉高压,如血吸虫病、先天性肝纤维化等;(2)有食管胃底静脉曲张、侧支循环形成等门脉高压表现;(3)病理检查结果无肝硬化表现,有闭塞性门静脉、结节性再生性增生(NRH)、不完全间隔性肝硬化等表现[4]。次要依据包括以下6项:(1)出现腹腔积液、脾脏增大、血小板减少、轻度肝功能异常等;(2)病理检查结果发现门静脉血流阻塞的异常特征、肝小叶结构破坏、肝窦扩张、窦周纤维化等;(3)多普勒超声检查排除门静脉血栓形成;(4)CT或MRI检查结果显示二级肝内门静脉分支突然狭窄,发现良性血管瘤形成;(5)肝静脉压力梯度正常或轻度升高;(6)瞬时弹性成像显示肝硬度正常或轻度升高[4]。
三、INCPH的病理表现
肝脏组织病理学检查对INCPH的诊断必不可少,有助于排除肝硬化、先天性肝纤维化、血吸虫病等其他引起门脉高压的病因,也有助于发现闭塞性门脉病变的直接和间接表现。临床上,肝脏病理学检查组织大多由超声引导下经皮肝穿刺获得。当患者有明显出血倾向时可采取经颈内静脉穿刺,这种方法可避免穿过肝包膜,降低大出血风险,但得到的肝组织较少,因此需要多次穿刺[5]。INCPH的病理改变多种多样,严重程度各不相同,且在肝脏中分布不均,因此,采集足够多的组织标本非常重要,首选长而宽的标本,高质量标本长度应>25 mm,其中至少应该包含11个汇管区[4]。
1.大体表现
早期INCPH的肝脏外形不均一,体积可正常或增大,表面光滑或不规则[6]。随着病程进展,可观察到肝包膜纤维化,包膜下区域实质不规则萎缩,肝脏表面出现隆起、凹陷及波浪状不规则改变。到病程晚期肝脏明显萎缩,形态改变,重量减轻,尤其肝左叶萎缩最为常见,与肝硬化难以鉴别。肝内门静脉主干管壁增厚、扩张,中等大小的门静脉分支因纤维化而扩张,部分分支彼此之间相互靠近,或靠近肝包膜[7]。外周的门静脉小分支可见明显狭窄,且彼此靠近,部分区域小分支数量明显减少[8]。
2.组织学表现
INCPH的病理学表现包括闭塞性门静脉病、NRH和不完全间隔性肝硬化[1]。闭塞性门静脉病依据病变部位可以分为汇管区及其周围病变、肝小叶病变及肝小静脉病变。
(1)汇管区及其周围改变
INCPH患者的肝脏组织中可见汇管区及其周围改变,然而这些病变呈不均一分布,且病变类型多种多样,因此对于有门脉高压表现的患者,组织学表现正常汇管区并不能排除INCPH。常见的汇管区及周围改变包括以下6点:
①门脉分支改变:INCPH最基础的病理改变是“闭塞性门静脉病”或“肝门静脉硬化”,即门静脉周围纤维化及门静脉分支狭窄、闭塞,主要累及门静脉的中小分支,通过增加门静脉血流的窦前阻力引起门脉高压[3]。在正常的汇管区中,门静脉分支的直径往往超过胆管直径的三倍,INCPH中门静脉内径可缩小至胆管大小,甚至更小。中等大小的门静脉分支可见血管平滑肌层增生。在周围的小汇管区可见门静脉周围结缔组织增生,管壁不规则增厚,管腔偏心性狭窄,直至完全闭塞甚至消失[1](图1、2)。同时需要注意的是,并不是所有缺失门静脉分支的汇管区均为异常,在正常的肝组织中,汇管区二联体即只包含肝动脉、门静脉、肝胆管中两者的汇管区几乎与汇管区三联体一样常见。通过Masson三色染色法可以观察到增生的平滑肌及浓缩的纤维环,有助于识别闭塞的门静脉。部分受累的汇管区内可见轻度淋巴细胞、单核细胞浸润,往往出现在较早期的患者中,这可能与门静脉原发性损伤因素相关[9]。部分汇管区可观察到轻度的胆管反应[10]。有研究发现INCPH患者的肝脏病理组织中可观察到门静脉血栓形成,这可能是继发改变,不列为INCPH的病理特征。不同病因引起的门静脉管壁及其周围区域的改变是INCPH的始动因素及特征性改变[11]。
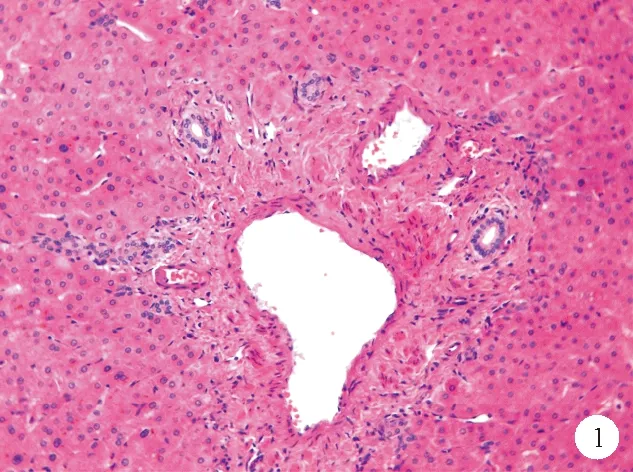
图1 门静脉管壁增厚患者肝脏组织的苏木素-伊红(HE)染色结果(×200)
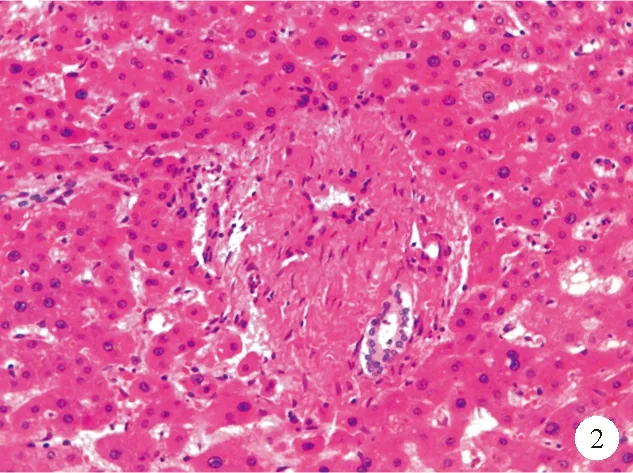
图2 门静脉分支闭塞患者肝脏组织的HE染色结果(×200)
②汇管区纤维增生:INCPH的汇管区可观察到明显的胶原纤维增生,主要围绕汇管区血管分布,偶尔可见不规则纤维组织自汇管区伸入肝实质中。然而在肝硬化中,增生的胶原纤维围绕假小叶分布,不仅仅局限于汇管区[11]。
③汇管区血管增生:在汇管区内,除正常的门静脉,还可观察到多个异常扩张的薄壁血管,呈血管瘤样改变(图3),该病变可能由门静脉闭塞直接引起。但在肝硬化等其他原因引起门脉高压的肝脏组织中也能观察到这种改变,因此可能仅能反映门脉高压的存在。
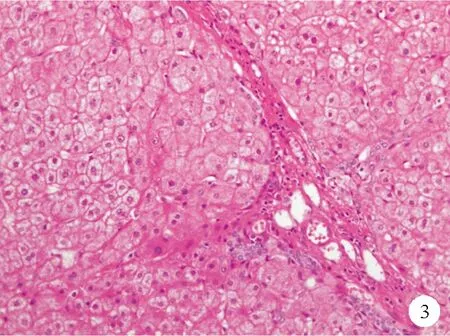
图3 门静脉分支增生患者肝脏组织呈血管瘤样改变的HE染色结果(×200)
④汇管区周围血管异常:正常情况下,门静脉被包裹在汇管区周围的结缔组织中,不直接与肝实质接触。但在异常的组织中可见到管径正常或扩大的门静脉分支直接毗邻肝实质,称为“门静脉疝入”[9](图4)。在汇管区周围,常常可观察到单个或多个类似的异常薄壁血管,它们和汇管区相连,管径大小不等,我们称之为门静脉周围血管瘤样改变,而与之相连的汇管区可能包含或不包含一个正常的门静脉。相关研究表明,这些异常血管与肝窦相连,而不直接与肝静脉相连,这也证实了其来源于门静脉。有学者将门静脉疝入及门静脉周围血管瘤样改变统称为门静脉的分流血管。然而,在脂肪肝的病理活检组织中也可观察到这种异常血管,目前还不能确定其是否具有分流作用,也可能是代偿肝脏血流量的不足引起的小静脉扩张[7]。部分汇管区还可观察到小动脉突出、增殖,可能也是一种代偿反应。
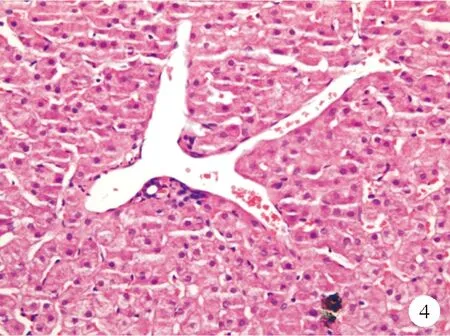
图4 门静脉分支向肝实质疝入患者肝脏组织的HE染色结果(×200)
⑤汇管区残基:此外,还可观察到部分直径异常减小的汇管区,小于其中胆管直径两倍,且胆管直径小于该汇管区毗邻的肝细胞,称之为“汇管区残基”[9]。汇管区残基中通常难以见到相应的门静脉(图5)。
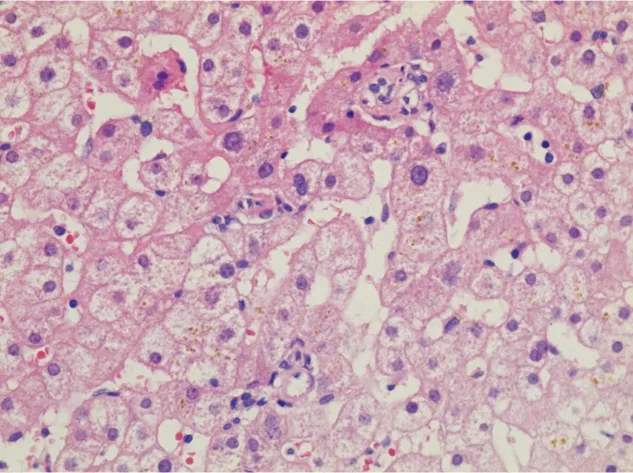
图5 汇管区残基患者肝脏组织的HE染色结果(×400)
⑥汇管区周围肝细胞病变:汇管区周围的肝细胞可能出现缺血引起的萎缩或细胞凋亡,但很少出现细胞坏死,这与肝硬化不同[11]。
(2)肝小叶改变
肝小叶中最常见的改变为肝窦扩张,即肝窦宽度大于一个肝细胞板。然而该改变并不具有特异性,在窦后梗阻、慢性炎症、药物刺激等多种肝病中都可观察到肝窦扩张。INCPH时肝窦扩张机制尚不明确,理论推测与白细胞介素-6及血管内皮生长因子通路的激活有关。其次,在INCPH中常见轻到中度窦周纤维化,Masson三色染色有助于突显这种病变。有时还可以观察到肝窦充血及髓外造血。
(3)肝静脉(中央静脉)改变
通常认为肝静脉病变是门静脉闭塞的继发改变,表现为管壁增厚、管腔闭塞或扩张,伴或不伴中央静脉周围纤维化。在部分肝小叶中央区可见畸形扩张的中央静脉或多个中央静脉。
(4)NRH
NRH是一种组织病理学实体,是增生的肝实质细胞组成的小结节。典型的NRH大体表现为大小均匀的白色或黄白色结节,直径大多为1~3 mm,在肝脏横截面上呈弥漫性分布[1]。也有报道称NRH在肝脏中可呈局限性分布,且大小不一,甚至有直径达数厘米的案例。显微镜下可以观察到正常的肝小叶结构扭曲,被增生的小结节取代[1]。结节围绕小汇管区分布,直径略小于原肝小叶。结节内部富血供区域肝细胞增生,形成2~3层厚的肝细胞板,外层包围着因血供减少而萎缩的肝细胞索[8]。结节的中心可见到小的汇管区,其中可看到正常的胆管和动脉。肝窦扩张、充血,中央静脉被挤压成细缝状或闭塞(图6)。与肝硬化不同的是,NRH结节之间没有纤维间隔,因此显微镜下HE染色难以识别二者的区别。通过网状纤维染色可以观察到增生的结节周围凝聚的网状纤维,有助于诊断NRH。其次,角蛋白-7免疫荧光染色可突出结节周围萎缩的肝细胞,对NRH的诊断也有帮助[9]。
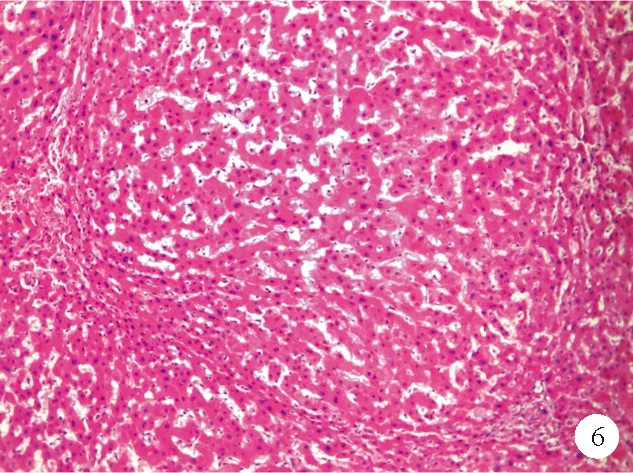
图6 NRH患者肝脏组织的HE染色结果(×100)
NRH与INCPH的关系比较复杂,很多研究试图证实两者之间的联系。法国的一项多中心研究中3 600例肝脏病理组织活检,仅4.4%发现有NRH。在不明原因肝功能异常患者中,组织学诊断为NRH约占15%[9]。约40%INCPH患者可观察到NRH的改变。因此NRH可能是特发性非硬化性门脉高压的一种形态学表现。然而,并不是发现NRH就能诊断INCPH,无门脉高压患者中也可观察到NRH的存在。在一项尸检研究中发现,NRH患者中仅有5%有门脉高压。临床上即使是经验丰富的病理学家对NRH诊断的一致性也较低,且就诊患者中多数已出现门脉高压[12]。因此,对于NRH的临床意义及其与INCPH的关系还有待进一步研究探讨。
(5)不完全间隔性肝硬化(ISC)
ISC的特征是纤细的纤维组织自汇管区伸入肝小叶中,且不与其他汇管区或肝静脉相连,通过断断续续的纤维间隔围成弥漫性的结节[1]。ISC可能是一种肝硬化逆转期改变,在慢性肝病的损伤和修复过程中,肝脏结构持续重构,肝硬化从小结节发展为大结节,再形成ISC。由于肝硬化消退后,肝血管病变持续存在,因此门脉高压也持续存在[9]。ISC与INCPH的关系尚不明确,在诊断INCPH前,临床医生需要仔细询问病史,排除患者存在慢性肝病的可能,病理医生也应仔细观察,排除肝硬化的可能。
四、临床前期INCPH的病理诊断
在部分因慢性肝功能异常就诊、无门脉高压患者肝脏组织病理活检中也能观察到闭塞性门静脉病变(OPV),这种情况被称为临床前期INCPH。一项研究对59例病理诊断为闭塞性门静脉病的患者进行分析,有15例(25%)在首次诊断时无门脉高压及肝外门静脉血栓形成,其中6例(40%)在随访过程中出现门脉高压症[13]。意大利的一项多中心研究发现,482例不明原因肝功能异常患者中有94例(19.5%)发现OPV,将其与20例同期诊断为INCPH的患者进行对比分析发现,OPV组可观察到全部INCPH相关病变,但两组观察率无显著差异。最常见病理改变包括门静脉血管异常(96.8%)、门静脉血管瘤样改变(75.5%)、肝窦扩张(67.0%)、肝窦毛细血管化(89.4%)等。在INCPH组中观察到NRH及不完全纤维间隔的概率较OPV组高,且差异有统计学意义(P=0.002和P=0.006),这可能是疾病更晚期的表现[14]。由于临床前期INCPH患者无门脉高压症,接受肝脏病理组织活检的概率较低,因此该病在临床的诊断相对不足。临床医生在面对不明原因肝功能异常患者时,应该考虑到这种情况。
INCPH病理改变的病因学解释尚不明确,且这些改变不具有特异性。在肝外门静脉血栓形成等其他原因引起门脉高压的患者中,也可能观察到这些病理改变。且在正常肝脏组织中,部分汇管区也能观察到类似的组织学改变,这些病理改变是否具有临床意义还不能确定[15],且INCPH尚无确切诊断标准,因此,INCPH的诊断还需要结合患者病史、影像学检查等综合考虑。对于因慢性不明原因的肝功能异常就诊、且无门脉高压的患者,若观察到INCPH相关病理改变,考虑其可能处于疾病的临床前期,长期随访十分必要。
