盐溶法分离纯化鲤鱼卵的卵黄高磷蛋白及其理化性质的研究
2021-01-09李慧中刘红梅李秋雨龚姚谦
李慧中,刘红梅,李 彦,李秋雨,龚姚谦,戴 幽,刘 焱*
(1. 湖南农业大学食品科学技术学院,长沙 410128;2. 湖南省发酵食品工程技术中心,长沙 410128;3. 芷江侗族自治县农业农村局,芷江 419100;4. 长沙理工大学化学与食品工程学院,长沙 410128)
中国的水产资源种类繁多,鱼卵作为鱼副产物的一种,含有丰富的卵黄高磷蛋白(phosvitin, Pv),是仔鱼获取营养物质的唯一来源,对幼鱼生长至关重要[1-2]。研究表明,鲤鱼卵中的不饱和脂肪酸含量甚高,且不饱和脂肪酸对于脑的发育和心血管疾病的治疗具有重要作用[1]。多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)含量同饱和脂肪酸(saturated fatty acid, SFA)含量以及单不饱和脂肪酸(monounsaturated fat, MUFA)含量的比值在鲤鱼卵中约为1:1:1,已达到人体脂肪酸含量的科学摄入标准,且营养价值高。国内外对水产副产物的加工利用已有大量研究[3-7],但关于鱼卵Pv方面的相关研究甚少。以鲤鱼卵为原料提取Pv有利于提高鲤鱼鱼卵的利用价值,减少资源浪费。本研究拟采用盐溶法提取鲤鱼卵Pv,并对其性质进行研究,这对鲤鱼卵Pv在食品工业中的进一步应用具有实际意义。
1 材料与方法
1.1 材料
成熟鲤鱼卵采自湖南长沙马王堆农贸市场。用生理盐水将完整的鲤鱼卵处理干净后用高速匀浆机对其进行匀浆处理(15 000 r/min);鸡蛋Pv标样购自Sigma公司。
1.2 试验方法
1.2.1 鲤鱼卵Pv的提取工艺
用4℃蒸馏水稀释预处理后的鲤鱼卵[V(蒸馏水): m(鲤鱼卵)=10:1]并在低温下进行1 h不间断的搅拌,静置过夜(4℃),弃去上清液后高速冷冻离心,将沉淀与有机溶剂[V(95%乙醇): V(正己烷)=1:3]按照1:10的体积比进行萃取、过滤(滤液旋转蒸发去除有机溶剂可分离脂类)处理,用1.74 mol/L NaCl溶液对过滤后的沉淀进行溶解并搅拌、静置、再过滤后进行透析脱盐以及冷冻干燥处理,最终产物即为鲤鱼卵Pv粗提物。
1.2.2 试验设计
首先对鲤鱼卵的Pv粗提物进行提取[8-9],经天然聚丙烯酰胺凝胶电泳(native polyacrylamide gel electrophoresis, Native-PAGE)以及磷蛋白染色检测确定其分子量以及纯度;用变性聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis, SDSPAGE)检测Pv亚基的数量和分子大小;然后对鲤鱼卵Pv进行纯化,根据天然凝胶电泳测得的结果对鲤鱼卵Pv粗提物溶液进行超滤分离、真空浓缩、冷冻干燥,得到其纯品样品,保存备用(-40℃);最后分别检测样品中氮和磷的含量,计算氮磷含量比值和Pv得率,检测紫外吸收特性、氨基酸含量及其螯合铁离子的能力。
1.2.3 Native-PAGE
参照汪家政等[10-14]的试验条件并稍加调整:鲤鱼卵Pv粗提物及鸡蛋Pv标样的质量浓度均为0.5 mg/mL,5%~10%分离胶,5%浓缩胶,注射上样,4℃恒流电泳。
磷蛋白检测方法:参照Sun等[15]的方法对凝胶进行染色,然后用10%的磺基水杨酸溶液将染色的凝胶漂至蛋白条带回显清晰后终止。
电泳蛋白质染色脱色方法:用0.1%考马斯亮蓝R-250、25%乙醇、8%冰醋酸对鲤鱼卵Pv凝胶进行染色,用7%的冰醋酸溶液脱色,待蛋白条带回显清晰后进行扫描成像。
1.2.4 SDS-PAGE
SDS-PAGE工作溶液的配制参照Native-PAGE的制备方法,在部分溶液中加入离子去污剂SDS。12%分离胶,5%浓缩胶。对凝胶进行扫描成像,并根据Marker计算其亚基分子量。
1.2.5 得率测定
纯化后的Pv重量占原料总重的百分比即为其得率。
1.2.6 氮磷含量及氮磷含量比值(N/P)的测定
氮含量的检测:依据凯氏定氮法进行测定。
磷含量的测定[16-18]:本试验原料属于有机磷,拟先将其消化为无机磷,再用未消化的原料做对比。磷蛋白络合磷的含量=总的磷量-未消化原料中无机磷的含量。
1.2.7 紫外吸收检测
将鲤鱼卵Pv、鸡蛋Pv标样分别配制成0.5 mol/L的溶液,并测定其光吸收特性(波长:190~300 nm[19])。
1.2.8 氨基酸组成检测
用1 mL pH为2.2的柠檬酸钠缓冲液溶解鲤鱼卵Pv,用自动分析仪分析除胱氨酸、色氨酸外的16种氨基酸[20]。其中色氨酸含量的测定参照国标GB/T 18246-2000[21]。
1.2.9 铁离子螯合能力测定
参照Fu等[22]介绍的方法测定鲤鱼卵Pv的铁离子螯合能力。采用分光光度法测定其在波长为562 nm处的吸光度值。用螯合效应表示Pv对铁离子的螯合能力。
1.3 数据处理
各组试验数据均重复3次,用Excel和SPSS软件对数据进行绘图和显著性方差分析。
2 结果与分析
2.1 鲤鱼卵Pv的Native-PAGE结果
图1为在5%浓缩胶和10%分离胶时鲤鱼卵Pv粗提物(泳带2)与鸡蛋Pv标样(泳带1)的分离结果的对比。从图1中可以看到,鸡蛋Pv有2条清晰的条带,对应于Zhang等[23]发现的鸡蛋Pv标样主要组分为α-Pv(α-phosvitin)和β-Pv(β-phosvitin)这一结果;鲤鱼卵Pv粗提物经过凝胶分离后显示为P1、P2、P3 3条条带,经梯度凝胶电泳检测,其分子量分别为53.0、34.0和16.0 kD,其中P2(34.0 kD)、P3(16.0 kD)条带的染色结果为阳性,应为鲤鱼卵的Pv。这说明鲤鱼卵同鸡蛋相似均含有Pv成分,同时也具有异质性。
根据Native-PAGE检测结果超滤分离粗提物,用超滤管(50 kD)超滤透析除盐后的Pv,真空浓缩滤出部分冷冻干燥后进行下一步分析。
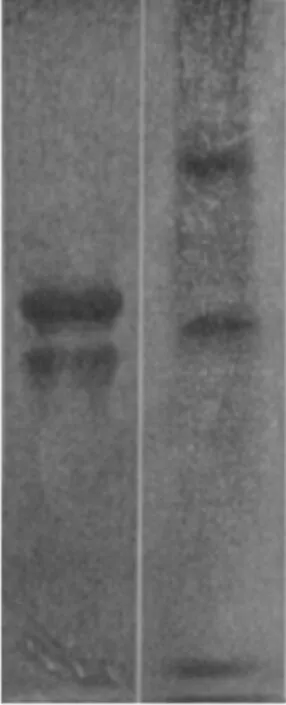
图1 鸡蛋Pv标样和鲤鱼卵Pv粗提物的Native-PAGE结果Fig. 1 Native-PAGE results of Pv crude extracts from egg and carp egg1:鸡蛋卵Pv标样;2:鲤鱼卵Pv粗提物。1: Standard sample of egg yolk of Pv; 2: Crude extract of egg yolk of carp Pv.
2.2 鲤鱼卵Pv的SDS-PAGE结果
图2为鲤鱼卵Pv的SDS-PAGE结果。泳带1显示鲤鱼卵Pv分为6条条带,分别为P2和P3的亚基。它们的分子量从大到小分别为98.0、96.0、33.0、20.0、17.7、和15.0 kD,且亚基分子量分布范围大。由图2可知,鲤鱼卵Pv在15.0~33.0 kD之间有4条条带,其分子量分别为15.0、17.7、20.0、和33.0 kD。这与文献中蓝鳕卵Pv在相同范围内具有5条条带[24]和鲈鱼卵Pv中有2条条带(其分子量分别为14.0 kD和21.0 kD)[8]的结果不同,说明鱼的品种对其Pv的组成存在一定的影响,但不影响其在一定范围内亚基分子量和数量上存在的相似性。
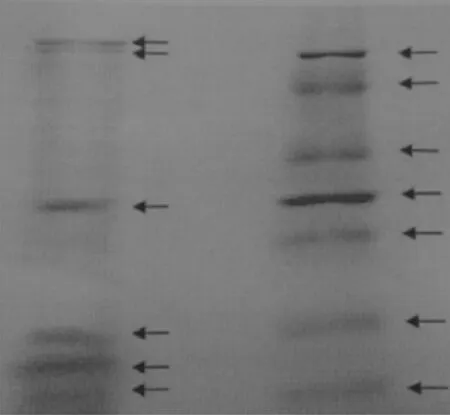
图2 鲤鱼卵Pv的SDS-PAGE结果Fig. 2 SDS-PAGE results of Pv carp egg1 :鲤鱼卵Pv ;2 :蛋白marker。1. Egg yolk of carp Pv; 2: Protein marker.
2.3 鲤鱼卵Pv得率、氮磷含量及其比值
图3为制作的磷标准曲线图,其线性回归方程为y=0.067x+0.002,相关系数R2=0.999,说明其线性关系良好。经测定,鲤鱼卵Pv的质量浓度为8.56 μg/mL,其磷含量为4.28%。
表1中,鲤鱼卵Pv的氮含量为11.74%,磷含量为4.28%,氮磷含量比值为6.07,与鸡蛋Pv标样的氮磷含量比值2.49相比较高,说明鲤鱼卵Pv的纯度比鸡蛋Pv的纯度低,这可能是因为鲤鱼卵Pv磷酸化程度比鸡蛋Pv磷酸化程度低。相比鲤鱼卵Pv中0.40%的提取率,有研究表明鸡蛋Pv粗提物的提取率约为0.78%,鲤鱼卵Pv提取率低于鸡蛋Pv。
2.4 鲤鱼卵Pv的紫外吸收特征
由图4可知,在波长为190.0~350.0 nm时,鲤鱼卵Pv的吸收峰分别在201.0 nm处和257.8 nm处出现,而鸡蛋Pv标样仅在201.0 nm处出现吸收峰,鲤鱼卵Pv吸收峰呈对称状且没有杂峰出现,说明盐溶法分离提取的鲤鱼卵Pv较纯。在波长为190.0~220.0 nm处鲤鱼卵Pv和鸡蛋Pv的光吸收趋势整体是相同的,在201.0 nm(峰2)处均出现最高吸收峰,其主要是由共轭双键肽键的作用导致的。与鸡蛋Pv不同的是,鲤鱼卵Pv在波长为257.8 nm处出现吸收峰,这可能是由苯丙氨酸的作用导致的。苯丙氨酸是人体必需氨基酸之一,大部分在体内经苯丙氨酸羟化酶催化作用氧化成酪氨酸,并与酪氨酸一起合成重要的神经递质和激素,参与机体糖代谢和脂肪代谢。结果显示,鲤鱼卵Pv中苯丙氨酸的含量高于鸡蛋Pv,且两者的紫外吸收特点不同,故反映其在氨基酸组成上也存在差异性。
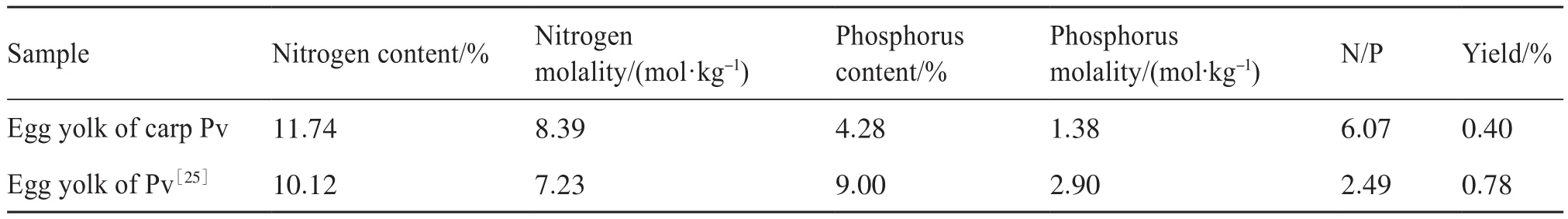
表1 鲤鱼卵Pv和鸡蛋Pv成分比较Tab. 1 Comparison difference of Pv from egg yolk and carp egg yolk
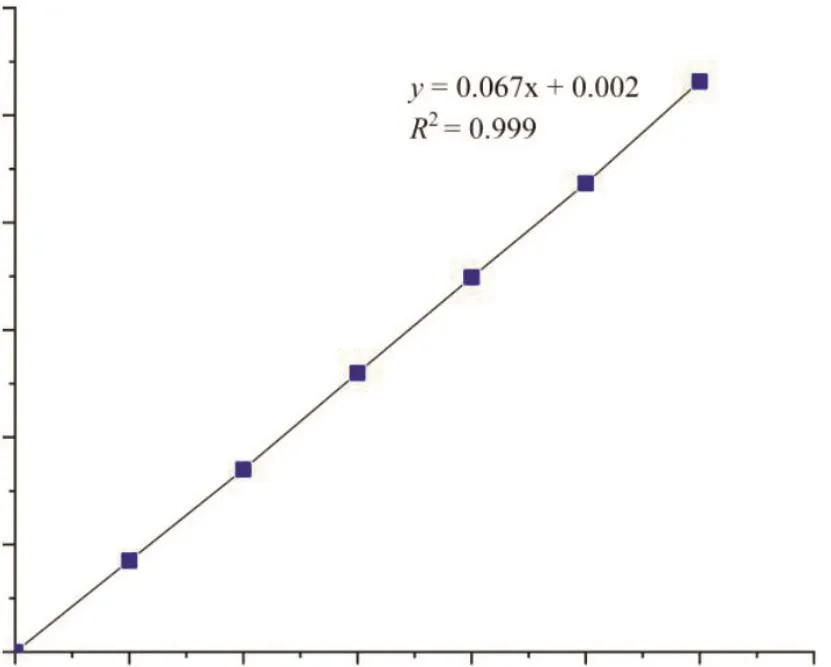
图3 磷标准曲线Fig. 3 The standard curve of inorganic phosphorus
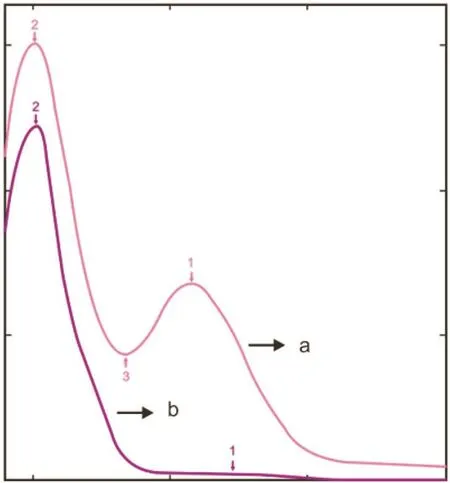
图4 鲤鱼卵Pv和鸡蛋Pv的紫外吸收图Fig. 4 The result about UV absorption of Pv from carp egg yolk and egg yolka:鲤鱼卵Pv ;b :鸡蛋Pv。a: Egg yolk of carp Pv; b: Egg yolk of Pv.
2.5 鲤鱼卵Pv中氨基酸的组成分析
从氨基酸分析结果可以看出(表2),鲤鱼卵Pv和鸡蛋Pv中共检测出17种氨基酸,其中含有7种人体必需氨基酸。鲤鱼卵Pv中除赖氨酸外,其余6种必需氨基酸的含量均高于鸡蛋Pv,这能够更好地促进Pv的形成。由于在Pv的氨基酸总量中,丝氨酸占56%,且80%以上的丝氨酸被磷酸化,因此丝氨酸和总氨基酸的比值可作为评判Pv中磷含量高低的依据。鲤鱼卵Pv中丝氨酸的含量为24.2%,明显高于所含其他种类氨基酸,但比鸡蛋Pv中丝氨酸占总氨基酸含量的34.9%要低。这与Mecham等[24]的研究中提出的蓝鳕卵Pv中14.6%的丝氨酸含量结果相近,说明鱼类Pv丝氨酸含量比鸡蛋Pv低,也说明了鲤鱼卵Pv中较低的丝氨酸含量正是导致其Pv含量低的主要原因。
2.6 鲤鱼卵Pv中铁离子螯合能力的分析
铁离子极易被氧化,能够诱导自由基反应,研究中常以铁离子为代表评价Pv的金属离子螯合能力。如图5所示,在铁离子浓度相同的条件下,鲤鱼卵Pv的铁离子螯合能力小于鸡蛋Pv。乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)螯合铁离子的能力最强。鲤鱼卵Pv的铁离子螯合能力小于鸡蛋Pv的铁离子螯合能力,这主要与鲤鱼卵Pv丝氨酸含量少、磷酸化程度小有关。
3 讨论
目前国内外在对Pv的研究中多从鸡蛋中获取,鱼类中以鲔鱼、黑鱼、鲈鱼以及鲫鱼鱼卵较为常见,对鲤鱼卵的提取研究很少。本文采用盐溶法对鲤鱼卵的Pv粗蛋白进行了提取,并检测到其粗提物中P2和P3为Pv,说明鲤鱼卵中含有Pv成分,且其同鸡蛋Pv相似,具有异质性(由P2、P3组成);SDS-PAGE检测到鲤鱼卵Pv亚基分子量分布范围大,且在一定范围内Pv的组成在亚基分子量和数量上的相似性不受鱼类品种的影响;氨基酸测试结果显示,在鲤鱼卵Pv中检测出的7种必需氨基酸中,除丝氨酸外,其余6种必需氨基酸的含量均高于鸡蛋Pv中的含量,这有利于更好地促进Pv的形成;鲤鱼卵中含有的食物限制性氨基酸赖氨酸和蛋氨酸含量高,且其Pv含量高于多种鱼类。
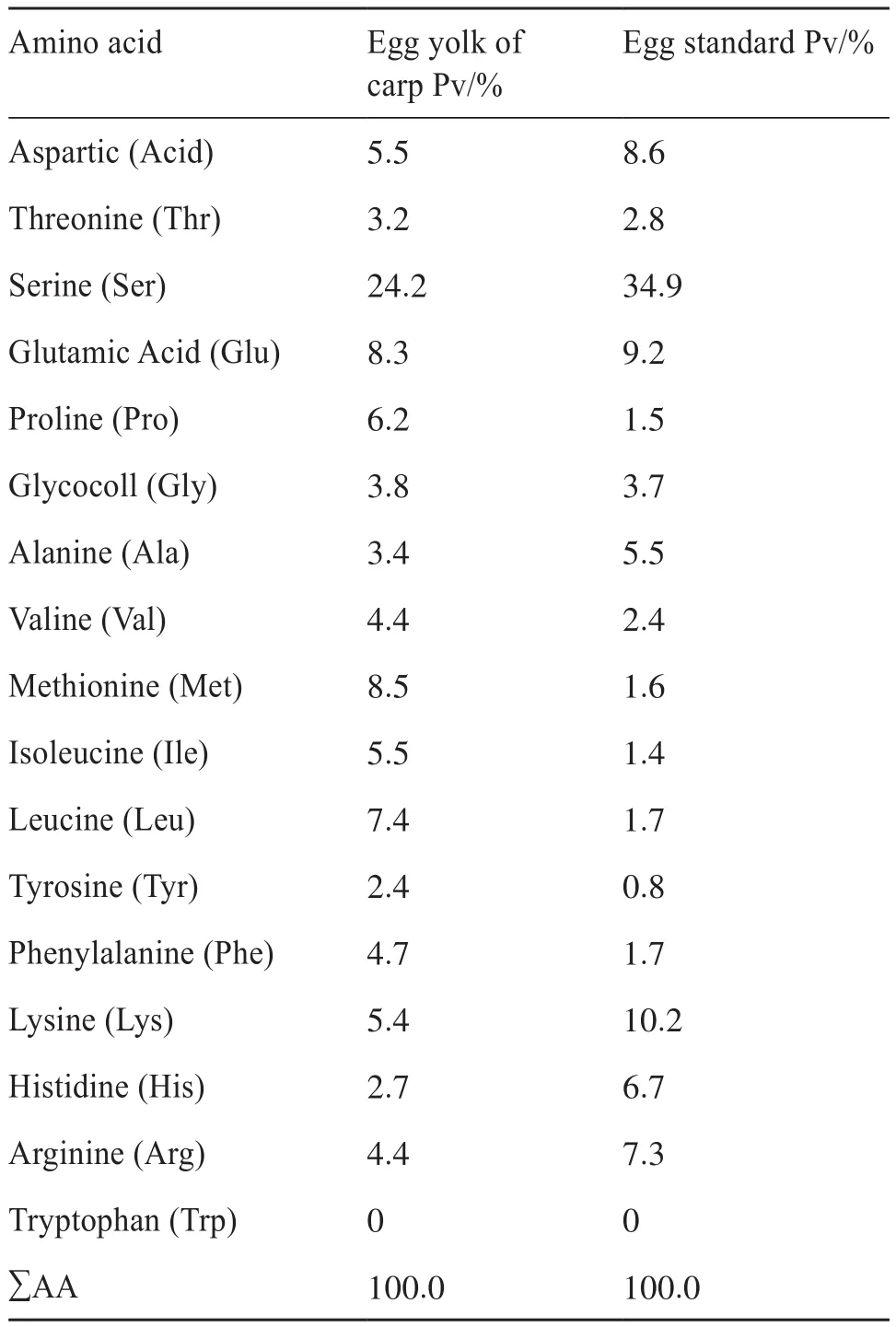
表2 鲤鱼卵及鸡蛋[25]Pv的氨基酸组成及含量Tab. 2 Amino acid composition and content of Pv in egg yolk of carp and egg yolk[25]
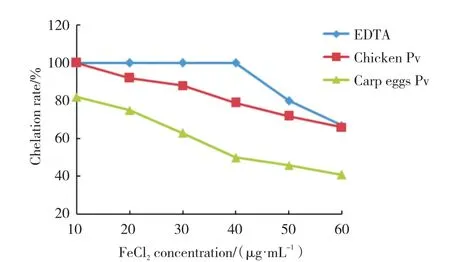
图5 鲤鱼卵Pv,鸡蛋Pv和EDTA的铁离子螯合能力Fig. 5 The iron chelating ability of egg yolk of carp Pv, egg yolk of Pv and EDTA
通过盐溶法提取分离鲤鱼卵的Pv,可一次性获得成分较为全面的目的蛋白。有采用葡聚糖凝胶(Sephadex G-200)过滤层析分离提取Pv的方法研究,但其试验速度较慢,且得到的目的蛋白较为单一;也有采用Tris缓冲溶液的提取方法,但结果显示其提取率远低于盐溶法。综合来说,提取鱼卵中的Pv宜采用盐溶法。通过盐溶法提取分离鲤鱼卵的Pv并对其性质进行探究,对鲤鱼卵在食品工业中的高值化利用存在实际意义。
