后正中入路显微手术治疗椎管内肿瘤24例的临床效果
2021-01-09吴维宁芮翔宇田威王钢锐吴有志
吴维宁, 芮翔宇, 田威, 王钢锐, 吴有志
椎管内肿瘤占中枢神经系统肿瘤的13%~16%,其可发生在椎管内的任何位置,根据生长部位的不同,可将椎管内肿瘤分为硬膜外肿瘤、髓外硬膜内肿瘤及髓内肿瘤。椎管内肿瘤常进展缓慢,病程较长,一般以压迫脊髓和神经根引起疼痛为首发症状,其次是感觉和运动障碍,大小便功能障碍。尽可能的手术全切是提高椎管内肿瘤预后的关键方案[1]。手术方式常规行后正中入路,包括全椎板开放入路和半椎板开放入路。随着显微外科手术的理念更新和术中电生理监测手段的发展,手术从追求全切逐渐转为保证功能同时尽可能多切,降低术后并发症。总结归纳椎管内显微手术的经验技巧有助于提高椎管内肿瘤的手术质量。我院神经外科近两年已采取后正中入路显微手术治疗椎管内肿瘤患者24例,效果较好,报道如下。
1 资料与方法
1.1 临床资料 选取南京医科大学附属南京医院神经外科2016年1月至2018年12月收治的椎管内肿瘤患者24例。纳入标准:腰椎磁共振检查提示椎管内占位,无手术禁忌的患者。排除标准:存有脑部病灶引起的肌力下降、感觉麻木等神经功能障碍者。24例中男6例,女18例;年龄17~86(56.0±14.6)岁。病程2个月~4年,平均病程11.8个月。临床表现:神经根痛18例,感觉异常11例,运动障碍16例,排尿障碍5例。病灶部位:颈椎4例,胸椎11例,腰椎7例,胸腰椎2例。其中髓外硬膜下肿瘤21例,髓内肿瘤3例。单发肿瘤22例,多发肿瘤2例。所有患者术前均行增强磁共振检查,明确肿瘤累及部位、脊髓受压移位、椎间孔扩大、骨质侵蚀及椎体破坏等征象。
1.2 手术方法 24例全部采用后正中入路,术前采用X线定位,将美蓝注射于病灶所在椎体棘突,便于术中辨识。11例监测运动诱发电位(MEP),将电极置于合适位置,按照说明书设置刺激频率、强度和持续时间,麻醉尽量减少肌松剂的使用。诱发电位波幅下降超50%以上报警。以病灶为中心作后正中直切口。根据病灶大小及部位,选择合适的暴露范围。当病灶较小、偏于一侧时,可分离一侧椎旁肌肉,半侧椎板牵开暴露,关节突内侧骨质用金刚钻开槽,向内侧铣除至棘突根部分骨质。清理黄韧带及硬膜外脂肪,形成手术骨窗。当病灶瘤体较大,单侧显露较为困难,为完整切除则行全椎板暴露,铣除范围为双侧关节突内侧,轻撬离断椎板,切除上下节段的棘上及棘间韧带,完整取下椎板。本组中11例行半椎板暴露,13例行全椎板暴露。正中切开硬脊膜并向两侧悬吊,缓慢释放脑脊液后即可完成暴露。病灶切除后连续严密缝合硬脊膜,硬膜外予以脊柱膜贴敷。查无脑脊液渗出后行椎板复位,全椎板暴露超过3个节段者,需行椎弓根螺钉内固定。严密缝合椎旁肌、皮下组织和皮肤,不留死腔。若缝合严密,止血彻底,无需放置引流管。术后常规行激素及扩血管药物治疗以改善脊髓微循环等,早期下床活动,戴颈托或胸腰束带制动2~3个月。
1.3 随访及脊髓功能评估方法 采用门诊复诊、电话随访等方式获得患者McCormick脊髓功能评分。McCormick脊髓功能评分共分为4级[2]:Ⅰ级:神经功能正常,轻度局灶功能异常,但不影响患肢肢体功能,轻度痉挛或反射异常,步态正常;Ⅱ级:感觉运动损害的表现影响患肢肢体功能,轻度到重度步态费力,严重的疼痛或感觉迟钝影响患者的生活质量,但仍然能独立行走;Ⅲ级:比较严重的神经功能损害,需要手杖支持辅助行走,或明显的双上肢功能损害,可以或者不能自理;Ⅳ级:十分严重的神经功能损害,无法行走,需要轮椅,或者手杖助行合并双上肢功能损害,不能独立活动,需要依靠他人辅助。术后症状根据McCormick脊髓功能评分分为缓解(级别降低)、无变化(级别无改变)及加重(级别升高)。
1.4 统计学方法 采用SPSS 22.0软件对术前术后McCormick脊髓功能评分进行Wilcoxon符号秩和检验,P<0.05为差异有统计学意义。
2 结果
24例患者的肿瘤均于显微镜下切除,肿瘤横截面若占据超半个椎管以上,选择全椎板暴露;反之则半椎板暴露。若肿瘤纵截面超过3个椎体节段以上,则需要暴露多个节段椎板,切除完成后行椎弓根螺钉内固定(见图1)。手术时间90~240 min,平均(143.6±31.7)min。行全切除21例(87.5%),其中髓外19例,髓内2例;次全切除3例(12.5%),其中髓外2例,髓内1例。髓外肿瘤与脊髓粘连较紧,肿瘤质地偏硬,无法全切;髓内肿瘤分界欠清,切除过程中出现电生理监测变化故残留部分。术后病理显示:神经鞘瘤12例,脊膜瘤6例,室管膜瘤2例,星形细胞瘤1例,脂肪血管瘤1例,副神经节瘤1例,神经纤维瘤1例。
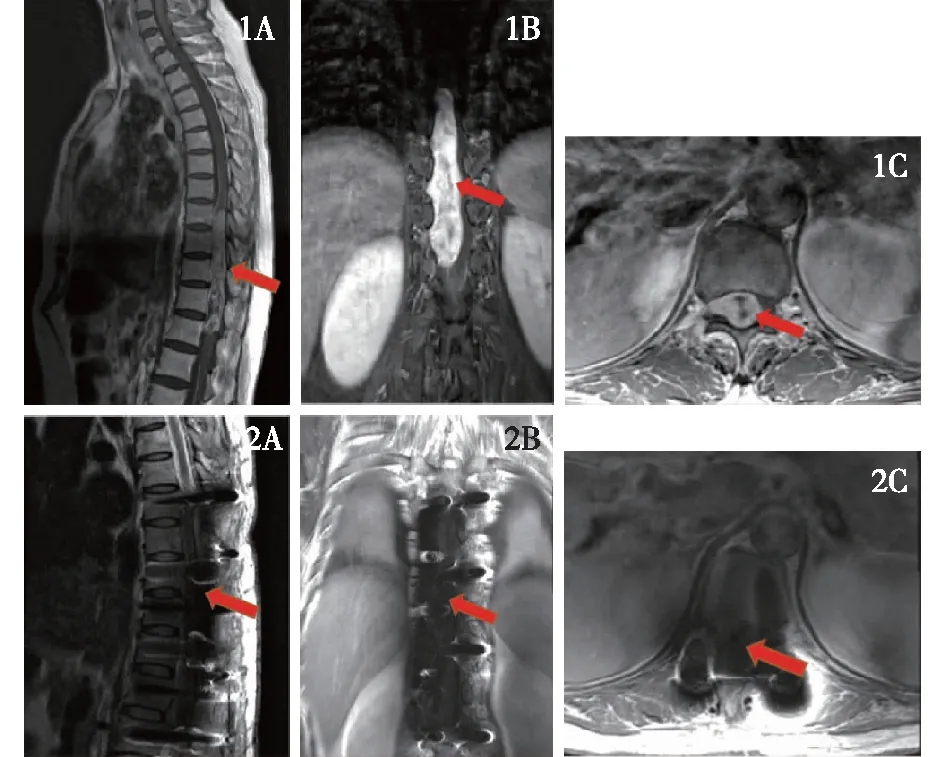
1A:矢状面显示椎管内长度涉及4个半椎体的巨大神经鞘瘤(红色箭头所指高度信号影为肿瘤);1B:冠状面显影巨大神经鞘瘤占据全椎管,病灶占据整个椎板下的空间,单侧椎板暴露较困难(红色箭头所指高度信号影为肿瘤);1C:横截面上显示脊髓被肿瘤推挤到一侧几乎被压扁(红色箭头所指高度信号影为肿瘤);1D:矢状面显示椎管内长度涉及4个半椎体的巨大神经鞘瘤切除完全(红色箭头所指为原肿瘤所在位置,上下椎体行椎弓根螺钉内固定);1E:冠状面显示巨大神经鞘瘤完全切除后表现(红色箭头所指为肿瘤所在位置,未见肿瘤残余强化,脊髓受压恢复);1F:横截面显示巨大神经鞘瘤完全切除后表现(红色箭头所指全椎板暴露切除)。
术后2周(出院时),24例患者的McCormick脊髓功能分级:Ⅰ级15例,Ⅱ级2例,Ⅲ级3例,Ⅳ级4例,与术前评分比较,可见Ⅱ级患者明显减少,Ⅰ级患者增多,常见于肌力和神经根痛的改善,但有3例症状加重,故影响整体效果,Wilcoxon符号秩和检验未见明显差异(Z=0.791,P=0.429,表1)。术后伤口延迟愈合3例,无硬膜内出血和感染患者。
24例患者均完成术后随访,随访时间3~48个月,平均6个月。末次随访McCormick脊髓功能分级:Ⅰ级16例,Ⅱ级7例,Ⅲ级1例,Ⅳ级0例,与术前差异有统计学意义(Z=3.419,P=0.001,表1)。3例症状加重患者均有不同程度缓解。

表1 患者手术前后McCormick脊髓功能分级(n=24)
3例症状加重患者中1例是T4节段神经鞘瘤,脊髓长期受压,术中减压后有缺血再灌注损伤及术中牵拉。切除后出现较长时间的双下肢活动不能,随访8月余肌力恢复正常;1例是C7椎管内外沟通性神经鞘瘤,因与脊髓粘连较紧,术后出现一侧肢体活动不能,随访12个月肌力恢复至术前3级;1例L3马尾神经鞘瘤因肿瘤较硬且与周围神经根粘连较紧,未能全切,术后出现感觉括约肌障碍伴大小便失禁,随访12个月大小便失禁症状缓解,但神经痛症状未见明显改善(表2)。所有患者远期均无脑脊液漏、脊柱后凸畸形及脊髓栓系等并发症。1例未全切的髓外肿瘤术后随访1年余发现复发并予以再次手术切除。

表2 3例症状加重患者的临床资料
3 讨论
椎管内肿瘤通常包绕或毗邻脊髓和神经根,手术时需要在这些重要结构内和边缘操作,笔者结合近年工作经验,总结出下述手术技巧:①分离椎旁肌肉应保护关节囊,卸下椎板时避免波及关节突,避免术后脊柱畸形。②切开硬脊膜后注意保护蛛网膜完整,防止脑脊液过快流出造成脊髓疝出和下腔出血。③最大限度降低吸引器的吸力,减少双极电凝热量至6~8焦耳。④避免过度牵拉脊髓和神经根,出血时予以棉片轻压,尽量减少电凝烧灼次数。尤其胸髓T4~T6节段,因血供较差,灼烧此节段的微小血管常导致术后较长时间的截瘫[3],本组1例T4节段神经鞘瘤患者术后出现双下肢瘫痪,可能与术中此部位止血过度有关。⑤松解肿瘤周围的蛛网膜,小的肿瘤予以整块切除,大的肿瘤分块切除,质韧病灶予以激光刀辅助切除。⑥肿瘤切除后予以温生理盐水冲洗残留物和出血,松解受压脊髓部位的蛛网膜粘连部分,能有效降低术后发生脊髓栓系及脊髓空洞等并发症。⑦用5-0的poly线严密缝合硬脊膜,使用人工脊柱膜补片覆盖于硬脊膜上,逐层关闭肌肉、皮下软组织及皮肤,可减少术后脑脊液渗漏及脊髓栓系并发症。
神经鞘瘤的神经根可贯穿或毗邻肿瘤。贯穿型载瘤神经基本瘤化,切除后并无功能损伤。毗邻过路神经原则上尽量保留,应锐性分离,避免过度牵拉[4]。尤其注意颈膨大和腰膨大支配四肢活动的神经根,应仔细剥离肿瘤与神经根,不可盲目全切而破坏神经根[5]。肿瘤生长于脊髓背侧或马尾部,硬脊膜剪开即可暴露。而生长于脊髓腹侧,需剪断部分齿状韧带暴露,必要时磨除部分椎弓根及关节突,从侧方充分暴露病灶,予以分块切除。关节突磨除应慎重,如果必须磨除,应于术后行内固定。脊膜瘤的血供源于硬脊膜,对硬脊膜的正确处理可以有效降低术中出血和术后肿瘤复发,对于基底位于脊髓背侧,环状切开肿瘤边缘的硬脊膜可降低肿瘤血供,再予以人工硬膜修补;对于基底位于脊髓腹侧,因暴露困难,应选择灼烧肿瘤促其缩小,再从硬脊膜上剥离,最后灼烧附着点硬脊膜[6]。髓外肿瘤因与脊髓分界清,若肿瘤残留极容易复发,应做到全切。当然若术中因肿瘤包绕血管或神经无法做到全切者,应行磁共振成像严密监测肿瘤生长情况,必要时行放射治疗。本组2例未能全切的髓外肿瘤,1例术后复发,予以再次手术。
术中运用体感诱发电位(SEP)监测脊髓后束的感觉传入功能,MEP监测皮质脊髓束功能,能够提高脊髓手术操作的安全性,但单一使用SEP不能反映运动功能,对单个脊神经刺激反应较差;单一使用MEP则存在受麻醉时神经肌肉阻滞影响较大的缺点[7-8]。有研究建议综合使用SEP和MEP可提高脊髓手术全切率和功能保护[9]。本组髓外肿瘤患者中有9例采用MEP监测,术后均未出现功能障碍,而未采用MEP监测的12例患者中有2例神经鞘瘤,因肿瘤偏硬,与脊髓存在明显粘连以及牵拉时力度偏大,造成术后脊髓较长时间内的功能障碍。
髓内肿瘤最常见的为室管膜瘤,其次为星形细胞瘤[1]。手术切除仍是治疗髓内肿瘤的主要手段。手术切除的难易度取决于肿瘤与脊髓之间是否有明确的分界面。通常从脊髓后正中髓沟进入,术后一般只造成深感觉功能障碍,后续行康复锻炼均能短期内恢复功能[10]。若肿瘤已经突出脊髓表面,应从肿瘤最接近脊髓表面的无血管处进入。若肿瘤位置较深,脊髓切开后查找困难,可以借助术中超声辅助定位。切除原则从瘤体中心分块切除,向四周及底部接近正常脊髓界面,囊变仅做引流处理,而不切除囊壁[11]。星形细胞瘤常分界不清,颜色与正常脊髓接近,需要术者根据经验判断是否到界。电生理监测下行髓内肿瘤切除具有更高的安全性。因后正中髓沟的切开操作,干扰脊髓后束传导,SEP往往假阳性率较高,MEP更能直接反映脊髓运动束的功能。同时比起传统的电极置入效应肌群的MEP,将电极放置入硬脊膜下(外)所显示的D波MEP,不受全身麻醉或肌松药的影响,常常与肌肉MEP联用[12]。研究表明术中的肌肉MEP完全消失且D波幅度下降达到50%,术后将会有较长时间的运动功能缺损[13]。故术中发生肿瘤组织辨识不清或监测运动电位改变,建议立即停止手术,做部分切除,术后行放化疗。肿瘤切除后脊髓内严密止血。本组中3例髓内肿瘤有2例行MEP监测,1例未行,术后运动功能均良好,本体感觉障碍在3个月内均得到不同程度缓解。
术后必须重视脊柱稳定性重建,研究显示全椎板切除会影响腰椎的稳定性[14],故对于脊髓一侧的髓外肿瘤,笔者采用半椎板入路切除,仅分离椎旁肌,棘突予以保留。优势在于术后对脊柱稳定性的影响小,无需内固定,也可降低手术区周围瘢痕增生所致的医源性椎管狭窄的发生概率。当病灶位置居中或较大时,盲目追求半椎管入路切除会导致操作视野受限,过度牵拉脊髓造成术后严重的功能障碍,仍应采用传统全椎板切除入路进行手术。术后根据暴露椎体节段来决定重建方式,一般当≥3个椎体的全椎板暴露,术中使用椎弓根螺钉内固定,<3个椎体的全椎板暴露,可使用连接片和钛钉行椎板复位,其主要目的是降低医源性椎管狭窄的发生率[15];本组患者中有2例因节段较多,术中行内固定;其余均行半(全)椎板暴露+椎板复位,术后随访均无脊神经牵拉痛和脊柱后凸畸形表现。
综上所述,对于椎管内肿瘤,在追求全切的同时,应重视对术中脊髓和神经根功能的保护,以及术后脊柱稳定性的维持。采用合适的椎板暴露,正确的显微切除方式,术中电生理监测,以及术后椎体重建方法等均可提高手术切除的精准度和安全性,减少脊髓神经损伤,降低术后并发症。
