难治性小儿肾母细胞瘤中TOPO Ⅱα的表达及其与临床病理特征和预后的关系
2021-01-09孟德光王佳荣常晓峰韩炜史奎滕怀炟赵曼
孟德光, 王佳荣, 常晓峰, 韩炜, 史奎, 滕怀炟, 赵曼
肾母细胞瘤又称威尔姆斯瘤(Wilms’ tumor,WT),是一种幼儿常见的、源于肾脏胚基细胞的泌尿生殖系统恶性肿瘤。WT占小儿实体瘤的6%,占小儿肾脏肿瘤的95%,多发于5岁之前的儿童时期,尤以2~3岁时发病率最高[1-2]。WT的发病症状通常表现为腹部肿胀、腹痛、血尿等,约有20%的患儿表现出高血压等症状。WT具有生长速度快、恶性程度高、发生转移早等特点,通常血行转移至肝脏和肺[3]。难治性WT是指WT患者在术后出现肿瘤复发的情况。目前临床上对难治性WT的治疗方法主要是瘤体的二次切除结合术后放疗或化疗,但是由于瘤体二次切除手术的难度较大,化疗敏感性较低,且复发瘤体广泛浸润生长,因此患者预后效果不佳[4]。随着分子生物学技术的提高,已有相关研究发现DNA拓扑异构酶-Ⅱα(Topoisomerase-Ⅱα,TOPOⅡα)的表达异常与多种实体肿瘤如脑胶质瘤、神经母细胞瘤、乳腺浸润导管癌等密切相关[5-7]。TOPOⅡα参与调节DNA双螺旋结构,是调控核酸空间结构、控制核酸生理功能的一种关键酶,存在于多种增殖细胞中,且呈现出周期特异性表达[8]。但有关TOPOⅡα在难治性WT中的表达及其与临床病理特征和预后关系的报道较为少见。本研究通过检测难治性WT肿瘤组织和癌旁组织中TOPOⅡα的表达,并进一步分析其与难治性WT患者临床病理特征及预后的关系,以期为研究难治性WT的发生发展机制和后续治疗提供临床依据。
1 资料与方法
1.1 一般资料 收集2017年7月至2018年7月于保定市儿童医院治疗且具有完整临床和随访资料的62例难治性WT患儿的肿瘤组织标本,同时收集58例癌旁组织为对照。62例患儿中男32例,女30例;年龄1~7(3.2±0.6)岁;均经病理、实验室检查及影像学证实为WT术后复发。收集患儿临床资料,包括年龄、性别、病理类型、肿瘤直径、淋巴结转移、肿瘤分期、肿瘤位置、复发转移等。其中病理类型包括预后良好型和预后不良型,预后良好型包括胚芽型、上皮型、间叶型和混合型,预后不良型主要指间变型和未分化型。本研究经保定市儿童医院医学伦理委员会批准,患儿监护人均签署知情同意书。
1.2 研究方法 所取得的肿瘤组织和癌旁组织(距肿瘤边缘>5 cm的正常组织)经固定、包埋、切片后行免疫组织化学染色,检测TOPOⅡα的表达情况。所有实验操作均严格按照免疫组化试剂盒说明书执行,免疫组化试剂盒购于北京鑫诺生物技术有限公司。染色结果由两位或两位以上病理科医师进行判定。以细胞核或部分胞浆内出现黄色或棕褐色颗粒判定为阳性细胞。染色评分:棕褐色3分,棕黄色2分、淡黄色1分;阳性细胞占比评分:高于80%为4分,51%~80%为3分,11%~50%为2分,0%~10%为1分。染色评分与阳性细胞占比评分的积为最后得分,总得分≥6为高表达,<6为低表达。
随访:患儿均随访12个月,最后1例患儿随访时间截至2019年7月,失访者以失访时实际疾病状态计算。统计终点为复发、转移、死亡及带病生存。
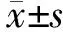
2 结果
2.1 难治性WT患儿中TOPOⅡα表达情况 难治性WT组患儿TOPOⅡα高表达率为59.68%(37/62),高于对照组的29.31%(17/58),差异有统计学意义(χ2=11.165,P<0.001),见图1。免疫组化检测各组病理组织中TOPOⅡα表达,TOPOⅡα高表达组中阳性细胞深染,多呈棕褐色,TOPOⅡα阳性细胞数为(84.03±10.64)个,高于对照组的(2.58±1.13)个和TOPOⅡα低表达组的(5.79±2.76)个,差异有统计学意义(t分别为57.923、53.401,P均<0.001),见图2。
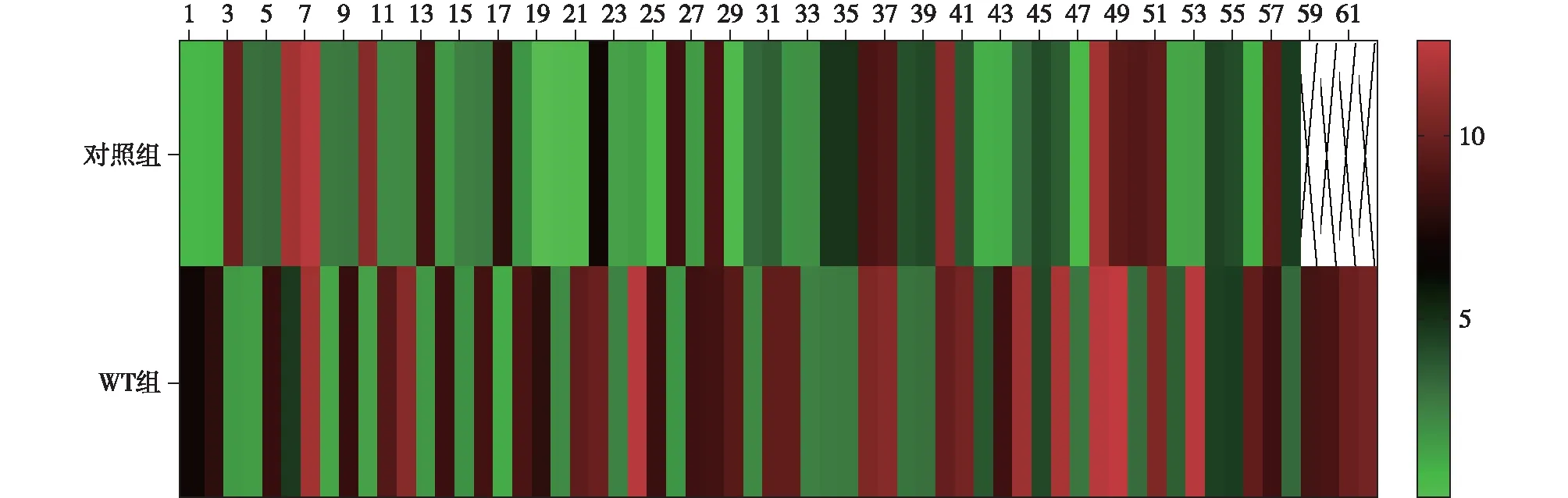
图1 难治性WT患儿的TOPOⅡα表达情况
2A:对照组中TOPOⅡα表达情况;2B:难治性WT患儿组TOPOⅡα低表达;2C:难治性WT患儿组TOPOⅡα高表达
2.2 TOPOⅡα表达与难治性WT患儿临床病理特征的关系 在WT病理类型为预后不良型、有淋巴结转移、肿瘤分期为Ⅲ或Ⅳ期、有复发转移的患儿中,TOPOⅡα高表达率较高(P<0.05)。患儿的年龄、性别、肿瘤直径、肿瘤位置与TOPOⅡα表达高低无关(P>0.05),见表1。
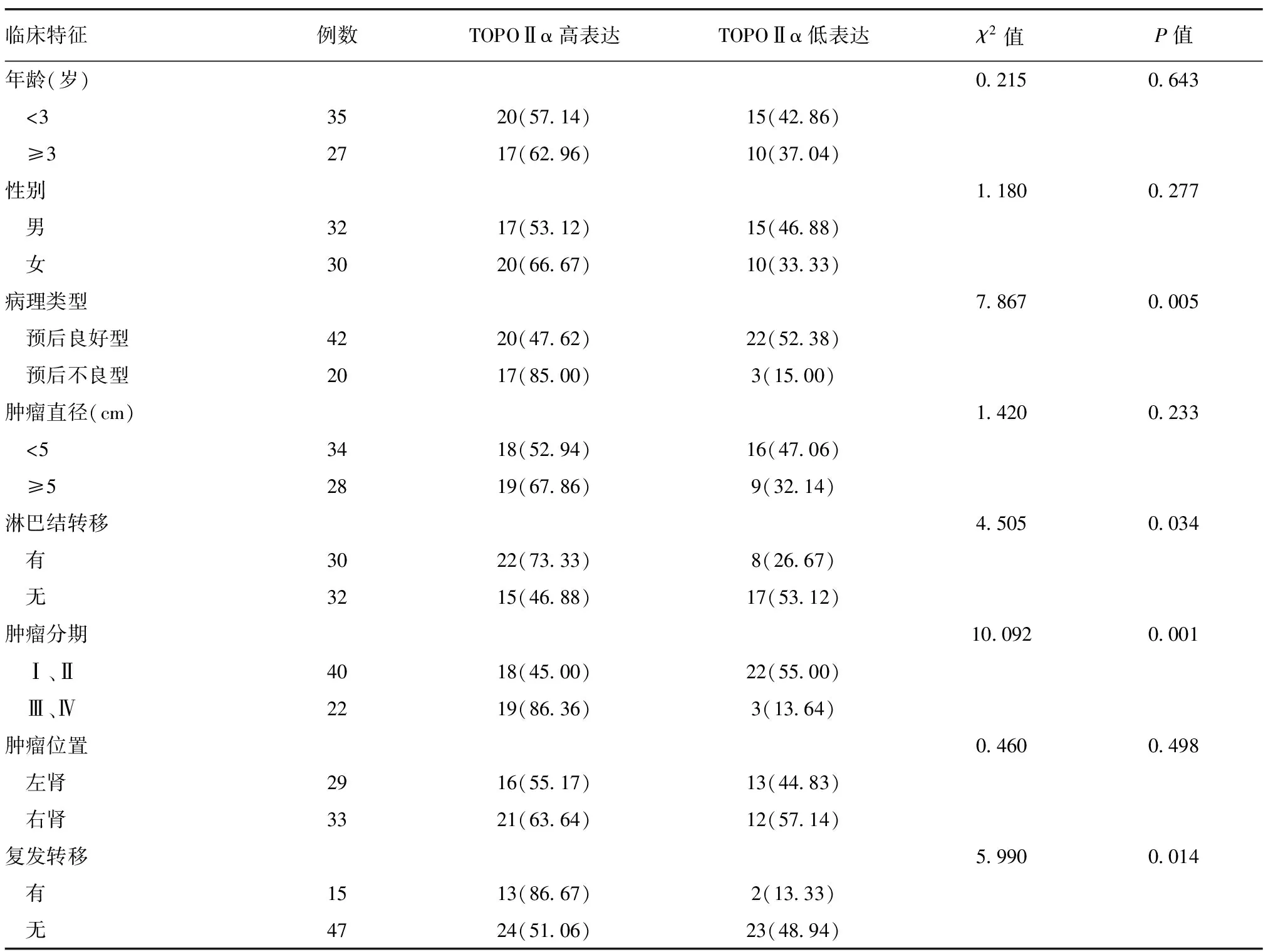
表1 TOPOⅡα表达与难治性WT患儿临床病理特征的关系 [例(%)]
2.3 TOPOⅡα表达与难治性WT患儿临床病理特征的多因素分析 以TOPOⅡα表达为因变量(TOPOⅡα高表达=1,TOPOⅡα低表达=0),以病理类型(预后不良型=1,预后良好型=0)、淋巴结转移(有=1,无=0)、肿瘤分期(Ⅰ、Ⅱ=0,Ⅲ、Ⅳ=1)、复发转移(有=1,无=0)为自变量进行多因素Logistic回归分析,结果显示,患者的病理类型为预后不良型、肿瘤分期高是难治性WT患儿TOPOⅡα高表达的危险因素(P<0.05),见表2。
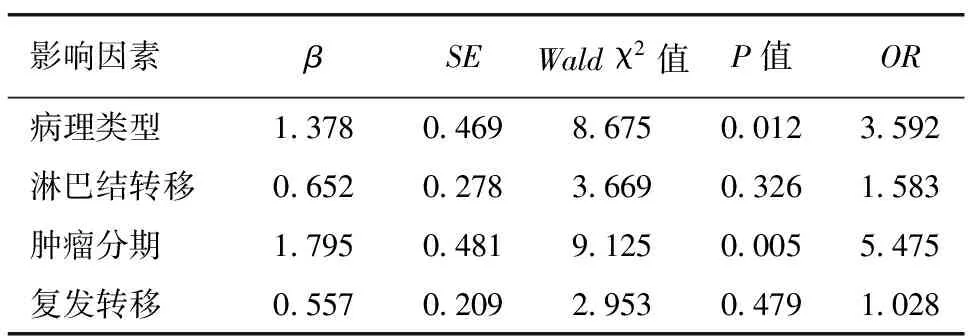
表2 影响难治性WT患儿TOPOⅡα高表达的多因素Logistic分析
2.4 TOPOⅡα表达与难治性WT患儿预后的关系截至2019年7月,62例难治性WT随访患儿中,失访5例,死亡26例。TOPOⅡα高表达组患儿的中位生存时间为27周,显著低于TOPOⅡα低表达组患儿的49周,差异有统计学意义(P=0.027),见图3。

图3 TOPOⅡα高表达与低表达难治性WT患儿的生存曲线
3 讨论
WT是幼儿腹部最常见的恶性肿瘤之一,其发病机制仍不明确,目前认为患儿体内癌基因的异常激活、抑癌基因的失活或缺乏、DNA复制或调控异常均与肿瘤的发生发展有关[9]。手术治疗、化疗和放疗是目前临床治疗小儿WT的常用方式,但这些治疗方式仍然存在多方面的问题,如未明确WT的具体发生发展机制、化学药物的不良反应及多种耐药机制等[10]。目前WT的治愈率虽然较高,但是仍有部分间变型肿瘤存在复发的情况,即成为难治性WT。难治性WT存在治疗难度大、治疗方法有限和患者预后较差等问题[11]。因此,除了应当掌握小儿难治性WT的标准治疗方法之外,更应当加深对难治性WT分子生物学水平上的认识和理解。随着人类基因组计划的发展及精准医疗时代的到来,分子检测成为临床诊治中必不可少的诊断手段[12]。相关研究发现,WT与ERCC1、TUBB3、TOPOⅡα等的表达关系密切[13]。
TOPOⅡα通过介导DNA的断裂并形成新的DNA-蛋白酶复合物来参与DNA的复制、转录和翻译过程,调控肿瘤细胞的增殖[14]。其编码的TOPOⅡα蛋白是ATP依赖的对细胞起关键作用的水解酶和合成酶,参与染色体浓缩及结果保持、染色体分离等重要过程。因此,在增殖活性异常升高的肿瘤细胞中TOPOⅡα表达显著升高[15]。本研究结果显示,难治性WT组患儿TOPOⅡα高表达率为59.68%,高于对照组的29.31%;TOPOⅡα高表达组阳性细胞数量多于对照组和TOPOⅡα低表达组,表明在难治性WT患儿中,存在TOPOⅡα的高表达。与陈永江等[16]的研究结果一致。此外,本研究发现随着肿瘤的预后不良及肿瘤分期的加重,WT患儿肿瘤组织中TOPOⅡα表达增高。
本研究结果显示,TOPOⅡα高表达组患儿的中位生存时间显著低于TOPOⅡα低表达组患儿。TOPOⅡα在难治性WT中的研究较少,但其在乳腺癌、膀胱癌中已有较深入的研究[17-18]。刘燕等[19]研究发现,87%的乳腺癌患者中存在TOPOⅡα阳性表达,且与人类表皮生长因子受体-2(HER2)的表达存在相关性,总体预后较差。在膀胱癌中,癌组织中TOPOⅡα阳性率显著高于癌旁组织,且TOPOⅡα高表达患者生存率较低、预后较差[20]。由此推测TOPOⅡα的表达与肿瘤患者预后生存期具有相关性。
综上,在难治性WT患儿中存在TOPOⅡα高表达。难治性WT患儿的病理类型为预后不良型、肿瘤分期高是TOPOⅡα高表达的危险因素。TOPOⅡα低表达组患儿的生存预后好于TOPOⅡα高表达组患儿。本研究纳入样本量较少,除了研究中纳入的影响因素外,可能还存在其他影响TOPOⅡα表达的因素,有待于日后扩大样本量对研究结果进行优化。此外,WT的发生发展是环境因素和多个基因共同作用的结果,受多种信号网络的影响,关于TOPOⅡα与其他基因或信号通路之间的关系尚待进一步深入研究。
