紫花杜鹃的HPLC指纹图谱及聚类分析
2021-01-08李川晶南敏伦张家贺赫玉芳赵全成
李川晶,孙 琦,南敏伦,白 雪,张家贺,赫玉芳,5,赵全成
(1吉林农业大学·吉林 长春 130118;2吉林正容医药发展有限责任公司·吉林 敦化 133700;3吉林省中医药科学院·吉林 长春 130012;4吉林吉春制药股份有限公司·吉林 四平 136504;5长春中医药大学·吉林 长春 130117)
紫花杜鹃为杜鹃花科植物紫花杜鹃(RhododendronmariaeHance)干燥叶或带叶嫩枝[1]。被1977年版《中国药典》收载为药材品种。据研究表明紫花杜鹃具有抑菌抗炎、抗血小板聚集、镇痛的功效[2-3],临床应用治疗慢性支气管炎。目前对紫花杜鹃质量控制的研究主要集中在槲皮素的含量测定,但是单一成分含量不能作为评价药材质量好坏的依据,《中国药典》也未有紫花杜鹃质量标准的规范,导致紫花杜鹃质量不可控,所以本文选取3个省份4个产区共13批药材样品对其中6种成分进行指认,有利于控制紫花杜鹃质量,为该药材进一步的开发研究提供有效依据。
由于中药材组分复杂,建立有效的检测方法极其重要,黄辉强等运用超高效液相色谱与串联四级杆飞行时间质谱联用技术(UPLC/Q-TOF-MS)分析紫花杜鹃黄酮类成分[4],该技术有分离度高,速度快,灵敏度高等优点,但UPLC/Q-TOF-MS对于样品前期处理较复杂,检测成本较高,仪器设备不普遍,质量标准及含量测定的日常研究受到限制。因此,本文以指纹图谱对不同产地不同批次紫花杜鹃进行质量探究,指纹图谱从整体角度对药材质量的检测更完善,能系统的观察到中药所含的化学成分和含量,为进一步控制中药材的质量奠定依据[5]。
1 仪器与试药
1.1 仪器 Agilent 1220:安捷伦公司;BS 124S电子天平:METTLER TOLEDO 仪器有限公司;KQ-250A型超声波清洗器:北京科伟永兴仪器有限公司;XTP-500A高速多功能粉碎机:浙江省永康市红太阳机电有限公司。
1.2 试药 槲皮素、槲皮苷、金丝桃苷、芸香苷、山柰酚和齐墩果酸对照品:均购于中国食品药品检定研究院,批号分别为:100081-201610、111538-201606、110861-201310、111521-201205、110709-201206、100080-201610,;水为娃哈哈纯净水;乙腈、磷酸为色谱纯;实验所用紫花杜鹃药材于2018年4月—2018年6月采自3 个省份4 个产区,由吉林省中医药科学院赵全成教授鉴定均为杜鹃花科杜鹃属真品,13批样品的信息见表1。

表1 紫花杜鹃样品来源
2 方法与结果
2.1 对照品溶液的制备 精密称取芸香苷、金丝桃苷、槲皮苷、槲皮素、齐墩果酸和山柰酚适量,用甲醇溶解制备得到每毫升含芸香苷0.0 101 mg、金丝桃苷0.0 128 mg、槲皮苷0.0 753 mg、槲皮素 0.0 230 mg、齐墩果酸0.2 010 mg和山柰酚0.0 212 mg的对照品混合溶液。
2.2 供试品溶液的制备 紫花杜鹃药材干燥叶粉碎(过60目筛),取粉末0.5 g,精密称取,置锥形瓶中,精密加入甲醇50 mL,水浴回流1 h,放置室温,称定重量,用甲醇补足减失的重量,摇匀,微孔滤膜滤过,取续滤液,即得。
2.3 色谱条件 色谱柱为ACE C18(250 mm×4.6 mm,5 μm);流动相A(乙腈)、B(0.2%磷酸水),梯度洗脱:0~32 min A 由10%升至19%;32~50 min A由19%升至30%;50~60 min A由30%升至40%;60~70 min A由40%升至50%;70~80 min A由50%升至60%;80~90 min A由60%升至70%;90~100 min A 由70%升至90%;100~105 min A由90%降至10%;105~110 min A保持10%;流速为1.0 mL·min-1;检测波长为280 nm;柱温为30 ℃;进样量10 μL。
2.4 方法学考察
2.4.1 精密度试验 取S3样品,按“2.2”方法处理供试品溶液,以“2.3”项下色谱条件分别进样6次,结果目标峰相对保留时间的RSD<0.59%,相对峰面积的RSD<1.03%;表明本方法精密度良好。
2.4.2 稳定性试验 取S3样品,按“2.2”方法处理供试品溶液,以“2.3”项下色谱条件分别在0、2、4、8、16、24 h进样,检测目标峰,结果目标峰相对保留时间和相对峰面积的RSD均小于0.45%表明供试品溶液在24 h内稳定。
2.4.3 重复性试验 取S3样品,按“2.2”方法处理供试品溶液,以“2.3”项下色谱条件分别进样6次,结果目标峰相对保留时间的RSD<0.39%,相对峰面积的RSD<0.61%,表明本方法重复性良好。
2.5 指纹图谱分析
2.5.1 指纹图谱的建立 取13批紫花杜鹃供试液,按“2.3”项下色谱条件依次进样检测,色谱图见图1。用“中药色谱指纹图谱相似度评价系统”软件进行处理,确定16个共有峰见图2。

图1 13 批不同产地紫花杜鹃指纹图谱
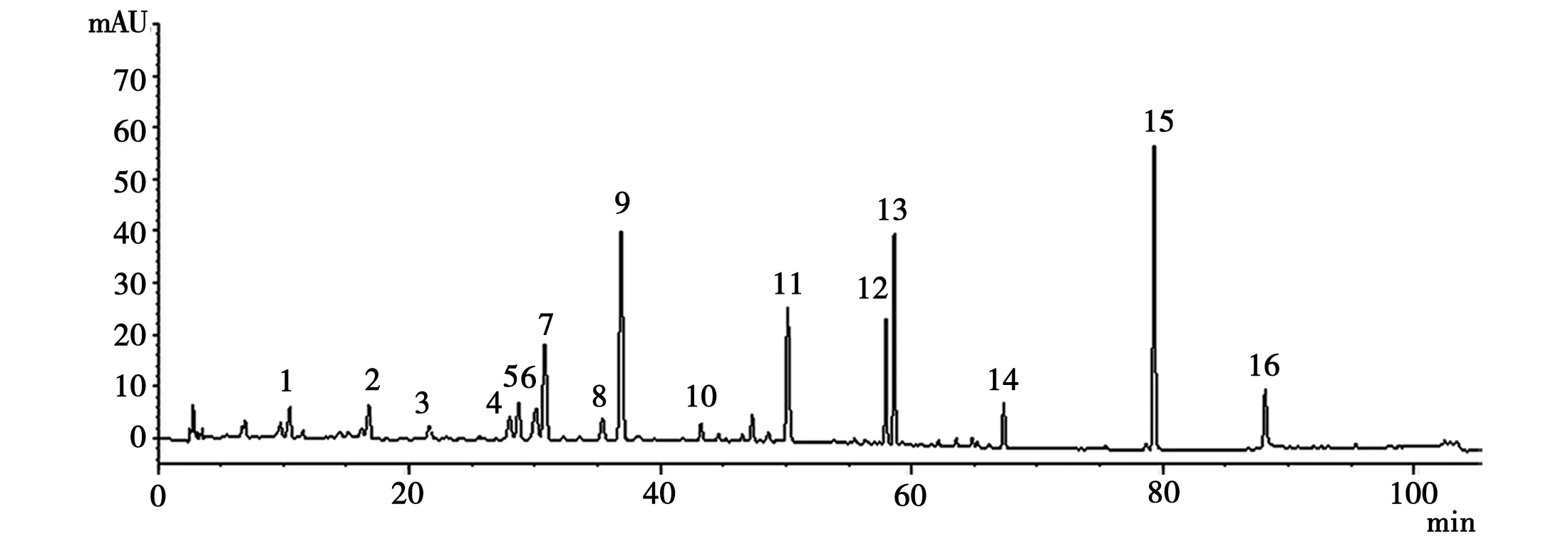
图2 紫花杜鹃指纹图谱共有模式图
2.5.2 色谱峰的指认 在16个共有峰参考下,经对照品的色谱图比对,确定6个色谱峰。见图3。
2.5.3 参比峰的选择 由于金丝桃苷在各批次紫花杜鹃中均含有,分离效果好、峰面积大,故选择金丝桃苷作为参比峰。
2.6 紫花杜鹃药材指纹图谱的评价
2.6.1 紫花杜鹃药材样品HPLC指纹图谱相似度评价 采用“中药色谱指纹图谱相似度评价系统”(2012版)对紫花杜鹃图谱分析处理,得到相似度评价结果见表2,相似度可以体现出不同产地不同批次样品之间成分和含量的相似程度,13批紫花杜鹃药材的相似度均在0.9以上,个别样品含量有差异,可能受样品产地和采摘时间的影响。

4.槲皮素;5.槲皮苷;9.金丝桃苷;11.芸香苷;12.山柰酚;16.齐墩果酸图3 高效液相混合对照品色谱图
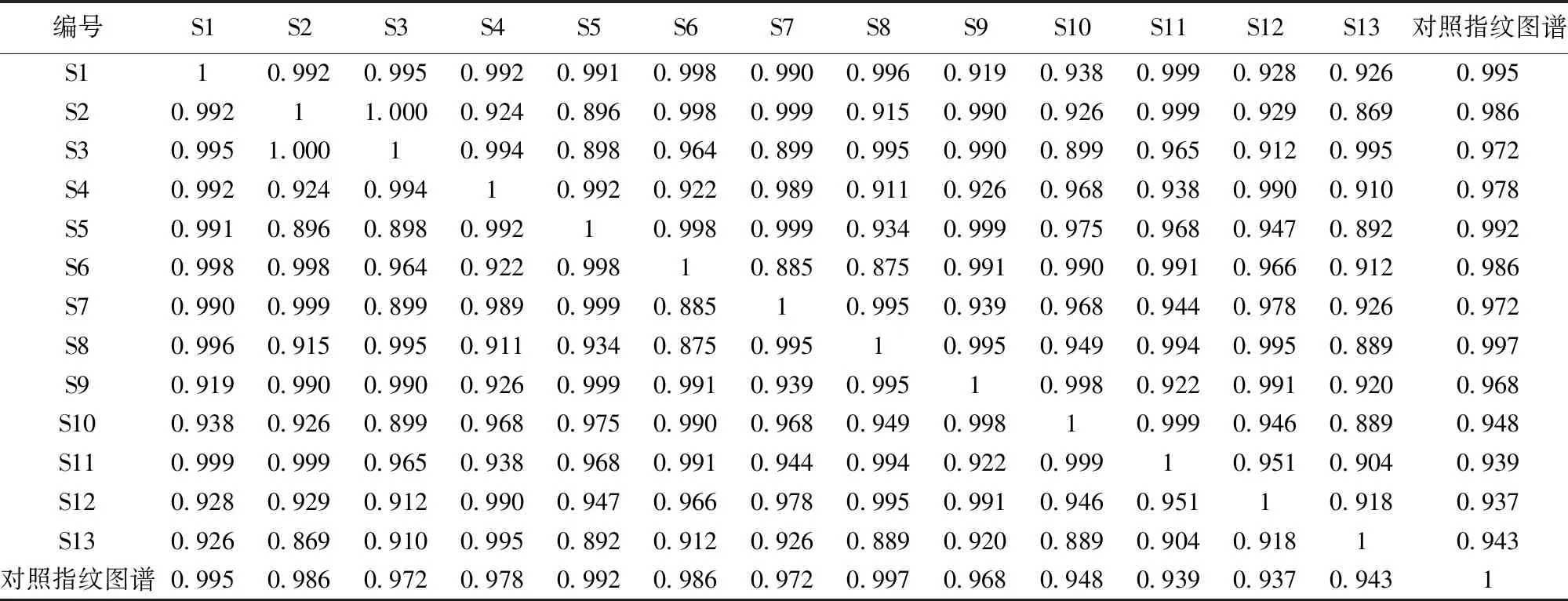
表2 13批紫花杜鹃药材样品相似度评价结果
2.6.2 各产地药材指纹图谱的聚类分析 以3个省份4个产区的13批紫花杜鹃样品进行指纹图谱的分析,应用SPSS 19.0软件分析[6],采用组间联结法,以欧式距离平方为度量标准,结果见图4。紫花杜鹃药材S1-S4首先聚为一类;其余批次为一类,在上述的分类基础上,其余批次分为两类,其中S5、S8、S1、S6、S2聚为一类,S4、S9、S7、S3聚为一类。
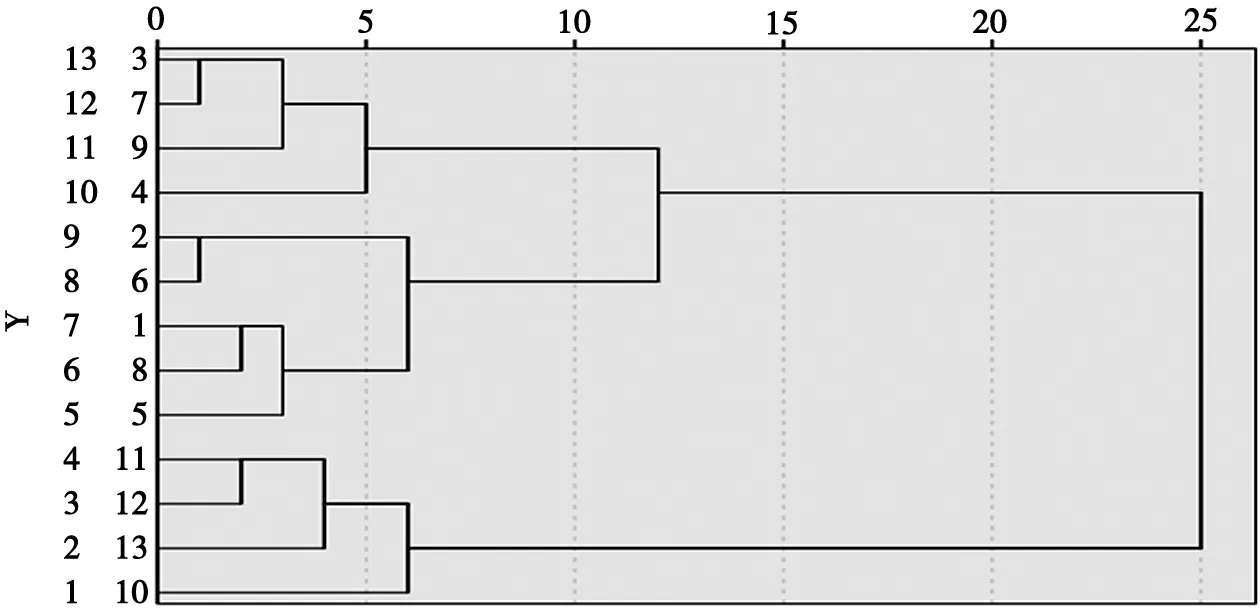
图4 紫花杜鹃样品聚类分析树状关系
3 讨论
3.1 提取溶剂和提取方式的选择 实验对比超声和回流2 种提取方法,超声虽操作简单,但峰个数极少,回流法提取效率更高;考察水、50%甲醇、甲醇、95%乙醇作为提取溶剂[7],结果表明水和95%乙醇作溶剂时,色谱峰数量少,50%甲醇、甲醇作溶剂时峰型较好,峰数量无明显差别,但甲醇作溶剂时色谱峰面积更大,故选择甲醇回流提取法。
3.2 色谱条件的优化 通过对甲醇-水、乙腈-水、甲醇-0.2%磷酸水和乙腈-0.2%磷酸水、4个流动相系统进行等度洗脱对比分析[8-9],结果显示达不到峰的有效分离,而且甲醇流动相比例过大会使UPLC柱压升高,基线不稳,故进一步对乙腈-水、乙腈-磷酸水进行梯度洗脱,结果乙腈-0.2%磷酸水流动相,峰数目多且分离度好。同时考察波长254、280、365 nm及柱温30 ℃和35 ℃对色谱峰保留时间的影响,结果显示本实验选用的色谱条件为最佳。
3.3 相似度结果及聚类分析方法评价 本文建立紫花杜鹃指纹图谱,从13批样品的重叠图谱中确定16个共有峰,与对照品图谱比较指认6种成分,每批样品非共有峰与总峰面积比值< 20%,符合指纹图谱要求。通过相似度和聚类分析的实验,结果表明13批紫花杜鹃样品相似度在0.939~1.000,不同地区的样品峰面积有差异,但共有峰保留时间的RSD无明显差别,说明不同省份及产区的成分相近,但含量不同,样品质量也存在差异。通过聚类分析图可见,13批紫花杜鹃聚为2 类,S10~S13为Ⅰ类,产自广东罗定样品相似度高,采摘期对成分基本无影响,质量较好;S1~S9为Ⅱ类,样品含量和成分受采摘期和产地气候影响有差别,Ⅱ类样品分别产自广东省、云南省、四川省,说明该地区间紫花杜鹃存在亲缘联系,可进一步探究,紫花杜鹃主采收期为5月份,广东罗定产区质量稳定,为紫花杜鹃药材的道地性提供科学依据,本实验操作简便实用性强,为紫花杜鹃药材的质量标准鉴别提供依据,为成分的进一步分析奠定基础。
