3株H9亚型禽流感病毒的分离与鉴定
2021-01-08吴忆春
吴忆春
(滨州职业学院生物工程学院,山东 滨州 256603)
禽流感(avian influenza,AI)是由禽流感病毒(avian influenza virus,AIV)引起的一种高度接触性传染病,可感染各种家禽和野禽。根据AIV致病性的不同可分为高致病性禽流感病毒和低致病性禽流感病毒,其中H9亚型AIV属于低致病性禽流感病毒[1]。H9病毒最早于1966年在患有温和呼吸道症状的火鸡中首次分离出来,我国最早于1994年由陈伯伦等[2]在蛋鸡产蛋量下降14%~75%的广东鸡场中首次分离。虽然H9亚型AIV对禽类造成的临床症状较温和,但其可以引起免疫抑制[1,3],常常与其他致病原混合感染加重疫病的危害程度,例如与大肠杆菌[4-5]、沙门菌[6]、呼肠孤病毒[7]等致病原的混合感染均对养殖业造成了巨大的经济损失。H9亚型AIV能与其他亚型AIV进行基因重组形成新型重组病毒[1,8],例如2013年以来国内发生的人感染H7N9高致病性禽流感病毒中,H9亚型AIV即向H7N9高致病性禽流感病毒提供了内部基因[9],因此H9亚型AIV对公共卫生安全可造成不容忽视的潜在威胁。H9亚型AIV经过数十年的遗传演化,目前已成为我国当前AIV流行的主要亚型,加强对H9亚型AIV流行毒株的分离鉴定和致病性研究对我国AI综合防控具有重要的理论和现实指导意义。鉴于此,本研究对山东地区疑似H9亚型AIV感染的3份病料进行了病毒分离、HA基因序列分析、致病性分析、交叉保护性分析等系列试验研究,最终获得了3株H9亚型AIV流行毒株,为探讨我国H9亚型AIV流行与遗传变异规律,研究H9亚型AIV抗原差异性,指导H9亚型AIV免疫预防工作奠定了基础。
1 材料与方法
1.1 试验动物
SPF鸡、SPF鸡胚均购自济南斯帕法斯家禽有限公司。
1.2 主要试剂与疫苗
病毒基因组RNA提取试剂盒为AXYGEN公司产品;一步法RT-PCR扩增试剂盒、pMD18-T载体均为宝生物工程(大连)有限公司产品;柱式离心式DNA凝胶回收试剂盒、质粒小量提取试剂盒均为生工生物工程(上海)股份有限公司产品;禽流感(H9亚型)灭活疫苗(NJ01株)为山东绿都生物科技有限公司产品。
1.3 临床病料的采集与处理
对3份山东地区(滨州、东营、潍坊各1份)疑似H9亚型禽流感病毒感染的病料,无菌采集病死鸡的气管、肺脏、肾脏等病变组织,按1∶3比例加入灭菌生理盐水溶解、捣碎、碾磨,研磨后的组织匀浆经12 000 r/min离心15 min,吸取上清液经0.45 μm 滤膜过滤,滤液即为处理后的临床病料样品,用于后续的RT-PCR检测和病毒分离试验。
1.4 病毒分离
取处理后的临床病料样品2.0 mL,接种10日龄SPF鸡胚10个,0.2 mL/胚,接种后每天照胚观察鸡胚死亡情况,舍弃24 h内死亡胚,将24~120 h死胚放置4 ℃冰箱保存,120 h后收集死亡鸡胚尿囊液,并观察鸡胚的病变情况。按照同样的试验方法在鸡胚上连续传三代,无菌收集鸡胚尿囊液,-20 ℃保存备用。
1.5 血凝试验
取分离毒株的第三代鸡胚尿囊液,按照常规微量血凝试验操作方法测定其对1%鸡红细胞的凝集效价。
1.6 鸡胚半数感染量(EID50)的测定
取分离毒株的第三代鸡胚尿囊液,利用灭菌生理盐水将其依次作10倍系列稀释,每一个稀释度尿囊腔接种5枚10日龄SPF鸡胚,0.1 mL/胚,37 ℃孵育观察120 h,24 h以内的死胚弃去不计,记录24~120 h各稀释度鸡胚死亡情况。至120 h将全部鸡胚解剖,死胚与活胚均测定其对1%鸡红细胞的凝集效价,凝集效价大于等于1∶128即判为感染,按照Reed-Mench方法计算分离毒株的EID50。
1.7 HA基因序列分析
1.7.1 引物设计
根据GenBank中H9亚型AIV基因序列设计合成扩增HA基因全长引物,引物序列为H9-F:5′-ATGGAGACAGTATCAC-3′,H9-R:5′-TTATATACAAATGTTG-3′,预期扩增片段大小约为1 683 bp。
1.7.2 HA基因PCR扩增
分别取3个分离毒株的第三代鸡胚尿囊液200 μL,用病毒基因组RNA提取试剂盒提取病毒基因组RNA。利用一步法试剂盒扩增HA基因,反应体系为:2×Buffer 25 μL,上、下游引物各1 μL(20 μmol/L),酶1 μL,RNA 10 μL,补水至50 μL。一步RT-PCR反应程序为:50 ℃ 60 min;95 ℃ 5 min;94 ℃ 45 s,52 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。RT-PCR扩增结束后经核酸电泳观察扩增片段大小。
1.7.3 HA基因遗传变异特征
利用胶回收试剂盒对RT-PCR扩增的目的片段进行回收纯化,回收产物连接至pMD18-T克隆载体,连接产物转化大肠杆菌DH5α感受态细胞,利用质粒小量提取试剂盒提取重组质粒,克隆质粒分别命名为pMD-BZ、pMD-DY、pMD-WF,利用BamHⅠ、XhoⅠ进行双酶切鉴定,鉴定正确的重组质粒送生工生物工程(上海)股份有限公司进行测序测定。下载GenBank中登录的部分H9亚型AIV HA基因序列,利用DNAStar生物学软件将分离毒株HA基因测序结果与GenBank中登录的H9亚型AIV HA基因序列进行核苷酸同源性比较分析,并构建系统进化树。
1.8 致病性试验
将40只14日龄SPF雏鸡随机分为4组(A、B、C、D),每组10只SPF雏鸡,A、B、C组的10只SPF雏鸡以点眼、滴鼻方式分别接种3个分离毒株,0.2 mL/只,D组的10只SPF雏鸡以点眼、滴鼻方式接种灭菌生理盐水,各处理组分别置于不同隔离器中隔离饲养,观察至14 d,每日观察SPF雏鸡的精神状态、食欲以及呼吸道临床症状,记录发病和死亡情况。
1.9 交叉保护性试验
将分离毒株用终浓度为0.1%的甲醛灭活后,以1∶3的比例加入油相中,中速混合均匀后高速乳化,制备成油乳剂灭活疫苗。将150只21日龄SPF雏鸡随机分为5组,每组30只雏鸡,1~3组试验雏鸡分别胸部肌肉注射3个分离毒株制备的灭活疫苗,0.2 mL/只;第4组试验雏鸡胸部肌肉注射禽流感(H9亚型)灭活疫苗(NJ01株),0.2 mL/只;第5组试验雏鸡注射灭菌生理盐水,0.2 mL/只。至免疫后21 d,将每组的30只鸡随机分为3个小组,每个小组10只,3个小组分别攻击3个分离毒株。至攻毒后5 d,逐只采集各处理组SPF雏鸡的喉拭子和泄殖腔拭子,按照1.3的方法对采集的拭子进行处理,按照1.4和1.5的方法对处理后的拭子接种SPF鸡胚进行病毒分离和血凝性测定,通过病毒分离结果确定试验雏鸡的排毒情况,分析不同分离毒株与商品化疫苗的交叉保护情况。
2 结果与分析
2.1 病毒分离
3份临床病料样品接种SPF鸡胚后,SPF鸡胚均在接种后72~96 h全部死亡,无菌收集第三代鸡胚尿囊液,分别命名为BZ株、DY株和WF株。
2.2 分离毒株的血凝性
取分离毒株的第三代鸡胚尿囊液,按照常规微量血凝试验操作方法测定BZ株、DY株和WF株分离毒株对1%鸡红细胞的凝集效价分别为10log2、11log2和10log2。
2.3 分离毒株的EID50
按Reed-Muench法测定BZ株、DY株和WF株分离毒株对SPF鸡胚的EID50分别为10-8.83/mL、10-9.50/mL和10-9.0/mL。
2.4 分离毒株的HA基因序列
如图1所示,BZ株、DY株和WF株的HA基因RT-PCR扩增产物在1 683 bp处出现特异性扩增条带,扩增片段大小均与预期相符。如图2所示,克隆质粒pMD-BZ、pMD-DY、pMD-WF经BamHⅠ、XhoⅠ酶切后的酶切产物均具有大小为1 683 bp的特异性条带,与预期结果完全一致。HA基因核苷酸同源性比较和系统进化树分析分别如图3、图4所示,综合比较3个H9亚型AIV分离毒株与2010—2018年的部分H9亚型AIV分离毒株的基因组序列,BZ株、DY株、WF株分离毒株与2018年分离自上海的几株AIV(MK552788.1、MK552797.1、MK552786.1、MK053846.1、MK552795.1)亲缘关系较近,进化树处于同一分支。BZ株与DY株核苷酸同源性较高,达99.8%;WF株与BZ株核苷酸同源性达98.6%;WF株与DY株核苷酸同源性达98.5%。BZ株、DY株、WF株与2011年分离自广西的JF715044毒株同源性均较低,核苷酸同源性分别为86.8%、86.8%和87.0%,BZ株、DY株、WF株与大部分H9亚型AIV核苷酸同源性在93.6%~98.6%之间,从分子水平鉴定3株分离毒株均为H9亚型禽流感病毒。
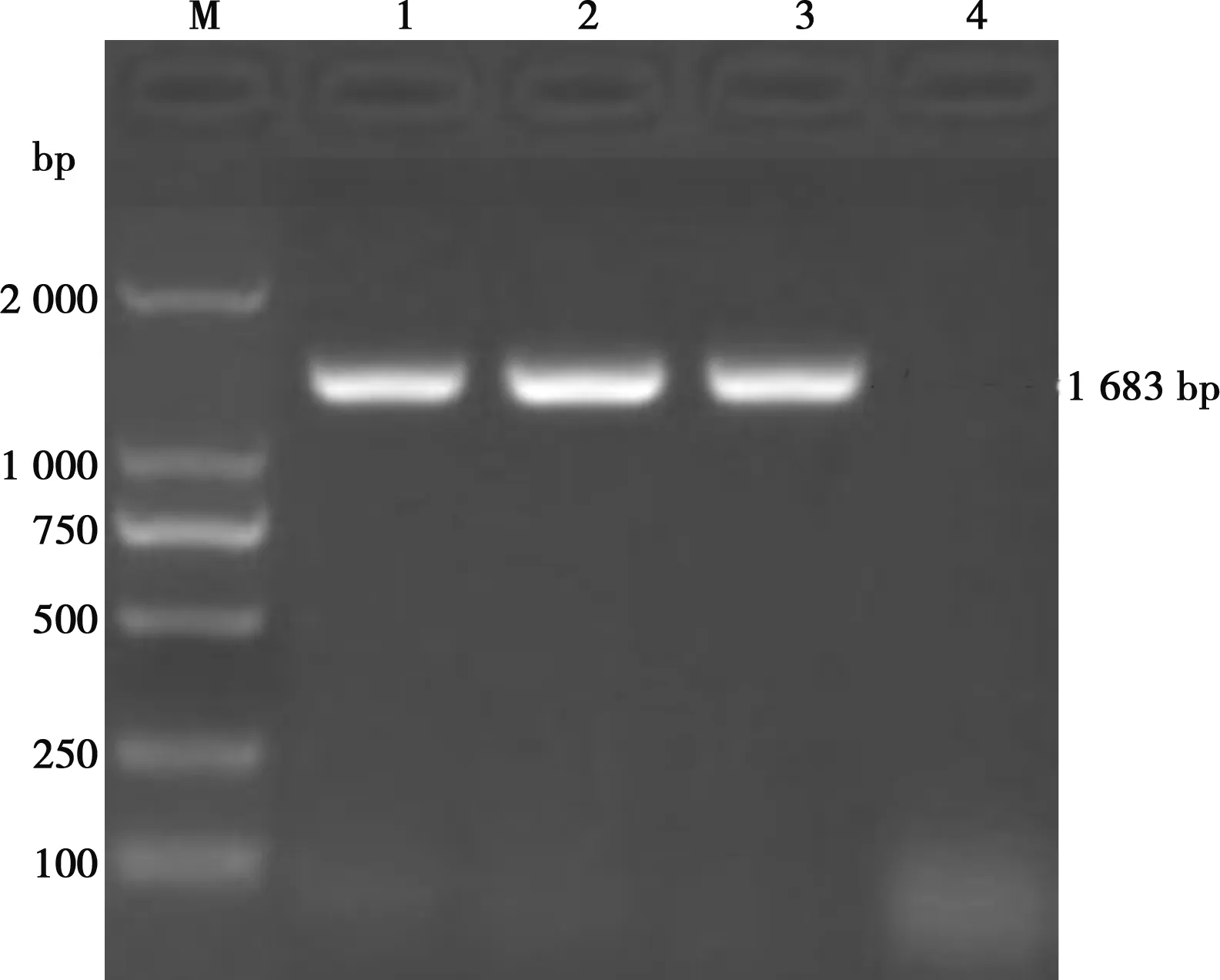
M. DL2000 Marker;1. BZ株;2. DY株;3. WF株;4. 阴性对照图1 HA基因RT-PCR扩增结果
M. DL2000 Marker;1. BZ株;2. DY株;3. WF株图2 重组质粒酶切鉴定结果

图3 分离毒株HA基因核苷酸同源性比较

注:•表示本试验分离株图4 分离毒株HA基因系统进化树分析
2.5 分离毒株的致病性
各处理组试验雏鸡的发病和死亡情况如表1所示,DY株攻击的10只试验雏鸡在攻毒后第3天即有部分SPF雏鸡表现出精神沉郁、食欲下降、以及咳嗽、喷嚏、甩头等呼吸道症状,随后症状逐渐加重,并伴随有绿色粪便排出,至攻毒后第8 天呼吸道症状逐步减轻,精神和食欲逐步恢复正常。DY株病毒攻击的10只试验雏鸡均发病,其中严重呼吸道症状发病率和轻微呼吸道症状发病率分别为70%和30%。BZ株、WF株攻击的10只试验雏鸡也有精神沉郁、食欲下降、以及咳嗽、喷嚏、甩头等呼吸道症状,但均较DY株攻毒鸡临床症状轻。BZ株、WF株攻击雏鸡后的发病率分别为80%和90%,严重呼吸道症状发病率分别为10%和20%,轻微呼吸道症状发病率均为70%。3个分离毒株攻击的试验雏鸡均未出现死亡,表明BZ株、DY株、WF株均为低致病性毒株,其中DY株的致病性稍微强于BZ株和WF株。

表1 试验雏鸡发病和死亡情况
2.6 分离毒株的交叉保护性
如表2所示,生理盐水免疫组的30只试验雏鸡经3株分离毒株分别攻击后,均能分离到病毒。在4个灭活疫苗免疫组中,只有禽流感(H9亚型)灭活疫苗(NJ01株)经DY株攻击后有1只雏鸡能分离到病毒,其余雏鸡经3株分离毒株分别攻击后均未能分离到病毒,说明3株分离毒株彼此之间均具有100%的交叉保护力,禽流感(H9亚型)灭活疫苗(NJ01株)对BZ株、WF株均具有100%的交叉保护力,对DY株具有90%的交叉保护力。研究表明,当前商品化H9亚型禽流感灭活疫苗对H9流行毒株仍具有较好的免疫保护效果。

表2 拭子病毒分离结果
3 讨论
AIV属于正黏病毒科A型流感病毒属,基因组包括8个单股负链RNA,依次编码聚合酶蛋白PB2、PB1、PA,血凝素蛋白(HA),核蛋白(NP),神经氨酸酶(NA),基质蛋白(M)和非结构蛋白(NS),其中HA蛋白是病毒最主要的2种表面糖蛋白之一,在AIV复制过程中起关键作用,直接参与AIV的致病过程,是AIV的主要毒力因子和保护性抗原。根据HA抗原性的不同可将AIV分为18种HA亚型(H1~H18)[10-12]。近年来H9亚型AIV疫苗免疫鸡群仍然不断发生H9亚型AIV感染,使得该亚型AIV的变异性研究成为热点。研究学者陆续进行了不同地区H9亚型AIV流行毒株HA基因的遗传变异监测。高绪慧等[13]对2017年山东地区16株H9亚型AIV流行毒株HA基因进行同源性分析,结果发现核苷酸序列同源性为91.2%~99.8%,氨基酸同源性为93.6%~100.0%,表明山东地区H9亚型AIV发生了部分新的遗传进化。万永虎等[14]对2015—2017年贵州省13株H9亚型AIV流行毒株HA基因进行遗传变异分析,证实均属于DK/HK/Y280/97分支,但HA基因核苷酸和氨基酸序列同源性分别为96.1%~99.9%和95.7%~100%,病毒一直处于不断的变异之中。仇微红等[15]对2013—2018年中国部分地区分离的69株H9亚型AIV的HA基因进行分析,69株毒株属于H9.4.2.5分支,核苷酸相似性为83.7%~99.9%,氨基酸相似性为85.8%~99.9%,与现有疫苗毒株核苷酸同源性存在较大的差异。本试验结果表明3株H9亚型AIV分离毒株与2018年上海分离毒株亲缘关系较近,HA基因核苷酸同源性较高,而与2011年广西分离毒株同源性较低,表明H9亚型AIV分离毒株HA基因呈现区域性分化的特点,其在我国随着流行时间发生了较大遗传分化。
H9亚型AIV分离毒株HA基因序列的变异是否引起分离毒株致病性的增加,以及现有商品化疫苗对流行毒株是否具有保护效果,这是对当前指导H9亚型AIV综合防控工作最为重要的。本研究交叉保护性试验结果显示,3株分离毒株彼此之间均具有100%的交叉保护效果,商品化的禽流感(H9亚型)灭活疫苗(NJ01株)对3株分离毒株的保护效果达90%~100%,说明当前商品化H9亚型AIV灭活疫苗对流行毒株仍然具有良好的免疫保护效果,也在一定程度上说明现有商品化疫苗能够满足H9亚型AIV流行毒株的疫病防控要求。对于当前H9亚型AIV疫苗免疫养殖场仍然发生H9亚型AIV流行的情况,分析可能与饲养管理不当、疫苗质量下降、免疫程序不合理、注射方法不准确、免疫抑制病感染等因素密切相关,而不能完全归结于H9亚型AIV流行毒株发生变异引起的免疫失败。
