棉花谷胱甘肽硫转移酶亚基编码基因GhGST3 的 抗黄萎病功能研究
2021-01-08马丽梅翁慧婷李志坤
李 扬,马丽梅,陈 悦,翁慧婷,李志坤
(河北农业大学 农学院,河北 保定 071001)
陆地棉是世界上耕种面积最大的棉花栽培种,生产过程中常因黄萎病发生而导致产量降低和纤维品质下降[1-2]。棉花黄萎病是由大丽轮枝菌侵染根部引起的一种土传真菌性维管束病害,也被称为棉花的“癌症”。目前,生产上还没有有效的防治药物和耕作方法可以防治黄萎病[3-5]。实践表明,通过选育和种植棉花抗病品种可以有效防治黄萎病[6]。克隆黄萎病抗性基因并解析其抗性机制是培育抗病品种的基础。课题组前期研究发现1 个谷胱甘肽硫转移酶基因簇在棉花黄萎病抗病反应中发挥了重要作用[7]。但该基因簇中单个基因的抗病功能和分子机制需要进一步研究。
谷胱甘肽S-转移酶(GST)是一组具有多种生理功能和各种生物体常见的胞质二聚体蛋白分子。它促进体内某些异型物质和内源性有害物质的亲电子基团与谷胱甘肽的巯基结合,后者可以分解或形成水溶性物质并从体内释放出来,近而达到解毒细胞的目的[8-9]。在植物中最早研究发现玉米GSTs在解毒除草剂过程中发挥了重要作用[10-11]。
谷胱甘肽硫转移酶编码基因属于多基因家族,其功能具有多样性。GST 可以在各种生物或非生物胁迫下诱导表达,增强植物对逆境的抵抗力,并且是抗氧化防御系统中的重要酶系统[12]。研究表明玉米中的GST-B和GST-Y基因在干旱胁迫条件下,酶活性显著增高,证明GST 在激活植物抗逆反应中起重要作用[13]。玉米中GST 蛋白能够催化谷胱甘肽与氯均三嗪阿特拉津结合,保护植物免受除草剂的伤害[11]。另有研究表明萝卜中RsGST1-1基因可能通过参与信号转导途径或与其他基因共同参与萝卜对不利重金属胁迫的防御,表明GST 在植物体中具有解毒作用[14]。而超表达拟南芥中的GST 基因能够减弱逆境对植物体内代谢活性的影响,使植物免受氧化损伤[15]。大豆根中发现,GSTs 能够促进大豆的生物固氮作用[16]。在水稻根中,2 个GST基因Osgstu3和Osgstu4受重金属和低氧诱导,同时也可响应盐胁迫[17]。水稻Lambda 类GST 家族成员在植物生长和发育以及对抗不同的生物和非生物胁迫方面起着重要作用[18]。研究发现,亚洲绵中Phi 类GST 基因GaGSTF9能够增强亚洲棉对黄萎病的抗性[19]。
项目组前期研究表明,植物中GST 基因被划分为9 类,其中tau 类GST 基因数目最多。并发现位于陆地棉A 亚组09 染色体上的一个tau 类基因簇(Gh_A09G1508,Gh_A09G1509和Gh_A09G1510)在进化过程中经历了正选择效应,并在棉花黄萎病抗性反应中发挥了重要作用[7,20]。但对该基因簇中单独基因的黄萎病抗性功能及机制还需进一步研究。本研究拟对抗病陆地棉品种ND601 中的Gh_A09G1510同源基因GhGST3(MK179292)进行克隆、黄萎病抗性及分子机制研究。
1 材料与方法
1.1 植物材料的培养
拟南芥和烟草种植于人工气候室(温度20 ~ 22 ℃,湿度70%~80%,光照强度5 000 Lux,光周期为16 h 光/8 h 黑暗)进行培养。
1.2 序列分析
在CottonFGD(https://cottonfgd.org/)网 站 下载G. hirsutum中Gh_A09G1510基因序列,CDS 序列及蛋白序列。利用DNAMAN 在CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 网站对Gh_A09G1510 蛋白序列进行结构域预测。在GSDS(http://gsds.cbi.pku.edu.cn/)网站进行基因结构分析。利用Cotton FGD 数据库对酵母菌阳性克隆片段进行序列比对分析。
1.3 基因克隆与原核表达分析
基于Gh_A09G1510基因序列设计ORF 克隆引物,在抗病陆地棉品种‘农大601’中克隆其同源基因GhGST3。将具有限制性位点的GhGST3基因片段连接至pEASY-T1 载体,并将测序的GhGST3与pET32a 载体定向连接,转化大肠杆菌TOP10,进行菌落PCR 和双重酶切。确认后,选择阳性克隆并提取质粒以表达蛋白。转化大肠杆菌BL21(DE3)。
在10 mL LB 液体培养基(含100 mg L 卡那霉素)中培养,在28 ℃下孵育直至OD 值为0.6 ~0.8,并通过IPTG 阶梯表达进一步富集诱导1、2、3 和4 h 后,取1 mL 细菌溶液。以相同的方式,在28 ℃下诱导空质粒pET32a 作为对照。离心1 mL 细菌溶液以收集细胞,弃去上清液,重悬细胞,离心上清液以进行蛋白检测,并继续用包涵体裂解液悬浮沉淀。测试包涵体蛋白。将上清蛋白和包涵体蛋白在100 ℃的水浴中煮沸10 min,12%SDS-PAGE 凝胶电泳,考马斯亮蓝染色,观察结果。
1.4 超表达载体的构建及纯系筛选
将GhGST3ORF 连 接 至 pMD19-T 载 体, 将pMD19-T-GhGST3载体和35s:XX 载体分别进行双酶切后,进行连接。将构建好的质粒35s:GhGST3转化至农杆菌感受态GV3101 中。利用农杆菌介导法转化野生型拟南芥。利用0.1%的Basta 进行纯系的筛选,利用载体特异性引物对T1代拟南芥进行PCR 检测,设计基因实时定量引物对纯系进行表达量检测。
1.5 大丽轮枝菌侵染与病指统计
大丽轮枝菌菌株临西2-1 培养于PDA 琼脂培养基(200 g/L 土豆,12.5 g/L 葡萄糖,15 g/L 琼脂)。将菌块接种于PDA 液体培养基中,25 ℃培养10 d。纱布过滤后,将菌液稀释至(0.94×107~1×107)[21], 用于接种。转基因拟南芥和野生型拟南芥每棵植株接种10 mL 孢子悬浮液。接种等量的水作为对照。将21 d 苗龄的转基因拟南芥和野生型拟南芥分别接种黄萎病菌,接菌25 d 时,统计病级及病指。
黄萎病病级统计及分析:总共分成5 个等级,0级:植株无发病症状,生长良好;1 级:25%的叶子发黄,呈现病态;2 级:25% ~50% 的叶片发黄,叶缘卷曲;3 级:超过75%的叶片枯萎发病,有少许叶片脱落;4 级:全株发病,叶片干枯脱落或整株死亡。病情指数的统计方法如下:病情指(Disease index)=[∑(发病级数×该级株数)]÷(调查总株数×4)×100
1.6 RNA 制备、cDNA 合成和实时定量PCR 分析
使用EASY Spin Plant(北京阿德莱德生物技术有限公司)的RNA 快速提取试剂盒进行RNA 提取,并使用PrimeScript® 第一链cDNA 合成试剂盒[Baori Doctor Biotechnology(北京)有限公司] 进行cDNA 合成,利用7500 实时荧光定量PCR仪(ABI,美国),使用荧光定量试剂盒(US EVERBRIGHT INC 公司)进行实时定量检测。AtTUB2为内参。
1.7 亚细胞定位载体的构建及观察
以含有GhGST3基因的质粒为模板,进行GhGST3基因的扩增,将PCR 产物和35s:XX-GFP载体分别进行双酶切后、进行连接。将构建好的质粒35s:GhGST3-GFP 和空载体质粒35s:XX-GFP 分别转化至农杆菌感受态GV3101 中。利用烟草进行瞬时表达。具体步骤为:将农杆菌进行扩繁,OD600达到0.8 左右。将菌液离心,5 000 r/min、10 min、 弃除上清,用蒸馏水重悬2 ~3 次。用缓冲液(10 mmoL/L MES、100 mmoL/L AS、10 mmoL/L MgCl2)重悬细胞沉淀(菌液∶缓冲液=1∶1),室温静置2 ~3 h 后,用1 mL 注射器,注射到烟草背面,并进行标记。遮光培养48 h 后,使用激光共聚焦显微镜FV10i(Olympus,Japan)观察GFP 表达情况。
1.8 酵母双杂交
PCR 扩增GhGST3ORF,并将其克隆到pGBKT7 中,将得到的重组质粒转化酵母菌株Y2HGold。检测其自激活活性和毒性。按照Matchmaker®Gold Yeast Two-Hybrid System 操 作 手 册 将 含 有 重 组 质粒的酵母菌株与本实验室已构建的海岛棉黄萎病菌诱导的cDNA 文库进行杂交。将杂交菌液依次涂布于DDO(SD / -Trp / -Leu),TDO(SD / -Trp /-Leu/ -His),QDO/X/A(SD / -Trp /-Leu/ -His / -Ade/X-a-Gal/AbA )进行筛选。利用特异性引物对阳性酵母菌进行PCR 检测。
1.9 KEGG 和GO 分析
对候选基因在http://kobas.cbi.pku.edu.cn/进行KEGG 和GO 分析[22]。
2 结果与分析
2.1 GhGST3 基因的克隆与生物信息学分析
本研究从抗病陆地棉品种ND601 中获得GhGST3ORF 全长序列,NCBI 注册号为MK179292。结果显示GhGST3基因全长651 bp,编码216 个氨基酸。基因结构分析显示GhGST3含有2 个外显子和1 个内含子(图1a)。结构域预测显示GhGST3 蛋白含有2 个保守结构域GST_N_Tau 和GST_C_Tau (图1b)。
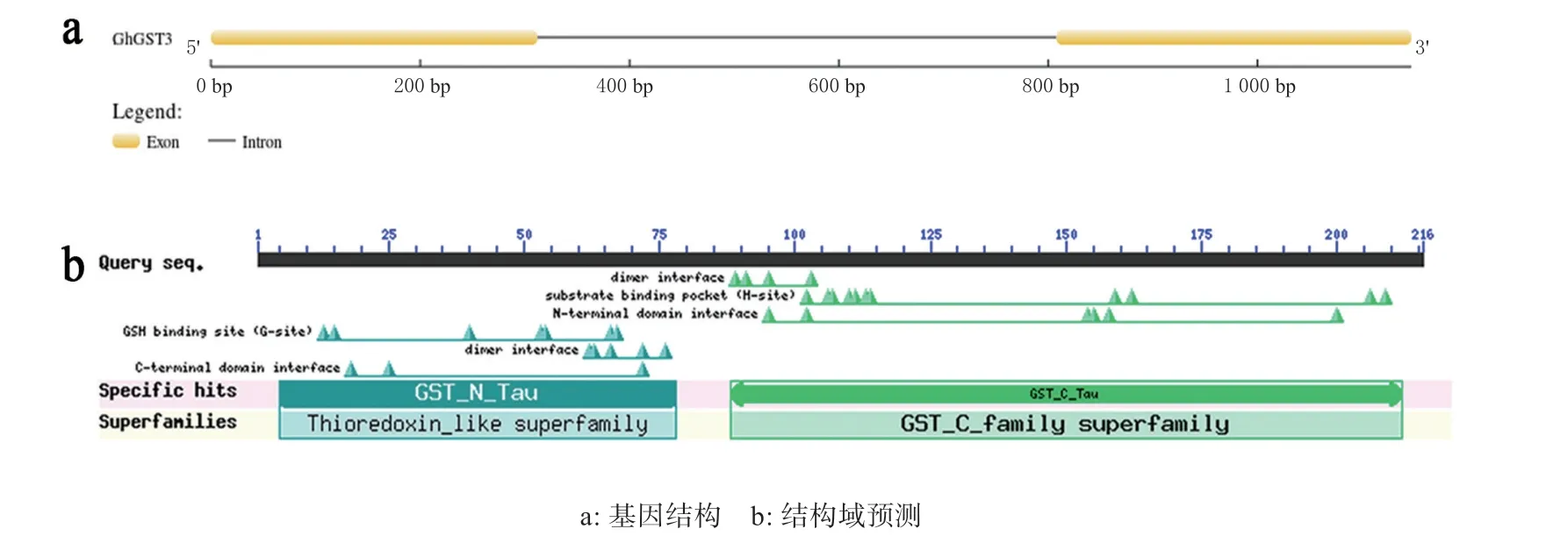
图1 GhGST3 基因序列分析Fig. 1 GhGST3 gene sequence analysis
2.2 超表达GhGST3 拟南芥黄萎病菌抗性鉴定
本研究获得了转GhGST3基因的拟南芥阳性植株(图2a),对T1代阳性植株进行PCR 检测,结果显示GhGST3基因成功转化到拟南芥基因组中(图2b)。继续筛选至T3代纯系后,对其进行GhGST3基因实时定量检测,野生型拟南芥中无表达,超表达拟南芥中GhGST3基因相对表达量达1.37(图2c),表明该基因在拟南芥中稳定表达。黄萎病抗性分析显示转基因植株较野生型植株黄萎病抗性明显(图2d)。病指统计结果显示转基因植株病指是32.8,野生型植株病指是82.8(图2e)。综合结果表明:超表达GhGST3基因后,可以增强植株的黄萎病抗性。
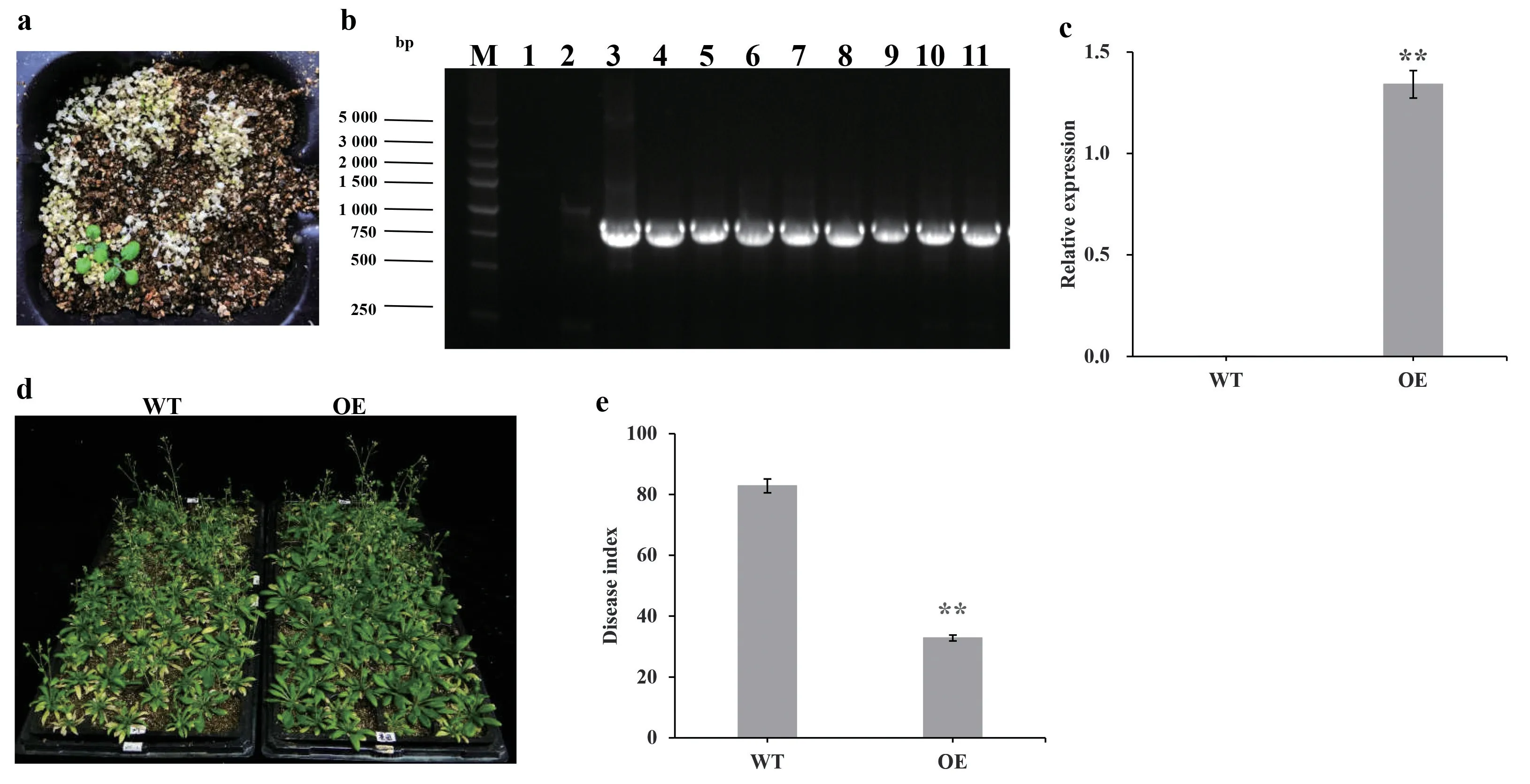
图2 超表达GhGST3 增强拟南芥对黄萎病的抗性Fig. 2 Enhanced Verticillium wilt resistance in Arabidopsis by Over-expression of GhGST3
2.3 GhGST3 基因的原核表达
为了进一步明确GhGST3基因的表达特性,GhGST3 原核表达分析显示获得了一条97.3 kD 的片段,预测显示GhGST3 蛋白大小为24.6 kD,pET32a 载体为(包括6 个组氨酸,硫氧还蛋白,以 及Trx.Tag、His.Tag、S.Tag、trx-tag 和2 个his 标签)72.7 kD。结果显示GhGST3 能被诱导表达(图3)。

图3 GhGST3 原核表达电泳图Fig. 3 The electrophoresis of the GhGST3 prokaryotic expression
2.4 GhGST3 的亚细胞定位
烟草中亚细胞定位结果表明,当GFP 表达时,荧光信号存在于细胞核、细胞质和细胞膜中。对于表达GhGST3 和GFP 融合的细胞,荧光信号存在于细胞核、细胞质和细胞膜中(图4)。表明GhGST3分布于植物细胞膜、细胞质与细胞核中。

图4 GhGST3 在烟草上皮细胞中的亚细胞定位Fig. 4 Subcellular localization of GhGST3 in tobacco epidermal cells
2.5 酵母双杂交筛选与GhGST3 互作的靶标蛋白
为了进一步明确GhGST3 的黄萎病抗性机制,对pGBKT7-GhGST3重组质粒进行自激活检测和毒性检测,含有诱饵载体的酵母菌在SD/-Trp 和SD/-Trp/X-a-Gal 固体培养基上正常生长、不变蓝。在 SD/-Trp/X-a-Gal/AbA 固体培养基上不生长(图5a), 证明重组质粒不存在自激活活性。将含有pGBKT7空载体的酵母菌和含有诱饵载体的酵母菌稀释1/10和1/100 后,分别吸取100 μL 均匀的涂布于SD/-Trp 固体培养基上培养。结果显示单克隆数量和大小趋于一致(图5b),证明重组质粒不存在毒性。
将携带诱饵载体的酵母菌与本实验室前期构建好的黄萎病菌诱导的海岛棉cDNA 文库进行杂交。杂交24 h 后,在显微镜下可以观察到结合子呈现三叶形状(图5c),将杂交后的菌液依次涂布于DDO、TDO 和QDO/X/A 培养基进行阳性克隆的筛选。将筛选到的阳性克隆利用特异性引物进行PCR检测(图5d),对单一条带的电泳产物进行回收、测序,利用Cotton-FGD 数据库进行序列的比对,最终筛选得到11 个基因(表1)。其中4 个为转录因子编码基因,分别编码CIPK3、ABCI19、GATA9和MYB330。

图5 酵母双杂交筛选GhGST3 的互作蛋白Fig. 5 The interacting proteins screening of GhGST3 using yeast two-hybrid method

表1 陆地棉中11 个与GhGST3 互作的蛋白Table1 Eleven candidate proteins interacting with GhGST3 in G. hirsutum
2.6 互作蛋白的KEGG 和GO 分析
利用拟南芥数据库进行11 个互作蛋白的KEGG和GO 分析,结果显示GhGST3 可能通过植物的柠檬酸盐代谢、氨基糖和核苷酸糖代谢、核糖体代谢、碳代谢以及氧化磷酸化等代谢路径参与棉花抗黄萎病反应(表2)。

表2 GhGST3 互作蛋白KEGG 分析Table 2 The KEGG analysis of GhGST3 interaction proteins
GO 结果表明互作蛋白在植物体内大多参与代谢过程,其中参与羧酸代谢、草酸代谢的蛋白最多(表3)。
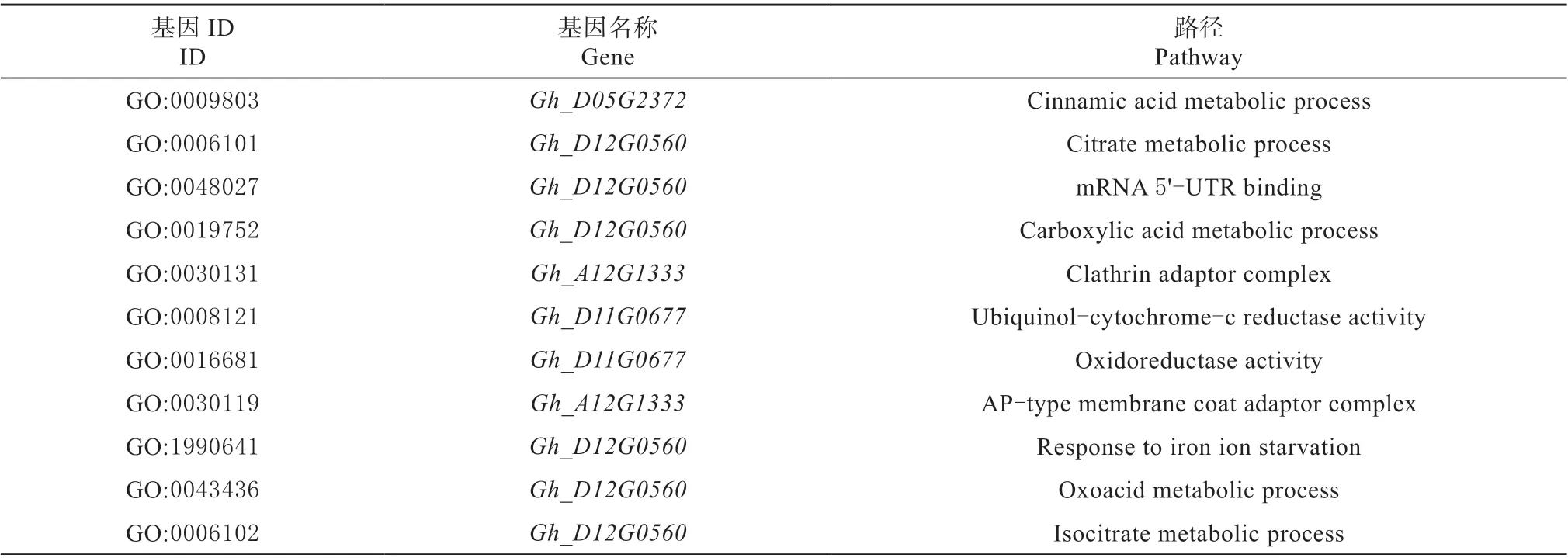
表3 GhGST3 互作蛋白GO 分析Table3 The GO analysis of GhGST3 interaction proteins

续表:
3 讨论
在植物中,谷胱甘肽硫转移酶主要通过同源二聚体或异源二聚体或单体发挥功能[23]。在结构上,GST 亚基包括N 端硫氧还蛋白折叠结构域和C 端α螺旋结构域,并且在这两个结构域之间有1 个活性位点。N 端结构域与谷胱甘肽结合,C 端结构域与细胞质疏水性物质、亲电试剂、有毒烷基化剂和某些内源性物质等结合,进而将结合的产物从体内排出,达到解毒细胞的目的[24-27]。GST 根据基因结构、氨基酸序列、免疫交叉反应性和底物的专一性等进行分类[28]。在棉花中,GST 分为9 类,包括Tau,DHAR,Ef1bγ,Lambda,MAPEG,Phi, TCHQD,Theta 和Zeta。 其 中Tau 和Phi 是 植 物特有的种类[29-30]。本研究从抗病陆地棉品种‘农大601’中克隆得到位于A 亚组09 染色体上tau cluster 中GhGST3基因。该基因全长651 bp,编码216 个氨基酸,分子量为24.6 kD。含有2 个外显子和1 个内含子。有两个保守结构域GST_N_Tau 和GST_C_Tau。
已有功能研究发现沉默Phi 类GST 基因,沉默植株茎段中分离出较多的黄萎病菌,维管束细胞更长、更大,使大丽轮枝菌的菌丝更容易渗透浸入,台盼蓝染色后发现沉默植株叶片中染色面积更大、颜色更深,降低棉花植株对黄萎病的抗性[31]。尖孢镰刀菌(Vasinfectum)感染棉根和下胚轴,并诱导同源GST 基因的表达[32]。推测棉花中GST 基因存在广谱抗性。但这些研究对GST 基因可能参与的黄萎病抗性分子机制并未报道。此外,项目组前期研究发现陆地棉A 亚组09 号染色体上的一个tau 类cluster(Gh_A09G1508,Gh_A09G1509和Gh_A09G1510)在黄萎病抗性反应中发挥了重要作用[7,20]。但其中单基因在黄萎病抗性反应中的功能及抗病分子机制需要进一步研究。因此本研究在陆地棉抗病品种‘农大601’中克隆了Gh_A09G1510的同源基因GhGST3,构建了超表达35s:GhGST3载体,并对转GhGST3基因拟南芥纯系进行黄萎病抗性鉴定,结果显示相比较野生型拟南芥,超表达株系显著提高了黄萎病抗性,表明该基因在黄萎病抗性反应中发挥了重要作用。
亚细胞定位研究对于解析植物体内抗病基因产物发挥作用的位置、功能和机制研究有重要意义,研究表明牧豆树(Prosopis juliflora)PjGSTU1 定位在叶绿体[33]。拟南芥中GST 定位结果显示:所有GSTFs 和GST-U2,U7,U9,U11,U19 和U28的GFP-GST 融合蛋白都定位在细胞质中。GFPGSTT3L,GFP-GSTU12 完全定位于细胞核。GFPTCHQD 定 位 于 质 膜。GFP-GSTT1,GFP-GSTT2和GFP-GSTT3 定位于过氧化物酶体。这些蛋白质可以在不同的细胞器发挥功能[34]。本研究通过亚细胞定位证实GhGST3 在细胞核、细胞质和细胞膜中均有分布。
为了进一步明确GhGST3可能的抗病分子机制,本研究通过酵母双杂交筛选到11 个与GhGST3 互作的靶蛋白,包括4 个转录因子,分别是CIPK3、ABCI19、GATA9 和MYB330。其中钙调节神经磷酸酶B 样蛋白(CBLs)代表植物钙结合蛋白家族,通过与CBL 互作蛋白激酶(CIPKs)互作,在植物钙信号传导中起重要作用[35]。CBL 蛋白能够通过调控植物的ABA 通路来提高植物抗病性,同时有证据表明CBL3 能够调控拟南芥的应激反应[36]。在抗逆过程中,植物还通过转录因子调节某些功能基因的表达,这是植物应对逆境的主要机制之一。作为植物中最大的转录因子家族之一,MYB 转录因子在植物抗逆性过程中起着重要作用[37]。在拟南芥中,当拟南芥感染病原体时,AtMyb30 是HR 反应的正向调节剂,对细菌病原体感染引起的过敏性死亡的反应取决于SA 的积累,但不取决于NPR1。并且如果改变拟南芥AtMYB30的表达(过表达,T-DNA插入突变),SA 的水平和SA 相关基因的表达也会改变。这表明拟南芥AtMYB30参与了SA 合成的调节并调节细胞死亡[38]。此外,烟草的Myb1基因编码水杨酸的下游信号复合物,并与病原相关蛋白(PR)基因的启动子序列结合,参与PR 基因的激活和植物防御反应[39]。因此,GhGST3可能通过ABA 路径和/或SA 路径等参与棉花黄萎病抗性反应。
4 结论
棉花谷胱甘肽硫转移酶家族GhGST3 蛋白在植物细胞膜、细胞质和细胞核中表达。在拟南芥中超表达GhGST3基因,使其对黄萎病的抗性增强。酵母双杂交得到11 个可能与GhGST3 互作的蛋白,其中有4 个转录因子蛋白。证明GhGST3参与抗黄萎病反应,是潜在重要的抗病基因。
