根癌农杆菌介导苹果愈伤组织遗传转化体系的优化
2021-01-08牛淑庆李雨欣姚允聪
牛淑庆,陈 丽,李雨欣,田 佶,姚允聪,张 杰
(北京农学院植物科学技术学院/农业应用新技术北京市重点实验室/植物生产国家实验教学示范中心,北京 102206)
苹果(MalusdomesticaBokh.)是落叶乔木。起源于欧洲和亚洲的中部地区,已经具有悠久的栽培历史,品种较多,分布较广,全世界温带地区均有种植。通过记载可知,苹果的栽培已有3000多年历史。从刚开始寥寥无几栽培品种,到现在通过长期自然选择以及人工栽培育种下,已经有较多的苹果品种。尤其是近代以来,人们通过杂交、嫁接、芽变等各式各样的先进育种方法,有许多的新品种被创造出来,目前,在全世界,苹果品种已达到1万个左右。其中,生产上常用的栽培品种有20多个。随着科学技术不断进步以及生物工程快速发展,加上目前苹果基因组测序数据,苹果中基因的功能在研究和鉴定,通过转基因技术将目的基因转入到苹果中从而进行功能基因的鉴定,已经是一种主要的方法,其中遗传转化体系的建立与优化则是重要的研究内容。
根癌农杆菌介导法,其易操作、低费用、高效率等优点成为转基因策略中的首选方法[1]。利用根癌农杆菌为载体,将目的基因转入到植物细胞的染色体中,目的基因的特性能够进行遗传,从而得到转基因植株。自从James等[2]首次报道获得绿袖苹果遗传转基因植株以来,苹果转基因研究迅猛。在苹果的遗传转化中,有众多因素起着十分重要的作用,包括基因型、外植体、培养基、植物生长调节剂等原因。苹果遗传转化的进步,对苹果遗传育种方面提供便利,能够增加育种的效率,并且还为其他果树的遗传转化提供参考价值[3-6]。目前虽然根癌农杆菌介导法已成为研究转基因植物采用的主要方法[7],但是不同植物间利用根癌农杆菌介导法获得的转化效率差异很大,高效根癌农杆菌转化体系对于转基因植物产业化和功能基因组学等研究都具有非常重要的意义[8-9]。
该试验以‘王林’苹果愈伤组织为转化研究的材料,在已经建立的遗传转化基础上,优化根癌农杆菌介导的‘王林’愈伤组织的遗传转化系统,为遗传转化工作及苹果分子育种工作提供一定的理论依据和技术支撑。
1 材料与方法
1.1 材 料
试验所用‘王林’(Malusdomesticacv.‘Orin’)愈伤组织来自北京农学院组培中心。
1.2 方 法
1.2.1 培养基 ‘王林’愈伤组织继代培养基1 L(pH 5.8),4.47 g MS+1 mL 6-BA(0.4 mg/L)+100 μL NAA(0.05 mg/L)+30 g蔗糖+6 g琼脂,高压灭菌20 min,温度为121 ℃。
‘王林’愈伤组织培养基1 L(pH 5.8),4.47 g MS+1 mg/L 2,4-D+1 mg/L 6-BA+30 g/L蔗糖+8 g/L琼脂+50 mg/L卡那霉素+250 mg/L头孢噻肟,高压灭菌20 min,温度为121 ℃。
1.2.2McmiR399d的克隆和载体构建 使用NCBI找到苹果‘王林’的McmiR399d基因序列,设计特异性引物,利用高保真酶进行PCR扩增,胶回收目的片段并连接到克隆载体,转化DH5α,根据载体抗性将菌液涂到带抗性的培养基上37 ℃过夜。挑取阳性克隆进行PCR验证,PCR验证后挑取阳性克隆进行菌液的培养,并提取质粒、双酶切。测序结果正确后对提取的质粒和表达载体(pRI101)和沉默载体(pTCK303)进行双酶切胶回收目的片段和载体,将目的片段与载体的大片段用T4DNA连接酶连接后转化DH5α,将其涂到培养基上37 ℃过夜。挑取阳性克隆培养菌液并进行酶切验证,结果正确,载体构建完毕。
1.2.3 菌液制备 将已经构建好载体的质粒转入根癌农杆菌菌株(GV4404)中,进行培养,选取培养基上单菌落放入带有抗性(抗性由载体决定)的700~1 000 μL的液体培养基中,放入28 ℃摇床220 r/min震荡培养8 h,离心收集菌液,倒掉上清,加入侵染液混匀[AS(200 μmol/L)+MES(10 μmol/L)+MgCl2],调OD600=0.8待用。
1.2.4 愈伤组织的侵染 选取已经继代培养20 d长势良好,鲜嫩‘王林’愈伤组织,分成小块放入侵染液中,摇床20 min,叶片用滤纸滤干后放置到共培养的固体培养基(MS+1 mg/L 2,4-D+1 mg/L 6-BA+30 g/L蔗糖+8 g/L琼脂糖,pH 5.8),黑暗培养3 d。
1.2.5 侵染外植体的脱菌与筛选 共培养3 d,将其置于选择性的继代培养基(MS+1 mg/L 2,4-D+1 mg/L 6-BA+30 g/L蔗糖+8 g/L琼脂+50 mg/L卡那霉素+250 mg/L头孢噻肟,pH5.8),暗培养30 d,此过程中如果根癌农杆菌生长过多,及时更换培养基。
1.2.6 RNA提取 使用EASYspin Plus植物RNA快速提取试剂盒提取所需植物的RNA,试剂盒购于北京艾德莱生物技术有限公司,步骤见试剂盒说明书。
1.2.7 愈伤组织的qRT-PCR检测 使用EASYspin Plus植物RNA快速提取试剂盒提取所需植物的RNA并进行反转录,试剂盒购于北京艾德莱生物技术有限公司,步骤见试剂盒说明书。将反转录所得的cDNA为模板进行qRT-PCR,进行引物设计,利用TB Green©Premix Ex TaqTM II酶,加上RNase free H2O,放置到CFX96TM Real Time System,运用两步法进行qRT-PCR。
1.2.8 数据分析 每个试验3个生物学重复,通过相关分析(Excel程序)检查各参数之间的关系。运用Origin 8.0,Adobe Photoshop CS5等软件进行数据的处理和分析。
2 结果与分析
2.1 激素对愈伤组织继代培养的影响
激素对愈伤组织继代培养的影响见表1。2,4-D 0.5 mg/L,6-BA 0.6 mg/L,由于没有达到愈伤组织所需的质量浓度,愈伤组织并没有生长。2,4-D 1.5 mg/L,6-BA 1 mg/L,因为其已经超过愈伤组织的所需质量浓度,愈伤组织开始慢慢出现黑化现象,并伴随较多的水渍。2,4-D 1 mg/L,6-BA 0.8 mg/L,愈伤组织的分化速度和生长情况良好,2,4-D 1 mg/L,6-BA 0.8 mg/L的培养基最适合愈伤组织继代培养。
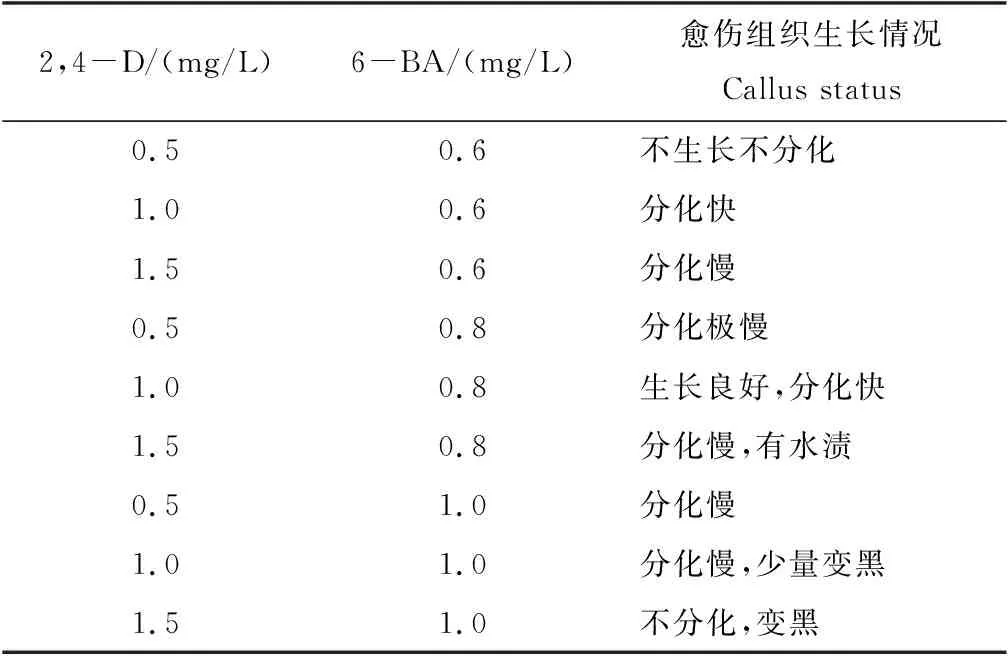
表1 激素对愈伤组织继代培养的影响Tab.1 The effect of hormone concentration on subculture of callus
2.2 ‘王林’愈伤组织生长时间对侵染的影响
‘王林’愈伤组织生长时间对侵染的影响如表2所示。愈伤组织10 d时,由于继代培养的时间不充分,愈伤组织被大面积的根癌农杆菌包围,并且水渍多。愈伤组织30 d时,由于继代培养的时间过长,愈伤组织已经开始有慢慢衰老,且分化能力不足,加上根癌农杆菌的侵染,愈伤组织大部分死亡。愈伤组织20 d时,转化率最高,且此时愈伤组织分化快,最适合进行遗传转化。

表2 愈伤组织生长时间对叶片再生的影响Tab.2 The effect of callus growth time on infection
2.3 侵染时间对愈伤组织的影响
侵染时间对愈伤组织的影响如表3所示。
在OD600=0.6的时候,根癌农杆菌侵染愈伤组织的能力比较低,对基因转入叶片的效率降低。OD600=1.0,由于根癌农杆菌OD600值过高,脱菌的时候会出现大量根癌农杆菌,不易控制,且有污染的现象。只有OD600值为0.8,对愈伤组织的侵染最合适,因此选择OD600=0.8。
侵染10 min,由于时间过短,并且不容易进入愈伤组织,严重影响遗传转化的效率,并且还会有假阳性的愈伤组织。而侵染30 min,由于侵染时间太长,愈伤组织受到严重的损伤,开始变黑和死亡,并且出现大量根癌农杆菌。愈伤组织侵染20 min,此时愈伤组织状态最佳,因此侵染时间选择20 min。

表3 侵染时间对愈伤组织的影响Tab.3 The effect of time and concentration of infestation on callus
2.4 卡那霉素对愈伤组织的影响
卡那霉素对愈伤组织的影响如表4所示。黑暗处理30 d,卡那霉素10 mg/L,由于卡那霉素质量浓度太低,愈伤组织并没有太大变化,依旧生长,无法进行野生型愈伤组织和转基因愈伤组织的选择。卡那霉素35 mg/L,此时不管是野生型愈伤组织,还是转基因愈伤组织都开始出现死亡现象,已经超过愈伤组织所能承受的范围。卡那霉素30 mg/L,愈伤组织增殖迅速,适合侵染使用,并且野生型愈伤组织处于不生长状态,不会影响转基因愈伤组织,因此最适宜卡那霉素质量浓度为30 mg/L。
2.5 愈伤组织表达载体和沉默载体转化根癌农杆菌及其鉴定
将带有目的基因的根癌农杆菌进行菌液的收集,并对‘王林’愈伤组织进行侵染。根癌农杆菌OD600=0.8,选择继代20 d的愈伤组织分成小块放入菌液,摇床20 min,再将其放到无抗性的固体培养基暗培养3 d,把侵染的愈伤组织转入到带有抗生素250 mg/L头孢噻肟和30 mg/L卡那霉素培养基,得到转基因愈伤组织,并对转基因愈伤组织进行鉴定,提取RNA,通过检测得到凝胶电泳分析结果如图1所示。

表4 卡那霉素对愈伤组织的影响Tab.4 The effect of Kan and concentration on callus screening
在过表达McmiR399d和沉默McmiR399d愈伤组织的对照中可以明显看出野生型并没有条带,而转基因的条带不但完整性比较好,并且条带清晰明亮,条带所在的位置正好是500 bp的位置。说明McmiR399d已经成功转入到‘王林’愈伤组织中。
2.6 McmiR399d基因表达水平
检测转基因愈伤组织和野生型愈伤组织McmiR399d的表达量如图2所示。通过与野生型愈伤组织相比发现,在过表达愈伤组织McmiR399d中,McmiR399d的表达量显著增加,而沉默的McmiR399d的表达量下降;还检测McmiR399d靶基因PHT1-4的表达量,可以看出,沉默的McmiR399d靶基因PHT1-4的表达量明显上升,而过表达的McmiR399d靶基因PHT1-4的表达量则下降,说明基因已经转入到愈伤组织中。
3 讨 论
经过‘王林’愈伤组织遗传转化的试验,提高转化的效率,为转基因植株的研究提供材料,建立高效的遗传转化体系,对转基因技术和转基因植物的研究都有十分重要的作用,这对研究植物提供有效的技术支撑。在‘王林’愈伤组织遗传转化体系的建立中,明确影响遗传转化的因素,并且对各个因素进行选择,得到最适合‘王林’愈伤组织的遗传转化条件。
在‘王林’愈伤组织的遗传转化体系中发现最适合进行转化的愈伤组织是继代20 d的愈伤组织,生长调节剂选择2,4-D 1 mg/L和6-BA 0.8 mg/L时,愈伤组织生长最好,并且需要找出适当的比例进行愈伤组织的继代培养,只有植物材料在最好的状态下才能在试验中提供帮助。根癌农杆菌侵染时间和根癌农杆菌OD值很大程度上决定遗传转化的成功与否,最适合‘王林’愈伤组织进行遗传转化条件为根癌农杆菌在OD600=0.8时侵染20 min。
在植物转基因过程中常添加一些酚类物质以促进T-DNA转移,从而提高转化效率。在共培养基中添加磷酸甜菜碱和脯氨酸等渗透保护剂可提高李和苹果的转化效率[10-13]。蔷薇科果树中尤其是苹果和草莓,在基因方面的研究已经有相对稳定的遗传转化体系,但是这些体系依旧存在不少缺点,进一步优化遗传转化体系是需要深入研究的内容。随着生物基因工程技术的发展,通过转基因的技术,将外源基因转入到果树中,从而提高苹果品质,是一种未来增加果树种质资源的有效手段,通过根癌农杆菌介导法将构建好的带有外源基因的过表达或者沉默转入到植物中是获得转基因植株的重要方法。
