暂存和运输方式对野生三疣梭子蟹暂养的影响
2021-01-08韩胜明任志明邱雪妮母昌考王春琳
韩胜明,任志明,邱雪妮,杨 华,母昌考,2*,王春琳,2
暂存和运输方式对野生三疣梭子蟹暂养的影响
韩胜明1,任志明1,邱雪妮1,杨 华1,母昌考1,2*,王春琳1,2
(1.宁波大学 海洋学院, 浙江 宁波 315832; 2.浙江海洋高效健康养殖协同创新中心, 浙江 宁波 315832)
三疣梭子蟹是我国重要的海产经济蟹类, 野生梭子蟹的暂养是一种高效利用梭子蟹自然资源的经济手段. 为探究适合野生三疣梭子蟹暂养的方法, 研究了野生三疣梭子蟹捕捞后不绑螯堆积式暂存(M1)、绑螯单个体式暂存(M2)两种暂存方式以及橡皮筋绑螯堆叠盛放于塑料筐中运输(T1)、不绑螯单个盛放于单体盒中运输(T2)两种运输方式分别对其暂养存活的影响, 并以超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、丙二醛(MDA)、血糖、皮质醇、热休克蛋白(HSP70)几种生理指标了解其生理响应特征. 结果显示: (1)不同暂存方式对野生三疣梭子蟹暂养的影响中, M2方式暂存的蟹暂养累积存活率为91.4%, 显著高于M1 (<0.05), M1组蟹累积存活率为70.0%; 根据对M1、M2组蟹血淋巴中几种生理指标的检测, 引起两组蟹存活率差异的原因可能是M1暂存方式对蟹造成不可逆的损伤胁迫, 抗氧化及应激能力显著降低, 生理机能和免疫防御能力受损. (2)不同运输方式对野生三疣梭子蟹暂养的影响中, T2方式运输的蟹暂养累积存活率为41.5%, 略高于T1 (>0.05), T1组蟹累积存活率为30.8%; 根据对T1、T2组的蟹血淋巴中几种生理指标的检测, 引起两组蟹存活率差异的原因可能是以T1方式运输的蟹受到挤压胁迫, 抗氧化及应激能力略低于T2. 综上分析, 以绑螯单个体式的暂存方式和不绑螯单个盛放于单体盒中的运输方式获取的野生三疣梭子蟹更适合暂养.
野生三疣梭子蟹; 暂存方式; 运输方式; 暂养; 存活
三疣梭子蟹(), 隶属于节肢动门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(), 因头胸甲呈梭形, 而胃、心区背面又有三个显著的疣突而得名, 是我国重要的海产经济蟹类, 也是我国沿海重要的捕捞对象[1-2]. 野生三疣梭子蟹暂养, 常发生在梭子蟹集中上市的季节, 暂养可错开上市旺季(9~11月), 也可育肥, 以实现品质提升, 均衡市场供应, 满足人们在不同季节对梭子蟹的需求[3-5]. 因此, 暂养是一种高效利用梭子蟹自然资源的经济手段[6].
当前用于暂养的三疣梭子蟹大部分来源于自然捕捞, 存在的主要问题是存活率低[7], 其暂养存活率与蟹的来源海区、捕捞方式、蟹起捕之后的暂存方式、运输方式以及暂养过程中的病害问题等诸多因素相关[8]. 目前已有对暂养过程中的病害及预防的相关研究[9-11], 而尚未见野生三疣梭子蟹捕捞后的暂存和运输等作业方式对暂养影响的相关报道. 野生三疣梭子蟹起捕后, 在储入活水船舱前需进行一个暂存的中间环节. 此中间环节是影响野生三疣梭子蟹质量的重要环节, 也对野生蟹后期的暂养起到关键作用. 在实际生产过程中, 暂存方式的不同会对蟹造成不同程度的损伤. 传统作业方式是将蟹不绑螯堆叠盛放暂存, 很容易造成蟹的堆叠、打架伤残, 严重影响梭子蟹质量. 同样, 野生三疣梭子蟹在暂养前需经历长时间的运输, 作为野生蟹捕获的重要活动环节之一, 在生产中常采用橡皮筋绑螯、堆叠式盛放的方式易造成挤压等环境胁迫, 此间多胁迫因子协同作用, 可能会打破蟹体内的生理稳态, 导致其体质下降.
鉴于此, 本实验研究了野生三疣梭子蟹捕捞后两种暂存和运输方式分别对其暂养存活的影响, 并以血淋巴中超氧化物歧化酶(SOD)、总抗氧化能力(T- AOC)、丙二醛(MDA)、血糖、皮质醇和热休克蛋白(HSP70)等生理指标的变化探究其生理响应特征, 以期获得在暂存和运输过程中对蟹更优的处置方式来提高暂养存活率.
1 材料与方法
1.1 蟹的来源及操作
本实验于浙江省舟山市嵊泗县蓝海洋生态发展有限公司试验场进行, 野生三疣梭子蟹均捕自嵊山渔场附近海域, 采用拖网捕捞, 本实验跟随捕捞船进行.
野生蟹起捕后暂存方式设置为两种, 一种为不绑螯堆积式暂存, 记为M1, 此方法将蟹不绑螯足堆积盛放在聚乙烯材料的塑料托盘中(60cm× 40cm×10cm); 另一种为绑螯单个体式暂存, 记为M2, 此方法将蟹绑螯足单个平铺盛放在同样托盘中, 不发生堆积. 实验设计如下: 野生蟹起捕后, 挑选附肢完整、活力好、规格相近(平均体质量(174.3±28.4)g)的三疣梭子蟹, 随机均分为两组, 每组各41只, 分别以上述M1、M2两种方式暂存, 两种方式暂存时间均为10min. 暂存结束后立即取样, 每组随机取样6只, 同时剔除各组暂存过程中损伤的蟹: M1组余30只, M2组35只. 随后储入活水船舱运输至试验场, 其他条件均保持一致. 至试验场后, 消毒处理, 暂养于多层立体养殖系统(34.0cm×22.5 cm×14.5cm)中. 实验期间自然光照, 不投喂饵料, 水温13~16℃, pH值7.0左右, 溶解氧质量浓度大于0.7mg·L-1, 氨氮质量浓度小于0.5mg·L-1, 亚硝酸盐质量浓度小于0.1mg·L-1, 每隔3~5d清洗排换新鲜海水一次, 暂养周期为30d.
相同来源的野生三疣梭子蟹, 挑选附肢完整、活力好、规格相近(平均体质量(207.0±30.5)g)的进行运输实验. 运输方式设置为两种, 一种是以常规的圆柱形(半径25cm, 高20cm)聚乙烯塑料筐为运输工具, 橡皮筋绑螯堆叠盛放于塑料筐中运输, 记为T1; 另一种以聚乙烯材料的长方体(22cm× 15cm×5cm)单体盒为运输工具, 不绑螯单个盛放于单体盒中运输, 记为T2. 每组蟹51只, T1组野生蟹逐只橡皮筋绑螯堆叠(5层)盛放在塑料筐中, T2组蟹不绑螯单个盛放在单体盒中, 以橡皮筋固定好. 两组蟹均存放在捕捞船活水舱内, 其他条件亦保持一致, 运输到试验场, 运输时长2h. 至试验场后立即取样, 每组随机取样6只, 同时剔除每组损伤的蟹: T1组余39只, T2组41只. 消毒处理后进行暂养, 方法同上, 周期为30d.
1.2 生存分析
生存曲线又称Kaplan-Meier曲线, 是一种将事件结果(终点事件)和出现这一结果所经历时间相结合分析的统计分析方法, 可以考虑到整个事件周期, 在某些任意观测点进行比较, 更好地描述终点事件的发生规律[12]. 目前对生存分析的假设检验一般采用log rank检验, 它是检验样本组之间差异显著性的方法, 检验可以是两组比较也可以是多组比较[13]. Kaplan-Meier法Log rank (Mantel-cox)检验结果会提供中位生存时间、平均生存时间以及相应的置信区间, 如果是三组及以上比较可以不显示中位生存时间. 生存分析在医学科学领域已有广泛应用, 例如在临床医学上用于分析病人预后治疗情况[14-16].
依据口张开、触碰四肢无反应为梭子蟹死亡标志来判断其是否存活. 观察并记录结果, 计算存活率, 公式如下: 累积存活率=终末梭子蟹数量/初始梭子蟹数量×100%.
1.3 抗氧化和应激指标的测定
用吸水纸吸干蟹体表面水分, 根据吴丹华等[17]的方法, 以1mL一次性注射器自游泳足基部抽取各组三疣梭子蟹的血淋巴, 转移到1.5mL离心管中, 4℃凝固过夜后捣碎, 3000r·mim-14℃离心10min, 取上清, 每200μL分装于冻存管, 迅速放入-80℃液氮罐, 然后转入-80℃冰箱保存待测.
SOD、T-AOC、MDA的测定均采用购自南京建成生物工程研究所(南京)生产的试剂盒. 其中, SOD活力采用WST法测定, 在反应体系中, SOD抑制率达50%时所对应的酶量定义为一个SOD活力单位(U·mL-1) ; T-AOC采用ABTS法测定, 单位为mmol·L-1; MDA采用硫代巴比妥(TBA)法测定, 单位为nmol·mL-1, 具体测定方法按试剂盒的说明进行.
血糖、皮质醇、HSP70的测定: 血糖采用购自南京建成生物工程研究所(南京)生产的试剂盒, 单位均为mmol·L-1; 皮质醇、HSP70均采用购自上海桥杜生物科技有限公司(上海)的定量检测试剂盒(ELISA), 皮质醇单位为ng·mL-1, HSP70单位为pg·mL-1. 具体测定方法按试剂盒的说明进行.
1.4 数据分析
数据以平均值±标准差表示, 采用SPSS 24.0软件进行统计分析. 以Kaplan-Meier乘积极限法和Log rank总体检验进行生存数据分析, 两组间各指标比较采用独立样本检验, 取<0.05为差异显著,<0.01为差异极显著. 采用Sigmaplot 12.5和GraphPad Prism 5软件绘图.
2 结果
2.1 暂存和运输方式对野生三疣梭子蟹暂养存活的影响
图1为两种暂存方式的野生三疣梭子蟹暂养生存曲线. 由图1可知, 随着暂养时间延长, 第5天开始两组的梭子蟹出现死亡, M1组存活率为93.3%, M2组存活率高达97.1%, 在随后的暂养过程, M1组的蟹死亡率在任何一个时间点均明显高于M2组; 5~25d内, M2组的蟹未发生死亡, 而M1组在5~15d出现短暂的稳定期后死亡增加; 在暂养的30d内, M1组的蟹累积存活率为70.0%, M2组累积存活率为91.4%. 由图1与表1分析可知, M2组累积存活率、平均生存时间大于M1组, Log rank检验提示M2组的蟹暂养累积存活率显著高于M1组(<0.05)(表1).

图1 两种暂存方式的野生三疣梭子蟹暂养生存曲线

表1 不同处理方式的野生三疣梭子蟹暂养生存差异分析
图2为两种运输方式的野生三疣梭子蟹暂养生存曲线. 由图可知, 暂养3d, 两组均出现死亡, 且生存曲线几乎吻合, 说明两组存活率相差不大; 此后至暂养30d, 两条曲线间距由大变小, 说明存活率差别逐渐趋缓, T1组累积存活率为30.8%, T2组为41.5%. 由图2与表1可知, T2组累积存活率、平均生存时间大于T1组, Log rank检验结果表明两组野生蟹暂养累积存活率无显著差异(>0.05).

图2 两种运输方式的野生三疣梭子蟹暂养生存曲线
2.2 暂存和运输方式对SOD、T-AOC、MDA的影响
两种暂存方式对野生三疣梭子蟹血淋巴中SOD、T-AOC、MDA的影响如图3所示. 由图可知, M1组梭子蟹血淋巴中SOD活力(85.93±3.90) U·mL-1显著高于M2 (62.33±1.66)U·mL-1(<0.01) (图3(a)); M1组T-AOC水平(2.46±0.23)mmol·L-1显著高于M2 (2.10±0.10)mmol·L-1(<0.05)(图3(b)); M1组MDA浓度(2.84±0.38)nmol·mL-1显著高于M2 (1.83±0.16)nmol·mL-1(<0.01)(图3(c)).
两种运输方式对野生三疣梭子蟹血淋巴中SOD、T-AOC、MDA的影响如图4所示. 由图知, T1组梭子蟹血淋巴中SOD活力(95.93±12.37) U·mL-1显著高于T2 (66.67±2.68)U·mL-1(<0.05) (图4(a)); T1组T-AOC水平略低, 与T2组无显著差异(> 0.05) (图4(b)); T1组MDA浓度(3.29±0.08)nmol·L-1显著高于T2 (2.78±0.28)nmol·L-1(<0.05) (图4(c)).

注: *表示组间差异显著(P<0.05); **表示差异极显著(P<0.01). 下图同.

图4 运输方式对血淋巴中SOD、T-AOC、MDA的影响
2.3 暂存和运输方式对血糖、皮质醇、HSP70的影响
两种暂存方式对野生三疣梭子蟹血淋巴中血糖、皮质醇和HSP70的影响如图5所示. 由图可见, M1组梭子蟹的血糖浓度(5.62±0.35)mmol·L-1显著高于M2组(4.90±0.37)mmol·L-1(<0.05) (图5(a)); M1组皮质醇质量浓度(1.41±0.03)ng·mL-1显著高于M2组(1.31±0.04)ng·mL-1(<0.05) (图5(b)); M1组HSP70表达量(4.31±0.10)pg·mL-1显著低于M2组(4.78±0.25)pg·mL-1(<0.01) (图5(c));

图5 暂存对血淋巴中血糖、皮质醇和HSP70的影响
两种运输方式对野生三疣梭子蟹血淋巴中血糖、皮质醇和HSP70的影响如图6所示. 由图可见, T1组血糖浓度略高于T2组, 差异不显著(>0.05) (图6(a)); 相比T2组, T1组皮质醇质量浓度略高, 两组无显著差异(>0.05) (图6(b)); T1组HSP70表达量高于T2组, 无显著差异(>0.05) (图6(c)).
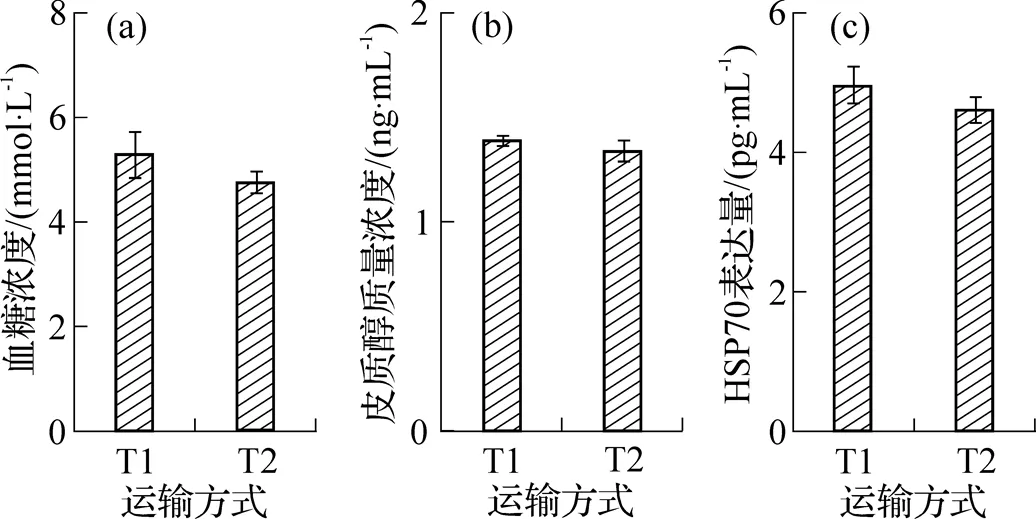
图6 运输方式对血淋巴中血糖、皮质醇和HSP70的影响
3 讨论
野生三疣梭子蟹在自然捕获至暂养场地暂养的众多环节中易受各种环境因子胁迫和人为损伤, 严重影响其暂养存活率. 本实验从暂养蟹海捕后的实际作业方式出发, 研究了不同暂存和运输方式对野生蟹暂养存活的影响, 并以血淋巴中生理指标的变化了解几种方式下蟹体的生理响应特征.
SOD是一种诱导性酶, 在抗氧化防御体系中能够最先清除活性氧自由基(ROS), 维持体内自由基动态平衡[18-20], 适量的ROS可以激活SOD活性, 二者的含量密切相关[21]. 本研究发现, 两种暂存方式中, M1组的蟹SOD酶活力显著升高, 说明M1的暂存方式引起其蟹体自由基的增多并诱导SOD的产生. 推测这可能是因为M1暂存方式对蟹造成氧化损伤, 导致机体ROS增多, 进而触发SOD活力显著升高. 同样, T1运输方式也可能对梭子蟹造成了氧化损伤, 从而导致该组SOD活性显著高于T2组, 这一结果与苏志星等[6]研究的挤压胁迫对三疣梭子蟹抗氧化系统影响的结果具有一致性. T-AOC代表机体内总抗氧化水平, 主要包括抗氧化酶体系和抗氧化物质体系[22-23], 可清除活性氧自由基, 在一定程度上反映机体所处环境及非特异性免疫力的变化[24]. 本研究中, M1组蟹T-AOC水平显著高于M2组, 可能是此暂存方式对蟹体的胁迫使其氧自由基增高, 在机体的代偿应激下, T-AOC水平升高. 结合M1方式下机体SOD酶活力变化, SOD活力和T-AOC水平变化一致, 说明M1方式暂存的蟹主要是通过调节抗氧化酶活力来维持机体ROS的平衡. 两种运输方式中, T1组蟹T-AOC水平略低于T2组, 主要的抗氧化酶系统成员SOD显著升高, 推测可能蟹在长时间的挤压胁迫下体内自由基显著增多, SOD酶不足以有效消除ROS, 机体需要不断消耗抗氧化物质来减少损害, 说明T1组蟹在挤压胁迫过程中由抗氧化物质体系和抗氧化酶体系共同清除ROS. T-AOC活力水平在暂存和运输中表现出变化趋势的差异, 可能是暂存发生在短时间内, 机体主要依靠氧化酶来应对自由基. 而长途运输时, 机体需要消耗抗氧化物质来维持机体功能. MDA是自由基引发脂质过氧化作用的最终分解产物[25], 其含量的高低反映了细胞膜氧化损伤的程度, 也被广泛地用作细胞氧化损伤的评价指标之一[26-27]. 对MDA指标分析发现, M1、T1组蟹MDA含量均显著升高, 说明蟹体细胞氧化损伤加剧, 可能是外部环境因子变化剧烈, 引起机体免疫防御系统受损与代谢异常. 从以上实验结果可以看出, 采用M1、T1方式的野生蟹暂养存活率低的原因可能是这两种方式对蟹体造成了氧化损伤, 机体正常生理机能和免疫功能受损.
暂存和运输方式的不同不仅对梭子蟹产生氧化损伤, 而且也诱发梭子蟹的应激反应. 糖类是生物体受到胁迫时首要和迅速响应的物质, 糖原被降解成单糖进入血淋巴, 导致血糖浓度升高[28]. 高血糖症是甲壳动物的典型应激反应, 有关甲壳动物在应对急性胁迫时血糖浓度的变化已有诸多报道, 如Racotta等[29-30]的研究表明重复取样和氨氮胁迫均可导致南美白对虾()血糖升高. 本研究中, M1、T1方式均导致蟹的血糖含量升高, 且M1暂存方式的蟹血糖含量显著升高, 两种运输方式血糖含量变化无明显差异. 皮质醇激素分泌量的增加, 常出现于捕捞、装载、运输等产生急性胁迫的过程中[31]. 水生生物中皮质醇是应激反应的指示指标之一[32-33]. 本研究发现, M1组的蟹血淋巴皮质醇含量显著升高, 表明此暂存方式引起蟹的强烈应激. T1组的蟹皮质醇含量略高, 可能是T1运输方式对蟹造成挤压胁迫引起应激反应, 这与彭世明等[34]的研究发现较高的运输密度会引起银鲳()血浆皮质醇含量升高具有一定的相似性. 郭明凯等[35]的研究表明, 应激与水产动物疾病的发生和发展关系密切, 较高的皮质醇含量会使中华绒螯蟹()抗病能力下降, 本实验中M1、T1组的皮质醇含量升高, 可能导致蟹体抗病能力下降. 此外, 皮质醇可促进葡萄糖异生, 急性应激作用下, 血糖浓度随着皮质醇含量的升高而升高, 本研究中M1、T1组蟹血糖含量的升高得此印证. HSP70作为生物体内灵敏的应激蛋白, 在细胞保护、抗凋亡以及免疫治疗等方面有独特的生物学功能, 被认为对生物体适应环境变化具有重要作用[36-38], 其表达量变化直接反映出环境因子对生物机体的影响[39]. 本研究中M1组的蟹HSP70表达含量显著降低, 推测可能是M1暂存方式下蟹体所处环境因子骤变, 迅速导致耐受应激能力下降和机体代谢紊乱, 使HSP70未得到正常表达. 姜娜等[24]研究的干露胁迫对梭子蟹肝胰腺中HSP70表达的影响规律与本实验结果具有相似性. T1方式运输的蟹HSP70表达含量略高, 结合抗氧化指标的变化, 推测可能是此运输方式对蟹体造成挤压, 机体氧化受损, HSP70为修复细胞损伤并维持细胞内平衡而大量表达. 由此得知, M1、T1方式使野生梭子蟹处于应激状态, 对蟹造成“应激损伤”, 使蟹体对环境因子的适应性、抗病能力下降, 这也可能是两种方式下野生蟹暂养存活率低的原因.
综上, M1暂存方式对蟹体造成氧化损伤, 抗氧化能力显著下降, 同时使蟹处于剧烈环境变化的强应激状态, 因此严重影响野生蟹暂养存活率. 不同运输方式的实验结果表明, T1运输方式的蟹受挤压胁迫引起蟹体氧化、应激损伤, 免疫机能降低, 但氧化、应激指标整体与T2无显著差异, 因此T1组蟹存活率略低, 这可能是因为运输方式中条件缓和, 并未对蟹体造成不可逆的剧烈损伤, 加之机体本身具有适应调节机制.
4 结语
本研究表明, 在野生三疣梭子蟹暂养过程中, 可采用绑螯单个体式的暂存方式来降低蟹体损伤, 保证蟹的质量; 运输过程应用单体盒, 将蟹不绑螯单个盛放于单体盒中运输是可行的. 本研究结果可为合理开发利用野生三疣梭子蟹优质资源, 提高野生蟹暂养存活率提供参考.
[1] 胡则辉, 徐君卓, 石建高. 浙江沿海三疣梭子蟹的养殖模式[J]. 现代渔业信息, 2011, 26(3):3-5.
[2] 薛俊增, 堵南山, 赖伟. 中国三疣梭子蟹(Miers)的研究[J]. 海洋学研究, 1997, 15 (4):60-65.
[3] 吴旭干, 汪倩, 楼宝, 等. 育肥时间对三疣梭子蟹卵巢发育和营养品质的影响[J]. 水产学报, 2014, 38(2):170-182.
[4] 万全, 古界明. 河蟹控温暂养保质新技术研究[J]. 现代农业科技, 2008(24):231-232.
[5] Chaiyawat M, Eungrasamee I, Raksakulthai N. Meat quality of blue swimming crab (, Linnaeus 1758) fattened with different diets[J]. Kasetsart Journal - Natural Science, 2009, 43(1):132-142.
[6] 苏志星, 何杰, 许文军, 等. 挤压胁迫对三疣梭子蟹抗氧化和应激能力的影响[J]. 浙江海洋大学学报(自然科学版), 2018, 37(2):95-100.
[7] 郑宽宽, 何杰, 许文军, 等. 海捕三疣梭子蟹的捕捞生产和研究现状[J]. 浙江海洋大学学报(自然科学版), 2019, 38(2):161-167.
[8] 许文军, 金海卫, 丁跃平, 等. 秋冬季三疣梭子蟹(Mies)暂养常见疾病及防治措施[J]. 现代渔业信息, 2004, 19(7):23-25.
[9] 孟庆显, 余开康. 鱼虾蟹贝疾病诊断和防治[M].北京: 中国农业出版社, 1996.
[10] 徐友波, 焦伟, 牟丹丹, 等. 海捕与养殖梭子蟹越冬育肥技术[J]. 齐鲁渔业, 2015, 32(7):25-26.
[11] 刘洪军, 官曙光, 冯蕾. 海水蟹类健康养殖技术[M]. 青岛: 中国海洋大学出版社, 2006.
[12] 胡志德. AME统计学专栏|手把手教你如何解读生存曲线[J]. 临床与病理杂志, 2015, 35(3):349-352.
[13] 尚海涛, 俞静芬, 朱麟, 等. 基于生存分析的三疣梭子蟹无水保活技术研究[J]. 水产科学, 2018, 37(1):73-78.
[14] Xu C, Zhang B, Lin Q, et al. Live attenuatedvaccines delivering SaEsxA and SaEsxB via type III secretion system confer protection againstinfection[J]. BMC Infectious Diseases, 2018, 18:195.
[15] Currie G E, von Scholten B J, Mary S, et al. Urinary proteomics for prediction of mortality in patients with type 2 diabetes and microalbuminuria[J]. Cardiovascular Diabetology, 2018, 17(1):50.
[17] 吴丹华, 郑萍萍, 张玉玉, 等. 温度胁迫对三疣梭子蟹血淋巴中非特异性免疫因子的影响[J]. 大连海洋大学学报, 2010, 25(4):370-375.
[18] Romero M C, Tapella F, Sotelano M P, et al. Oxidative stress in the subantarctic false king crabduring air exposure and subsequent re-submersion[J]. Aquaculture, 2011, 319(1/2):205-210.
[19] 王丽, 韩艳楠, 金珊, 等. 水体Cu2+对三疣梭子蟹主要组织ROS含量和抗氧化能力的影响[J]. 农业环境科学学报, 2015, 34(7):1261-1268.
[20] 姚翠鸾, 王维娜, 王安利. 水生动物体内超氧化物歧化酶的研究进展[J]. 海洋科学, 2003, 27(10):18-21.
[21] Campa-Córdova A I, Hernández-Saavedra N Y, Ascencio F. Superoxide dismutase as modulator of immune function in American white shrimp () [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2002, 133(4):557-565.
[22] 王芸, 李健, 李吉涛, 等. pH胁迫对中国明对虾抗氧化系统酶活力及基因表达的影响[J]. 中国水产科学, 2011, 18(3):556-564.
[23] 孔祥会, 王桂忠, 艾春香, 等. 锯缘青蟹不同器官组织中总抗氧化能力和SOD活性的比较研究[J]. 台湾海峡, 2003, 22(4):469-474.
[24] 姜娜, 王芳, 路允良, 等. 干露对三疣梭子蟹抗氧化和应激能力的影响[J]. 水产学报, 2014, 38(12):1996-2004.
[25] 李涌泉, 王兰, 刘娜, 等. 镉对长江华溪蟹酶活性及脂质过氧化的影响[J]. 水生生物学报, 2008, 32(3):373-379.
[26] Lepage G, Munoz G, Champagne J, et al. Preparative steps necessary for the accurate measurement of malon- dialdehyde by high-performance liquid chromatography [J]. Analytical Biochemistry, 1991, 197(2):277-283.
[27] Meng X L, Liu P, Li J, et al. Physiological responses of swimming crab () under cold acclimation: Antioxidant defense and heat shock proteins [J]. Aquaculture, 2014, 434(1):11-17.
[28] Sancho E, Ferrando M D, Andreu E. Sublethal effects of an organophosphate insecticide on the European eel,[J]. Ecotoxicology and Environmental Safety, 1997, 36(1):57-65.
[29] Racotta I S, Hernández-Herrera R. Metabolic responses of the white shrimp,, to ambient ammonia [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2000, 125(4):437-443.
[30] Racotta I S, Palacios E. Hemolymph metabolic variables in response to experimental manipulation stress and serotonin injection in[J]. Journal of the World Aquaculture Society, 1998, 29(3):351-356.
[31] Strange R J, Schreck C B. Anesthetic and handling stress on survival and cortisol concentration in yearling Chinook Salmon ()[J]. Journal of the Fisheries Research Board of Canada, 1978, 35(3):345-349.
[32] Kubokawa K, Watanabe T, Yoshioka M, et al. Effects of acute stress on plasma cortisol, sex steroid hormone and glucose levels in male and female sockeye salmon during the breeding season[J]. Aquaculture, 1999, 172(3):335-349.
[33] Iversen M, Finstad B, McKinley R S, et al. Stress responses in atlantic salmon () smolts during commercial well boat transports, and effects on survival after transfer to sea[J]. Aquaculture, 2005, 243 (1/2/3/4):373-382.
[34] 彭士明, 施兆鸿, 李杰, 等. 运输胁迫对银鲳血淋巴皮质醇、血糖、组织中糖元及乳酸含量的影响[J]. 水产学报, 2011, 35(6):831-837.
[35] 郭明凯. 恩诺沙星和皮质醇对中华绒螯蟹()免疫功能及肠道菌群的影响[D]. 苏州: 苏州大学, 2012.
[36] 王琦, 李健, 李吉涛, 等. 干露胁迫对脊尾白虾() HSP70和ferritin基因表达的影响[J]. 海洋与湖沼, 2013, 44(2):409-414.
[37] 洪美玲, 陈立侨, 孙新谨, 等. 亚硝酸盐急性胁迫对中华绒螯蟹幼体相关免疫指标和应激蛋白(hsp70)表达的影响[J]. 应用与环境生物学报, 2011, 17(5):688-693.
[38] Mayer M P, Bukau B. Hsp70 chaperones: Cellular functions and molecular mechanism[J]. Cellular and Molecular Life Sciences, 2005, 62(6):670-684.
[39] 曲凌云, 孙修勤, 相建海, 等.热休克蛋白研究进展[J].海洋科学进展, 2004, 22(3):385-391.
Effects of different temporary storage methods and transportation systems on temporary rearing of wild
HAN Shengming1, REN Zhiming1,QIU Xueni1,YANG Hua1, MU Changkao1,2*,WANG Chunlin1,2
( 1.School of Marine Science, Ningbo University, Ningbo 315832, China; 2.Collaborative Innovation Center for Zhejiang Marine High-efficiency and Healthy Aquaculture, Ningbo 315832, China )
is an important marine economic crab in China. The temporary rearing of wildis an economical method to efficiently use natural resources of crab. The study was aimed to explore the method suitable for the temporary rearing of wild. Two modes of the temporary storage were compared, including a group with stacked bodies and with the chela not being tied (M1) and a group with single body and with the chela being tied (M2). Two modes of transportation were also compared, including the group with rubber band tying the chela and stacked in the plastic basket (T1) and the group without rubber band tying the chela and contained in individual box (T2). The effects on their survival rate after rearing for a short period were investigated. And their physiological response characteristics were identified by using several physiological indicators including SOD, T-AOC, MDA, hemolymph glucose, cortisol, and HSP70. The results showed that: (a) In the impact of different temporary storage methods of wild crabs, the cumulative survival rate of crabs in M2 was 91.4%, significantly higher than that of M1 (<0.05), and the survival rate in M1 was 70.0%. According to the detection of the several physiological indexes in crab hemolymph of M1 and M2 groups, the reason for the difference in survival rate between the two groups of crabs may be that the M1 produced damage stress to the crab. The antioxidant and stress capabilities were significantly reduced and the physiological functions and immune defense capabilities are impaired. (b) In the effect of different transportation systems of wild crab, the cumulative survival rate of crabs in T2 was 41.5% which was slightly higher than that in T1 group (>0.05). The survival rate in T1 was 30.8%. According to the detection of the several physiological indexes in crab hemolymph of T1 and T2, the reason for the difference in the survival rate of the two groups of crabs may be that the crabs transported by T1 were subjected to crushing stress. The antioxidant and stress resistance were slightly lower than T2. In conclusion, the wildobtained by the temporary storage method of single body with the chela being tied and the transportation method of not tying the chela and contained in individual boxes is more suitable for rearing.
wild; temporary storage methods; transportation systems; temporary rearing; survival
S968.25
A
1001-5132(2021)01-0008-07
2020−02−08.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
宁波市农业重大项目(2017C110007).
韩胜明(1994-), 男, 山东德州人, 在读硕士研究生, 主要研究方向: 虾蟹类繁育及人工养殖. E-mail: 2997441048@qq.com
母昌考(1976-), 男, 云南曲靖人, 教授, 主要研究方向: 虾蟹类繁育及人工养殖. E-mail: muchangkao@nbu.edu.cn
(责任编辑 韩 超)
