草莓枯萎病病株与健株根际基质真菌群落组成分析
2021-01-07唐冬兰唐泉蒋立奔宋芹芹曹荣祥
唐冬兰 唐泉 蒋立奔 宋芹芹 曹荣祥



摘要:植物根际微生物群落在植物生长发育及病害发生防治方面具有重要作用。由尖孢镰刀菌草莓专化型(Fusarium oxysporum f. sp. fragariae)引起的枯萎病是草莓生产中的典型土传病害,危害极大。旨在揭示草莓植株根际枯萎病真菌群落结构与枯萎病发生之间的关系,从微生物生态学角度对草莓枯萎病的生态防控提供理论依据。以南京地区草莓枯萎病病株和健株根际基质为研究对象,用高通量测序技术检测草莓根际基质的真菌组成。结果表明,草莓枯萎病病株与健株根际基质相比,真菌群落组成发生了显著改变;病株根际基质真菌多样性指数较健株高;病株根际基质中优势属是刺孢菌属,优势种是蚜虫莫氏黑粉菌;健株根际基质中优势属是Pseudothielavia(暂无统一中文名),优势种是Paecilomyces tabacinus(暂无统一中文名);病株根际基质尖孢镰刀菌相对丰度明显高于健株根际基质,提高了14.83倍,表明枯萎病的发生与尖孢镰刀菌含量的大幅度增加密切相关。
关键词:草莓;枯萎病;高通量测序;根际微生物;真菌群落多样性
中图分类号: S154.3;S436.68+4文献标志码: A
文章编号:1002-1302(2021)24-0110-04
收稿日期:2021-04-19
基金项目:江苏省农业科技自主创新资金[编号:CX(20)3017];亚夫科技服务项目[编号:KF(20)1021];江苏现代农业产业技术体系建设项目(编号:JATS[2021]008)。
作者简介:唐冬兰(1983—),女,江苏淮安人,博士,助理研究员,主要从事果树病理学及生物技术研究。E-mail:dofthmlhm@163.com。
通信作者:曹荣祥,副研究员,主要从事草莓栽培与生理研究。E-mail:3060601887@qq.com。
草莓(Fragaria ananassa)素有“水果皇后”之称,其产量在世界小浆果中居首位。近10年来,我国草莓产业发展迅速,已经成为世界草莓生产第一大国,是国内农业增效、农民增收的重要途径之一。但是随着草莓种植面积扩大、栽培年限增加,枯萎病已经逐渐成为草莓生产上的重要病害,其病原菌为尖孢镰刀菌草莓专化型(Fusarium oxysporum f. sp. fragariae)[1]。在我国上海、台湾、北京、江苏、湖北等地均有关于草莓枯萎病发生的报道[2-6]。
目前,草莓枯萎病尚无有效防治药物[7-8],从土壤微生态平衡的角度进行防控应是未来的发展方向[9-10]。现有研究表明,土传病害的发生与植物根际微生物区系的改变存在一定相关性[11-12]。赵卫松等研究发现,马铃薯黄萎病病株根际土壤中的真菌多样性指数低于健康植株,且轮枝菌属菌群的相对丰度显著提高[13];余妙等研究发现,西洋参根腐病的发生可能与根际真菌多样性指数的显著降低和群落结构失衡相关[14]。近年来,随着测序技术的迅速发展,高通量测序技术能够从微生物群落水平分析土传病害发生的可能主导因子,该方法既可克服培养基类型和培养环境对结果的影响,也可检测到无法离体培养的真菌类群,可以更好地揭示病株与健株根际生长介质中真菌的组成及差异[15],从而为草莓枯萎病的防治提供更好的思路和解决方法。
在生产上,为了减少土传病害的发生,采用无土基质进行草莓育苗及栽培的研究越来越多,但是关于无土基质真菌群落结构与草莓枯萎病发生之间关系的研究尚未见报道。因此,本研究以草莓健株和枯萎病病株根际基质为对象,采用Illumina MiSeq高通量测序技术研究草莓根际基质真菌群落结构的变化,以期揭示枯萎病发生与真菌群落之间的互作关系,为草莓枯萎病的防治奠定基础,并为筛选对草莓枯萎病有拮抗作用的有益微生物提供新的思路。
1 材料与方法
1.1 试验时间与地点
本试验于2020年10—12月在江苏省南京市完成。
1.2 试验材料
供试草莓品种为红颊,草莓样品采集于江苏丘陵地区南京农业科学研究所基地,位于江苏省南京市江宁区铜山镇。试验分为2组:发病穴盘育苗基质(SA)组、未发病穴盘育苗基質(SB)组。每组取3个取样点,每个取样点选择5株草莓的根际基质混合而成。在草莓枯萎病发病期,选择健康植株、病株作为研究对象。先将草莓植株的整个根系完整挖出,轻敲根系,将与根系结合较松的土壤弃去,再将与根系紧密结合的土壤用毛刷清理收集。将收集的样品过2 mm筛后,装入无菌自封袋内,保存于-80 ℃冰箱内,用于真菌群落的高通量测序[16]。
1.3 DNA提取、真菌ITS1区扩增、Illumina文库制备和高通量测序
由北京诺禾致源科技股份有限公司完成样品的DNA提取、PCR扩增与产物纯化、Illumina文库的制备和高通量测序工作。使用的引物为ITS5F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)、ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′),采用Illumina HiSeq平台进行双末端测序。
1.4 原始数据处理、可操作分类单位划分及多样性分析
利用QIIME 1.8.0软件对测序数据进行识别、拼接,并去除低质量、非特异扩增序列及嵌合体,得到用于后续分析的有效数据,即Effective Tags。以97%的相似性将所有样品的Effective Tags进行可操作性分类单位(OTU)聚类分析,并筛选出OTU的代表性序列;基于Unite数据库,对OTU代表序列进行物种注释分析,获得每个OTU分类信息,统计样品的物种构成,并在各分类水平(门、纲、目、科、属、种)上统计物种在每个样品与分组中的相对丰度。通过α多样性分析、β多样性分析挖掘样品内和组间的真菌组成多样性差异[17-18]。α多样性分析用于分析样品内真菌群落多样性,β多样性分析用于分析样品间真菌群落构成的差异。
2 结果与分析
2.1 草莓根际基质真菌多样性分析
从草莓病株基质和健株基质中获得的平均有效序列数量分别为65 022、66 417条。由表1可以看出,与健株相比,病株根际基质的真菌多样性指数升高,除辛普森指数外,其他参数均表现出显著差异。
2.2 草莓根际基质真菌群落的特异性分析
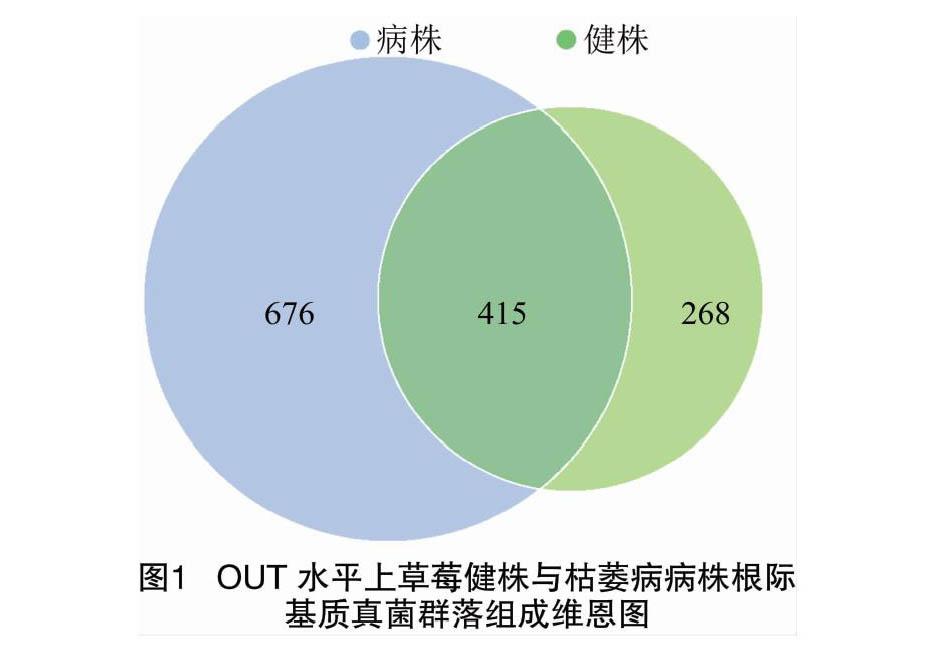
在OTU水平上的特异性分析发现,草莓枯萎病病株和健株根际基质共有的真菌OTU数量为415个,各自特有的OTU数量分别为676、268个(图1)。
2.3 草莓根际基质真菌在门、属、种水平的结构变化
将相对丰度<1%、未能鉴定、未培养及未能注释到相应分类等级的菌群归为其他。门水平上的真菌群落组成分析结果表明,草莓枯萎病病株及健株根际基质中相对丰度最高的门均为子囊菌门(Ascomycota),其次为担子菌门(Basidiomycota),其平均相对丰度分别为43.18%~77.46%、15.17%~37.32%。与健株根际基质相比,枯萎病病株根际基质中担子菌门、被孢霉门(Mortierellomycota)、罗兹菌门(Rozellomycota)、Aphelidiomycota(暂无统一中文名)、芽枝霉门(Blastocladiomycota)的相对丰度提高,分别是健株中的2.46、6.91、1.04、3.26、5.09倍;其他门真菌的相对丰度下降,枯萎病病株根际基质中子囊菌门、壶霉门(Chytridiomycota)、毛霉门(Mucoromycota)、球囊菌门(Glomeromycota)、捕虫霉门(Zoopagomycota)的相对丰度分别为健株根际基质中的55.75%、35.89%、21.04%、26.65%、20.92%(图2)。
属水平上的真菌群落组成研究结果表明,病株和健株根际基质中相对丰度最高的属分别是刺孢菌属(Subulicystidium)和Pseudothielavia(暂无统一中文名)。与健株根际基质相比,草莓枯萎病病株根际基质相对丰度较高的12个属中,除毛壳菌属(Chaetomium)、曲霉属(Aspergillus)、丝衣霉属(Byssochlamys)、红菇属(Russula)和Pseudothielavia的相对丰度降低外,其他属的相对丰度均表现为升高的趋势,其中镰刀菌属(Fusarium)的相对丰度在病株根际基质中较健株根际基质中提高了10.87倍(图3)。
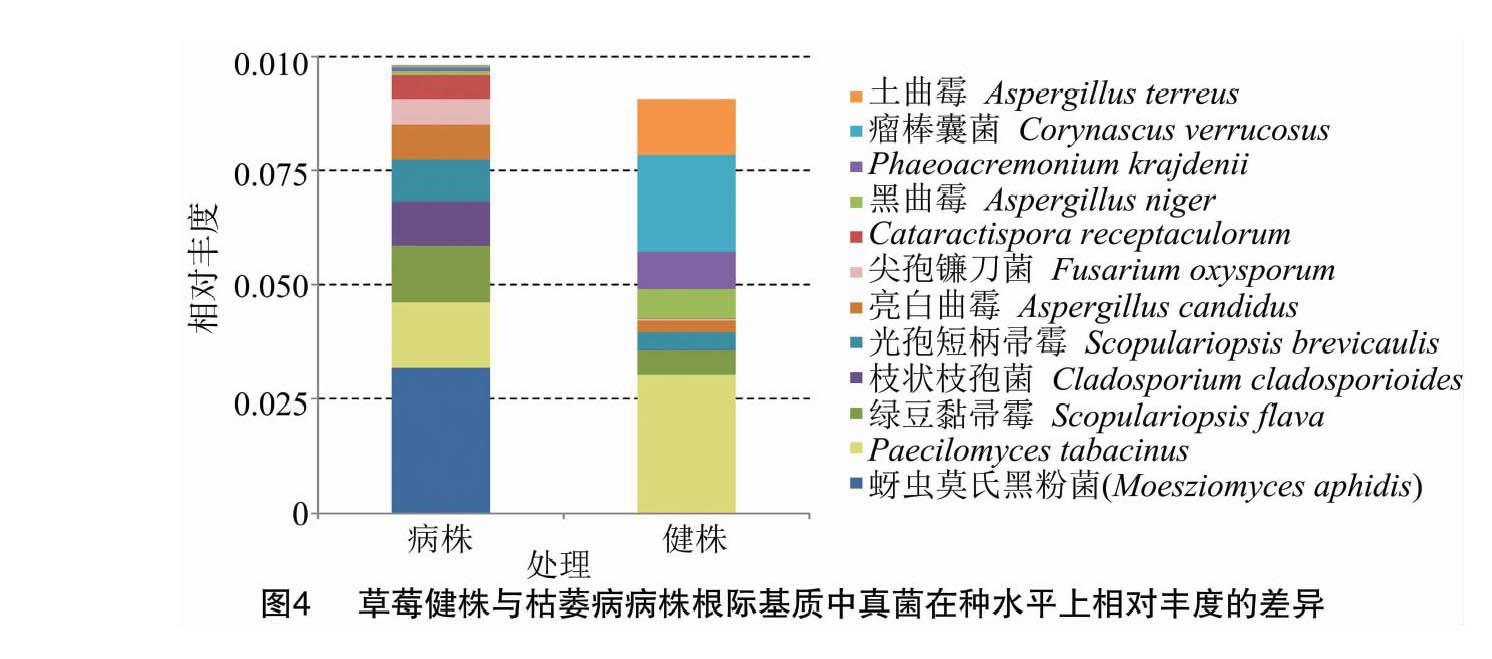
种水平上的真菌群落组成研究结果表明,病株根际基质中相对丰度最高的3个种依次是蚜虫莫氏黑粉菌(Moesziomyces aphidis)、Paecilomyces tabacinus(暂无统一中文名)和绿豆黏帚霉(Scopulariopsis flava),健株根际基质中相对丰度最高的3个种依次是P. tabacinus、瘤棒囊菌(Corynascus verrucosus)和土曲霉(Aspergillus terreus)。与健株根际基质相比,草莓枯萎病病株根际基质中相对丰度较高的12个种中,仅5个种的相对丰度降低,分别为P. tabacinus、黑曲霉(Aspergillus niger)、Phaeoacremonium krajdenii(暂无统一中文名)、瘤棒囊菌和土曲霉,其他真菌的相对丰度均升高,其中尖孢镰刀菌(F. oxysporum)的相对丰度在病株基质中提高了14.83倍(图4)。
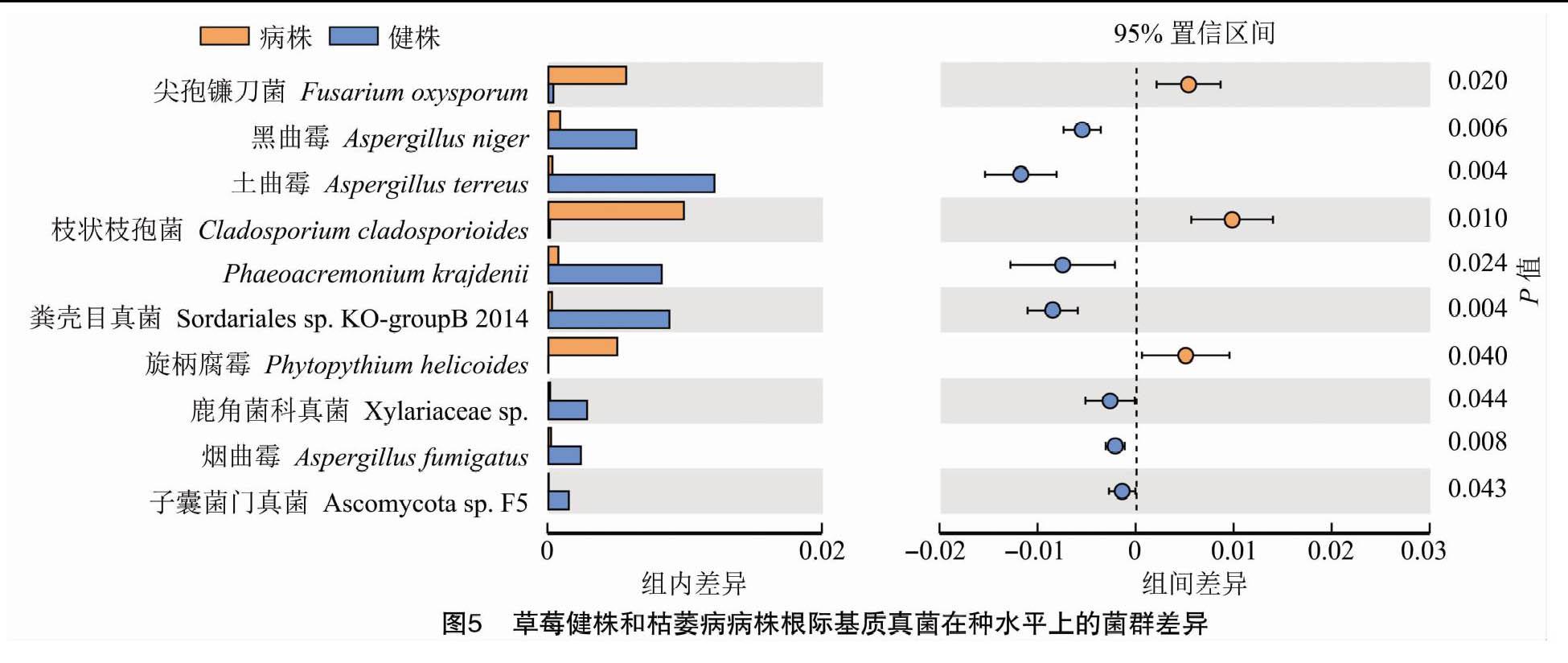
采用独立样本t检验进一步对草莓根际基质真菌种水平的物种差异进行分析。结果表明,在2种基质中,有26个菌群在2种基质中的分布存在显著差异(P<0.05)。由图5可以看出,在平均相对丰度较高的10个菌群中,尖孢镰刀菌(F. oxysporum)、枝状枝孢菌(Cladosporium cladosporioides)和旋柄腐霉(Phytopythium helicoides)等在病株中的含量较高,黑曲霉(A. niger)、土曲霉、P. krajdenii(暂无统一中文名)和烟曲霉(A. fumigatus)等在健株中的含量较高。
3 讨论与结论
土壤微生物群落不仅是植物根系的重要组成部分,而且在植物生长发育及病害防治方面具有重要作用[19]。目前已有大量研究探討了土传病害发病植株根际土壤微生物群落结构的变化。涂祖新等对赣南脐橙黄龙病病株和健康土壤进行分析发现,病株根际土壤中真菌多样性高于健株根际土壤[20]。赵卫松等对马铃薯健株与黄萎病病株根际土壤真菌群落结构的研究发现,病株的根际土壤真菌多样性较健株降低,群落结构也发生了改变,其中黄萎病致病菌轮枝菌属(Verticillium sp.)菌群的相对丰度显著提高[13]。刘海洋等对棉花黄萎病不同发病程度植株根际土壤真菌群落的研究发现,发病程度较重的棉田,植株根际土壤中真菌多样性低于健康及发病程度较轻的棉田[21]。也有研究发现,病株与健株根际土壤中真菌数量及组成没有发生显著变化。综合分析可知,植物病害发生与根际土壤微生物群落结构关系非常复杂,大部分研究认为病害的发生改变了土壤的微生物群落组成,尤其是病株根际土壤中病原菌的数量或相对丰度会增加。
本研究利用高通量测序技术对草莓枯萎病病株、健康植株根际的基质进行了比较分析,发现2种基质中真菌多样性存在显著差异。健株根际中优势属是Pseudothielavia(暂无统一中文名),优势物种是Paecilomyces tabacinus(暂无统一中文名);病株根际中优势属是刺孢菌属,优势种是蚜虫莫氏黑粉菌。尖孢镰刀菌是引起草莓枯萎病的病原菌,本研究发现,枯萎病病株根际基质中尖孢镰刀菌的相对丰度明显高于健株根际基质,相对丰度是健株根际基质的15.83倍,表明草莓枯萎病的发生与尖孢镰刀菌含量的大幅度增加密切相关。此外,在健株根际基质中多种曲霉属真菌的相对丰度高于病株根际基质,包括黑曲霉、土曲霉、烟曲霉,差异均达显著水平(P<0.05),或许可以通过针对性地筛选曲霉属菌群作为候选拮抗菌来抑制草莓枯萎病。
参考文献:
[1]Winks B L,Williams Y N. A wilt of strawberry caused by a new form of Fusarium oxysporum[J]. Queensland Journal of Agricultural and Animal Science,1965,22:475-479.
[2]雷恒树,华战迎,范灵姣,等. 北京地区草莓枯萎病病原的鉴定与防治[J]. 中国农业大学学报,2019,24(6):66-72.
[3]许 媛,成 玮,颜伟中,等. 上海地区草莓枯萎病病菌的鉴定及对4类杀菌剂的敏感性[J]. 江苏农业科学,2020,48(4):115-121.
[4]于红梅,赵密珍,王 静,等. 草莓枯萎病菌的分离、鉴定及生物学特性[J]. 江苏农业科学,2013,41(11):124-127.
[5]郑 莉,朱秋珍,冯自立,等. 草莓枯萎病病原菌鉴定及其生物学特性[J]. 湖北农业科学,2006,4(2):194-195.
[6]钟珮哲,吴添益. 草莓田休闲期土壤管理对萎凋病之抑制效果[J]. 苗栗区农业改良场研究汇报,2017(6):15-25.
[7]伊海静,陈 艳,刘正坪,等. 草莓枯萎病菌的分离鉴定及防治药剂筛选[J]. 西北农业学报,2016,25(4):626-635.
[8]吉沐祥,陈宏洲,吴 祥,等. 8种生物杀菌剂对草莓枯萎病菌室内抑菌活性的测定[J]. 江苏农业科学,2014,42(9):103-106.
[9]高 芬,闫 欢,王梦亮,等. 土壤微生物菌群变化对土传病害的影响及生物调控[J]. 中国农学通报,2020,36(3):160-164.
[10]Tao C Y,Li R,Xiong W,et al. Bio-organic fertilizers stimulate indigenous soil Pseudomonas populations to enhance plant disease suppression[J]. Microbiome,2020,8:137.
[11]Yang H W,Li J,Xiao Y H,et al. An integrated insight into the relationship between soil microbial community and tobacco bacterial wilt disease[J]. Frontiers in Microbiology,2017,8:1-11.
[12]van Bruggen A H C,Semenov A M,van Diepeningen A D,et al. Relation between soil health,wave-like fluctuations in microbial populations,and soil-borne plant disease management[J]. European Journal of Plant Pathology,2006,115(1):105-122.
[13]趙卫松,郭庆港,苏振贺,等. 马铃薯健株与黄萎病株根际土壤真菌群落结构及其对碳源利用特征[J]. 中国农业科学,2021,54(2):296-309.
[14]余 妙,蒋景龙,任绪明,等. 西洋参根腐病发生与根际真菌群落变化关系研究[J]. 中国中药杂志,2018,43(10):2038-2047.
[15]岳丹丹,韩 贝,Ullah A,等. 干旱条件下棉花根际真菌多样性分析[J]. 作物学报,2021,47(9):1806-1815.
[16]伍晓丽,李隆云,王 珏,等. 健康/根腐病黄连根际土壤真菌组成与根部可培养真菌组成分析[J]. 西南农业学报,2020,33(11):2509-2518.
[17]Lozupone C,Lladser M E,Knights D,et al. UniFrac:an effective distance metric for microbial community comparison[J]. The ISME Journal,2011,5(2):169-172.
[18]Lozupone C A,Hamady M,Kelley S T,et al. Quantitative and qualitative β diversity measures lead to different insights into factors that structure microbial communities[J]. Applied and Environmental Microbiology,2007,73(5):1576-1585.
[19]Wagg C,Dudenhoffer J H,van der Heijden M G A. Linking diversity,synchrony and stability in soil microbial communities[J]. Functional Ecology,2018,32(5):1280-1292.
[20]涂祖新,张莉莉,贺伟华,等. 赣南脐橙黄龙病株与健康株的根际土壤真菌群落多样性比较[J]. 安徽农业大学学报,2017,44(2):333-341.
[21]刘海洋,王 伟,张仁福,等. 黄萎病不同发生程度棉田土壤中的真菌群落特征分析[J]. 中国农业科学,2019,52(3):455-465.
