二化螟36 d标准化饲养技术与管理体系
2021-01-07罗智心姚静张茹王利华罗光华方继朝
罗智心 姚静 张茹 王利华 罗光华 方继朝



摘要:二化螟[Chilo suppressalis (Walker)]是我国乃至亚洲各国稻区分布最广的重大水稻害虫之一,近年来其抗药性问题尤为突出。因此,寻求环境相容性更好的二化螟防控手段迫在眉睫,而建立稳定的室内种群和规范化的人工饲养管理体系是开展相关研究的基础。针对目前二化螟室内大规模人工饲养中存在的操作不规范、管理不严格、效率低下等问题,本研究通过区分幼虫人工饲料用量、规范各项饲养操作的时间节点、加强饲养全程的管理等方法,建立了一套成熟的二化螟36 d标准化饲养技术与管理体系。该技术体系操作简单、实用性强,不仅可以满足种群长期继代饲养的基本需求,而且可以随时扩繁,以满足不同虫龄的大规模用虫需求,可作为二化螟室内人工饲养技术规范加以推广。
关键词:二化螟;水稻害虫;人工饲养;技术规范
中图分类号:S435.112+.1 文献标志码: A
文章编号:1002-1302(2021)24-0100-10
收稿日期:2021-06-25
基金项目:国家自然科学基金(编号:31801737、31672024);国家水稻产业技术体系建设专项(编号:CARS-01-37);国家重点研发计划(编号:2016YFD0200805);江苏省农业科技自主创新资金[编号:CX(19)3114]。
作者简介:罗智心(1985—),女,江苏南京人,博士,助理研究员,主要从事农业害虫防控技术研究。E-mail:515958397@qq.com。
通信作者:罗光华,博士,副研究员,主要从事农业害虫综合防控研究,E-mail:luogh_cn@163.com;方继朝,博士,研究员,主要从事水稻害虫防控技术研究,E-mail:fangjc126@126.com。
二化螟[Chilo suppressalis (walker)]是重要的粮食作物害虫,不仅广泛分布于我国乃至东南亞、南亚国家的水稻产区,而且是大部分稻区的螟虫优势种[1-3]。该虫具有钻蛀性危害的特点,运用常规防治手段很难达到理想的效果。近年来,随着我国稻区耕作制度和种植结构的调整、化学农药的不合理使用等原因,二化螟抗药性水平不断提高,发生数量呈明显上升趋势[4-6],这些不利因素促使人们寻求环境相容性更好的害虫防控手段。目前针对二化螟开展的研究涉及面很广,主要包括抗药性监测及机制解析[7-9]、转基因抗螟水稻的选育[10-12]、天敌扩繁和生物防治[13-15]、生长发育调控[16-17]等多项研究,而建立稳定的二化螟室内种群和规范化的人工饲养管理体系是开展相关研究的基础。
20世纪70年代以来,国内外对二化螟人工饲养技术的研究进入高速发展时期。其中在利用天然植物材料的饲养方法方面,水稻种苗饲养法的使用范围较广且沿用至今[18-22],在此基础上发展的茭白、荸荠等新鲜植物材料饲养法亦陆续出现,且饲养效果良好[23-24]。但由于天然食料饲养法在防腐效果、操作复杂程度、饲养规模等方面存在一定的局限性。目前,该类方法多用于特定水稻品种饲养比较,或特定二化螟抗性种群饲养的相关试验[7,9,25-26]。
在半人工或纯人工饲料饲养方法方面,日本学者起步较早并先后研发了二化螟石井饲料[27-28]和釜野饲料[29]。20世纪80年代初期,我国学者尚稚珍等对二化螟1代人工饲料配方及饲养管理方法展开了初步探索[30]。随后胡阳等研发了以稻茎粉、稻糠粉、大豆粉、茭白茎粉等为主要原料的二化螟2代人工饲料配方[31-34],李波等在此基础上优化了该配方,发展出了以新鲜茭白、大豆粉、酵母粉等为主要原料的3代人工饲料配方[35-36]。现有二化螟3代人工饲料配方已趋于成熟,用该人工饲料饲养的试虫在蛹质量、性比等多项适合度指标上均表现良好[25]。与之匹配的室内饲养技术体系也在进一步完善之中,极大地促进了二化螟相关研究工作的开展,包括各种室内品系的筛选和继代保持等[8,37-38]。
值得注意的是,尽管二化螟人工饲料配方已经基本完善,但涉及该虫人工饲养过程中不同试虫龄期的饲养容器大小、饲料用量、种群密度等具体指标和注意事项等的表述尚不够精准。此外,虽然已有研究者对幼虫管理、化蛹管理、羽化管理、产卵管理进行了一定的分类和描述[23],但在各虫态规范化饲养管理方面的表述并不完善,尤其是在各项操作时间节点的选择、标准化饲养管理等方面存在一定的不足。
本研究在总结和优化前人饲养方法的基础上,首次提出以5 d作为室内种群采集虫卵的周期,以 4 d 作为收集虫蛹的周期,以36 d作为单个批次卵块接种至化蛹阶段的幼虫饲养周期;通过对不同虫态操作流程的规范化管理,建立了多批次、重叠循环饲养的新型管理体系——二化螟36 d标准化饲养技术与管理体系。该体系不仅可以满足室内种群长期继代饲养的基本需求,而且可以根据试验用虫量的变化随时扩大繁殖,极大地缩短了不同虫龄、不同虫态试虫的准备周期。此外,该饲养管理体系有效地解决了笔者所在实验室二化螟室内种群饲养规模不稳定的问题,即偶发性的种群规模快速萎缩甚至趋于灭绝的情况。笔者所在实验室采用该体系连续饲养二化螟室内种群超过2年,种群发育状态良好,各项适合度指标稳定,未发生种群规模萎缩现象。该饲养管理体系是对现有二化螟人工饲料饲养方法的补充完善和改进发展,是一种全新的标准化饲养与管理方法,实施效果良好,可作为二化螟室内人工饲养技术规范加以推广。
1 材料与方法
1.1 饲养材料
1.1.1 主要用品 二化螟饲养管理体系所需的主要材料和设备包括幼虫及成虫饲养通用的空调、智能加湿器、多层光照养虫架(长120~150 cm × 宽45 cm × 高180 cm,幼虫用层间距35 cm,成虫用层间距75 cm);还包括幼虫饲养管理及配制人工饲料相关的高温湿热灭菌锅、烘箱、电动榨汁机、电动搅拌器、冰箱、无菌操作台、无菌培养皿(直径 3.5 cm)、不锈钢消毒盘、黑布、松紧带、铝饭盒、卷纸、广口玻璃罐头瓶(240、350 mL)、打孔瓶盖(直径5.3 cm,方形透气孔1.8 cm× 1.8 cm)、整理箱(长18 cm × 宽13 cm × 高14 cm)、铝锅(直径28 cm × 高18 cm)、量杯、剪刀、药匙、移液枪、竹铲子、镊子、漏斗、分液吊舀(125 mL)、毛笔、不锈钢网球(直径4.5 cm)、干燥缸、不锈钢刮刀、一次性圆形饭盒(500 mL,底部 直径8 cm,顶部直径12 cm,高 8 cm)、打孔饭盒盖(直径12 cm,含12个直径2 mm透气孔)。成虫饲养管理相关的养虫笼(长40 cm × 宽40 cm × 高60 cm)、产卵苗(制备方法见“1.1.4”节)、塑料布丁盒(300 mL)、棉花、塑料三角烧瓶(250 mL)等。
1.1.2 主要试剂 二化螟饲养管理所需的主要试剂包括琼脂条、大豆粉、酵母粉、干酪素、蔗糖、威氏盐、复合维生素、胆固醇、头孢氨苄胶囊、对羟基苯甲酸甲酯、山梨酸、抗坏血酸或抗坏血酸钠、氯化胆碱、甲醛溶液(40%)、植物油、方糖块(4.5 g/块)、84消毒液等。
1.1.3 饲养条件 幼虫、成虫养虫室及水稻育苗室均为人工气候室,温度(28±1) ℃,相对湿度70%~80%,光周期16 h光照—8 h黑暗。每日需定时打开排风扇换气6~8次,每次15 min。
1.1.4 产卵苗制备 选取螟蛾低抗水稻品种作为产卵苗品种。笔者所在实验室所用品种为南粳52。通常每周种植15~20杯(约50株/杯)稻苗即可满足常规饲养中采集虫卵的用苗需求。具体制备方法如下:
根据种子千粒质量称取相应质量的水稻种子,置于整理箱中,漂洗干净后加水浸泡,置于水稻育苗室[温度(28±1) ℃,相对湿度70%~80%,光周期16 h光照:8 h黑暗的人工气候室]内12 h。次日将稻种取出淘洗3~5次后滤干,将双层湿纱布覆盖在湿种子上催芽至少24 h,待胚根长出后播种于盛有营养土的200 mL一次性硬质塑料杯中,每杯播种约50粒,并用蛭石覆盖表面,定期浇水,取生长期10~18 d、株高15~20 cm的水稻苗作为产卵苗。
1.1.5 供试虫源 二化螟室内种群的初始虫源由江西省农业科学院提供,该种群在笔者所在实验室的养虫室内连续重叠循环饲养累积超过150批次。
1.2 人工饲料标准化配制流程
二化螟人工饲料中复合维生素B配方参考李波等的配方[35-36],新鲜茭白、水等其他组分含量在原有配方基础上略作调整。具体配制流程如下:
1.2.1 饲料用量规格划分 根据不同龄期幼虫的食量及单瓶接种虫量差异,划分3种饲料用量规格如下:
少量型饲料:1~2龄初孵幼虫食量较小,单瓶接种虫量为800~1 200头/瓶,饲料需求量较少,约为40 mL/瓶。
大量型饲料:3~4龄幼虫食量较大,单瓶接种虫量为150~200头/瓶,饲料需求量最大,约为 120 mL/瓶。
中量型饲料:4~5龄幼虫即将化蛹,故食量较小,单瓶接种虫量固定为50头/瓶,饲料需求量居中,约为60 mL/瓶。
每周配制幼虫人工饲料前,需根据所有试虫种群规模提前计算下1周上述3种规格饲料的使用量。
1.2.2 相关用品的准备 根据计算好的3种规格饲料的使用量,提前将足够数量的饲料瓶(即 240 mL 广口玻璃罐头瓶)、打孔瓶盖、无菌卷纸、分装饲料用的漏斗、分液吊舀等洗净、灭菌、烘干。其中饲料瓶和瓶盖需要用1 ∶100倍稀釋的84消毒液浸泡20 min左右,再用清水洗净后放入灭菌锅灭菌。以下均按照笔者所在实验室常规饲养过程中单周饲料用量准备各项材料。
1.2.3 材料A的制备 称取琼脂条120 g,将其剪成5 cm左右的小段,并将大块的琼脂适当撕散后放入铝锅中。用量杯量取自来水2 400 mL倒入铝锅中,用竹铲子将琼脂按压到水中,浸泡30~45 min,待其泡软后进行步骤“1.2.5”节。
1.2.4 材料B的制备 提前1~2 d采购新鲜茭白1 000 g,置于4 ℃冰箱内保存。配制饲料当天取出,切成1.5 cm左右见方的小块。用量杯量取自来水1 800 mL,将茭白小块分3~4次放入电动榨汁机打成匀浆,将打好的茭白匀浆倒入另一口铝锅中。
称取大豆粉300 g、酵母粉200 g、干酪素100 g、蔗糖100 g,倒入上述盛有茭白匀浆的铝锅中。取1个电动搅拌器的搅拌头将茭白匀浆和其他4种粉末材料手动混合,使粉末浸湿后,再用电动搅拌器充分搅拌均匀。
注意事项:由于先加粉末材料再加茭白匀浆搅拌时,锅底粉末易结块,搅拌不均匀。而先加茭白匀浆再加粉末材料并直接用电动搅拌器搅拌时,粉末容易扬尘干扰操作。故采用上述“加茭白匀浆、加粉末材料、手动简单搅拌、电动充分搅拌”的操作流程。
1.2.5 灭菌与冷却 将盛有材料A、B的2口铝锅、竹铲子、镊子和药匙放入高温湿热灭菌锅中,其中盛放材料A的铝锅置于下方。于121 ℃下灭菌20 min,待冷却至70~80 ℃,迅速取出进行步骤“1.2.8”节。
注意事项:本步骤耗时约100 min,需要注意前后步骤的快速衔接。可利用该时段称取步骤“1.2.6”节中所需的材料C,并提前摆放好步骤“1.2.8”节中所需的饲料瓶。
1.2.6 材料C的制备 称取威氏盐1 g、复合维生素0.171 g、胆固醇2 g、市售头孢氨苄胶囊2粒(约0.25 g,除去外壳,倒出粉末)、对羟基苯甲酸甲酯发10 g、山梨酸10 g、抗坏血酸(或抗坏血酸钠)30 g、氯化胆碱3 g,置于1个干净的350 mL广口玻璃罐头瓶中,将上述微量元素粉末混合均匀后备用。用另一个干净的350 mL广口玻璃罐头瓶取40~50 ℃温开水200 mL备用。
注意事项:(1)氯化胆碱暴露在空气中容易受潮,因此最后称取。(2)本步骤中所有药品需随用随配,通常可利用饲料灭菌的间隙准备。
1.2.7 材料D的制备 准备甲醛溶液6 mL、植物油6 mL。
1.2.8 成品饲料的混合与分装 根据提前计算好的少量型、中量型、大量型3种规格饲料的使用量,将相应数量的饲料瓶提前摆放好,并用铝箔纸覆盖瓶口防尘。
取出灭菌锅中已冷却至70~80 ℃的材料A、材料B。先用镊子将材料B搅拌打碎,再将已经融化的材料A倒入材料B中,用竹铲子搅拌使2种材料初步混合均匀。在材料C的微量元素中加入温开水,用药匙将所有药品粉末搅拌均匀,待药品粉末充分溶解后倒入盛有材料A、材料B的铝锅中。之后用移液枪量取材料D加入铝锅中,用竹铲子搅拌使所有材料混合均匀。混合后的饲料成品体积约为6 500 mL,可分装笔者所在实验室单周饲养所需饲料70~100瓶。
用分液吊舀和漏斗将饲料成品分装于瓶中,完成后用铝箔纸盖好。待所有饲料冷却至28 ℃以下后,取下铝箔纸,用2张无菌卷纸覆盖瓶口,并盖上打孔瓶盖。将所有分装好的饲料置于4 ℃冰箱中冷藏保存。饲料在使用前需提前至少8 h取出,置于人工气候室内回温,之后方可接入试虫。
注意事项:由于冬季室温较低,饲料容易凝固,故需要注意加快分装速度,或提前将室温升至20 ℃以上。冷藏保存超过10 d以上的饲料颜色发黄且水分流失较多,接入试虫后易发霉,故不建议使用。此外,可根据实际配制饲料需求,按比例調整各项材料和试剂的使用量。
1.3 幼虫36 d标准化饲养流程
笔者所在实验室采用的二化螟36 d标准化饲养技术与管理体系,从单个批次1 d的卵块采集与接种,到36 d的四蛹(即第4次收蛹)完成该批次所有操作,时间跨度为36 d(表1),其中涉及的所有步骤均需在无菌操作台上进行。此外,根据实际用虫需求,可在卵块采集与接种、分瓶(即第1次换饲料)、二换(即第2次换饲料)这3个步骤时保留更多的虫量,用于扩大繁殖。具体操作流程如下:
1.3.1 卵块采集与接种(1 d) 以5 d为1个周期,更换成虫饲养中获得的产卵苗,并进行卵块采集与接种。通常于最后一天的人工暗期结束后,从成虫养虫笼内取出产卵苗,并以最后一天的日期作为编号新建1个批次(表1)。次日,将卵块从水稻叶片上剪下,按照其长宽划分为3种规格。其中大卵块为长度15~35 mm、宽度2~5 mm,卵粒数量100~180粒的卵块;中卵块为长度5~15 mm、宽度2~5 mm,卵粒数量30~100粒的卵块;小卵块为长度3~5 mm、宽度2~5 mm,卵粒数量20~30粒的卵块;其他更小的卵块及颜色斑驳不均匀的卵块不收集。因卵块接种用的无菌培养皿直径为35 mm,故需将长度大于35 mm的大卵块剪成35 mm以内的小段。通常将每个批次采集到的卵块平均分为 4~8份(图1-A),每份含有10~20个大中卵块,或20~30个中小卵块,随后进行卵块灭菌及接种。
卵块灭菌处理时,取单份卵块放入不锈钢网球中,浸没于70%乙醇溶液中快速涮洗约20 s,再浸入无菌水中快速涮洗约20 s,取出后用无菌卷纸吸干表面残水,并将卵块分摊开晾干。之后将卵块移入3.5 cm无菌培养皿的盖子或底座中,再移入盛有50 mL甲醛溶液的干燥缸中充分熏蒸约10 min。计时结束后立即取出,置于无菌风下吹约5 min。
卵块接种时,取另一个完整的无菌培养皿,置于少量型饲料的中央位置,之后用无菌镊子取1份已分装好并完成灭菌处理的卵块,置于该完整无菌培养皿上(图1-B);完成后用2张无菌卷纸覆盖瓶口并盖上打孔瓶盖。每3~4个饲料瓶分装于1个整理箱中,用灭菌黑布盖好整理箱,并用白色松紧带封口,完成后移入幼虫养虫室内保存。本步骤少量型饲料用量为4~8瓶。
1.3.2 取皿(6 d) 在卵块接种后6 d,幼虫已基本完成孵化,龄期集中在1~2龄。此时需要进行“取皿”,即取出盛放有残留卵壳的培养皿盖子或底座,以及饲料中央完整的培养皿,并用小毛笔将完整培养皿底部残留的幼虫还原回饲料瓶内(表1、图1-C、图1-D)。完成后盖上无菌卷纸和打孔瓶盖,装箱并封口后,将整理箱放回幼虫养虫室。
1.3.3 分瓶(10 d) 在卵块接种后10 d,幼虫已完成至少1次褪皮,龄期集中在2~3龄。此时需要进行“分瓶”,即将旧饲料切分,接种于新饲料瓶中,故该步骤又称“第1次换饲料”(表1)。通常取1个无菌培养皿的盖子或底座,置于大量型饲料的中央位置,再用药刮将步骤“1.3.1”节卵块接种后被取食过的旧饲料平均切分成4~6块,每块包含约 150~200头幼虫(图1-E);之后随机取其中2~3块旧饲料,分别置于新饲料瓶中央的培养皿盖子或底座中(图1-F)。完成后盖上无菌卷纸和打孔瓶盖,装箱并封口后,将整理箱放回幼虫养虫室。本步骤大量型饲料用量为12~24瓶。
1.3.4 取旧饲料(15 d) 在卵块接种后15 d,幼虫已完成至少2次褪皮,龄期集中在3~4龄。此时需要完成“取旧饲料”,即用无菌镊子取出步骤“1.3.3”节分瓶时盛放有旧饲料残渣的培养皿盖子或底座,挑拣出残渣中的幼虫,还原回饲料瓶内(表1、图1-G)。完成后盖上无菌卷纸和打孔瓶盖,装箱并封口后,将整理箱放回幼虫养虫室。
1.3.5 二换(20 d) 在卵块接种后20 d,幼虫龄期集中在4~5龄。此时需要进行“二换”,即“第2次换饲料”(表1)。通常随机取出步骤“1.3.4”节旧饲料瓶中的100头幼虫,分别投入2瓶中量型饲料中,每瓶50头(图1-H)。 完成后盖上无菌卷纸和打孔瓶盖,装箱并封口后,将整理箱放回幼虫养虫室。本步骤中量型饲料用量为24~48瓶。笔者所在实验室单个批次二换时通常保留1 200~1 600头幼虫,分装入6~8个整理箱中保存,用于后续4次收集虫蛹。
1.3.6 一蛹(24 d) 在卵块接种后24 d,幼虫龄期集中在5龄,且有部分幼虫即将开始化蛹,此时需要进行“一蛹”,即“第1次收集虫蛹”(表1)。通常取1个500 mL一次性圆形饭盒,并在底部加入圆形卷纸片或滤纸片,作为收蛹盒。之后用无菌镊子取出步骤“1.3.5”节饲料瓶中、瓶盖上及无菌卷纸内已褪皮成形的蛹,置于收蛹盒中。用镊子清除饲料表面及饲料瓶侧壁上的虫粪,将幼虫还原回饲料瓶内(图1-I)。完成后盖上无菌卷纸和打孔瓶盖,装箱并封口后,将整理箱放回幼虫养虫室。当盒内收集蛹量达到约200头时,更换新的收蛹盒。收集到的蛹移入成虫养虫室内保存。
1.3.7 二蛹(28 d) 在卵块接种后28 d,幼虫进入化蛹高峰,此时需要进行“二蛹”,即“第2次收集虫蛹”(表1)。具体操作流程同“一蛹”。
1.3.8 三蛹(32 d) 在卵块接种后32 d,幼虫的化蛹高峰即将结束,此时需要进行“三蛹”,即“第3次收集虫蛹”(表1)。具体操作流程同“一蛹”。
1.3.9 四蛹(36 d) 在卵块接种后36 d,幼虫的化蛹高峰基本结束,仅有少量幼虫未完成化蛹。此时需要进行“四蛹”,即“第4次收集虫蛹”(表1)。具体操作流程基本同“一蛹”。完成后用药匙清理瓶中所有饲料残渣及幼虫,集中冷冻48 h后处理,结束该批次的饲养。之后整理清空的饲料瓶、瓶盖、黑布等相关用品,洗净、灭菌、烘干后循环使用。
通常本步骤收集到的虫蛹数量小于200头,故无需更换新的收蛹盒。此外,笔者所在实验室单个批次二换时通常保留1 200~1 600头幼虫,故上述4次收蛹操作累积可获得约1 000~1 300頭蛹(5~6盒)。
按照上述饲养流程,单个批次幼虫饲养全程为36 d,前后2个批次初始日期间隔为5 d,每30 d可新建6个批次,从而实现多个不同批次的重叠循环饲养。
1.3.10 注意事项 除卵块采集以外的所有步骤,即从卵块的灭菌和接种至四蛹的所有步骤均需在无菌操作台上进行。如发现饲料瓶内有细菌、真菌或病毒污染,应立刻将该饲料瓶取出,严禁打开瓶盖,应直接放入灭菌锅进行灭菌处理后方可清洗。幼虫饲养所需的镊子、药匙、饲料瓶、卷纸等相关物品和工具需提前洗净、灭菌、烘干。
1.4 成虫饲养操作规范
将幼虫饲养中收集到的蛹移入成虫养虫室,开始成虫阶段的饲养。具体操作流程如下: (1)取1个成虫养虫笼,置于成虫养虫室的多层光照养虫架上。取1个300 mL一次性塑料碗,加入适量棉花及10%蔗糖水作为糖水碗。将糖水碗置于养虫笼中央,用于成虫补充营养。 (2)取全新的产卵苗4~5杯、幼虫饲养所得的收蛹盒2~3个(含蛹约400~600头),置于养虫笼内,且均匀分散于糖水碗周围。(3)通常在将收蛹盒移入成虫养虫室后的3~5 d为该盒蛹的成虫羽化高峰。待成虫大量羽化并交配产卵后,可取出产卵苗采集虫卵,并按照上文所述各步骤,重复幼虫人工饲料的配制,以及不同批次幼虫36 d饲养和成虫饲养的重叠循环饲养过程。(4)在将收蛹盒移入成虫养虫室后的第10 d,笼内成虫基本死亡后,清理养虫笼内的成虫尸体、产卵苗、糖水碗和收蛹盒,将养虫笼打扫干净,用于循环使用。
注意事项:幼虫和成虫养虫室、水稻育苗室、无菌接种室需定期清洁,通常以每周打扫1次为宜。
1.5 适合度参数调查
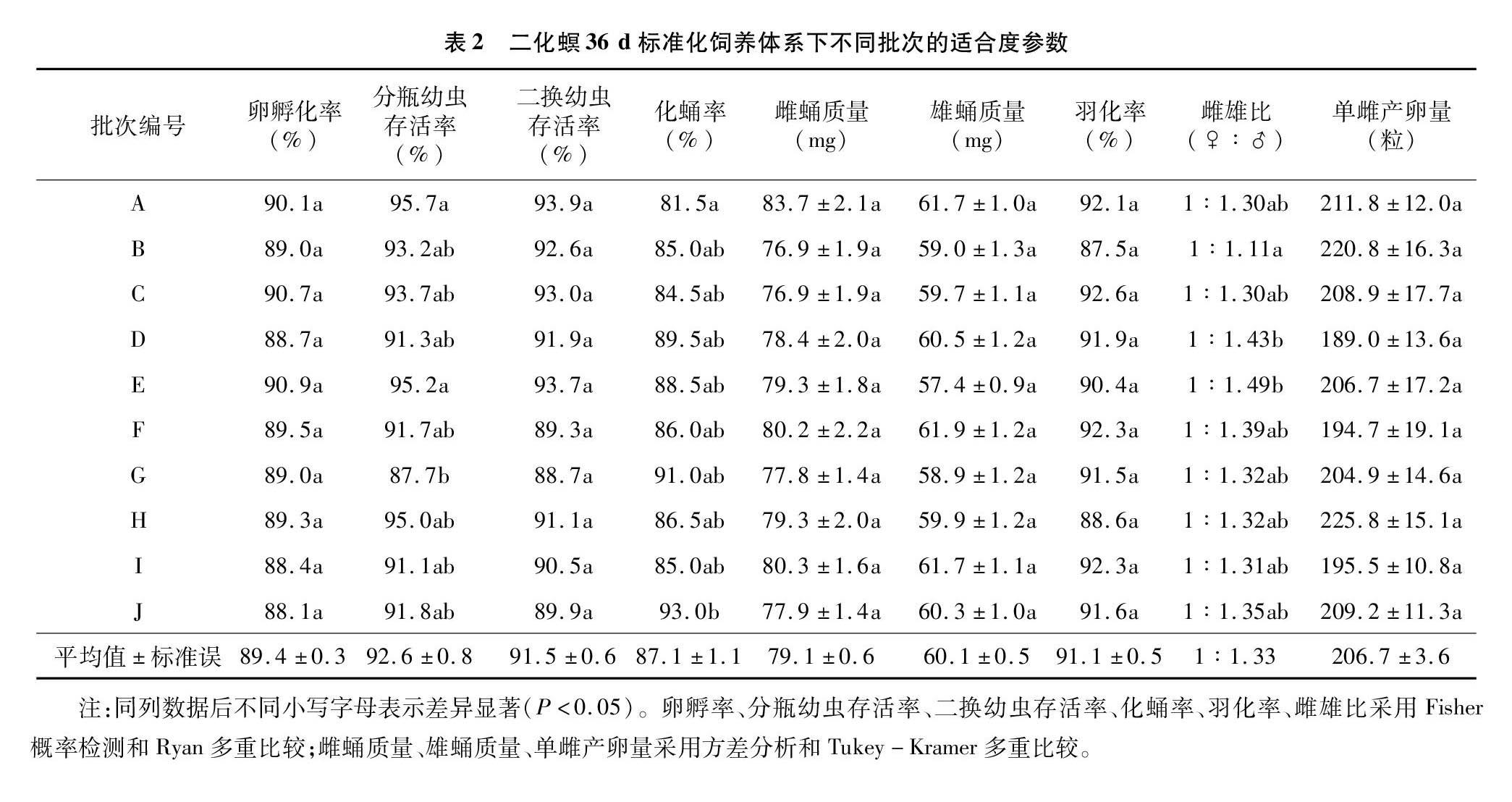
采用上述方法重叠循环饲养二化螟室内种群,并抽样调查10个批次的9项适合度参数。其中每个批次取皿时调查约15个卵块的孵化率,分瓶时调查约300头幼虫的存活率,二换时调查约350头幼虫的存活率,四蛹结束后调查200头幼虫的化蛹率、30~40头雌雄蛹的蛹质量、约200头蛹的成虫羽化率及雌雄比、10头雌虫的产卵量。
1.6 数据分析
采用R 3.1.0 软件对抽样调查的9项适合度参数进行统计分析。其中,卵孵化率、幼虫存活率、化蛹率、羽化率、雌雄比采用Fisher概率检测和Ryan多重比较进行差异显著性分析(P<0.05);雌雄蛹质量和单雌产卵量采用方差分析(ANOVA)和Tukey-Kramer多重比较进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 标准化饲养体系下二化螟的适合度参数
抽样调查36 d标准化饲养技术与管理体系下饲养的10个批次二化螟的9项适合度参数见表2。结果显示除了分瓶幼虫存活率、 化蛹率和雌雄比中的1个批次以外,其余各批次的各项适合度参数之间均无显著性差异。其中卵孵化率为(89.4±0.3)%,分瓶幼虫存活率为(92.6±0.8)%,二换幼虫存活率为(91.5±0.6)%,化蛹率为(87.1±1.1)%,羽化率为(91.1±0.5)%,均大于80%。雌、雄蛹质量分别为(79.1±0.6) mg、(60.1±0.5) mg,单雌产卵量为(206.7±3.6)粒。种群健康稳定,未出现退化现象。结果表明,二化螟36 d标准化饲养技术与管理体系可以满足室内种群长期继代饲养的基本需求。
2.2 循环饲养流程及耗时
笔者所在实验室依照上述标准化饲养体系饲养二化螟室内种群时,以36 d为1个饲养周期,建立单个批次饲养操作流程时间轴(表1)。以A月第25~30天成虫所产卵块新建的饲养批次为例。该批次编号为A-30,在第1天进行卵块采集与接种,第6天进行取皿,直到第36天进行四蛹并结束该批次的饲养。其中第1、10、20天的饲料使用量分别为少量型4~8瓶、大量型12~24瓶,中量型24~48瓶。其余批次各项操作的时间轴以此类推。以每月30 d为例,建立单月循环饲养操作流程(表3)。故每月可新建6个批次(例如C-05至C-30),并结束上一阶段开始的6个批次的饲养(如A-25至B-20)。
如表3所示,以单个批次接种卵块4~8瓶,二换时保留幼虫1 200~2 400头为例,单个批次的各项常规饲养操作耗时如下:(1)卵块采集与接种耗时3.0~4.0 h;(2)取皿耗时约0.2 h;(3)分瓶耗时约1.0 h;(4)取旧饲料耗时约0.8 h;(5)二换耗时2.0~4.0 h;(6)一蛹耗时2.0~4.0 h;(7)二蛹耗时2.5~5.0 h;(8)三蛹耗时1.0~2.0 h;(9)四蛹耗时1.5~3.0 h。故单个批次常规饲养耗时(不含配制饲料耗时)为14.0~24.0 h,可获得1 000~2 000头蛹;每月常规饲养操作耗时约为84.0~144.0 h。
此外,每月还需完成幼虫及成虫饲养管理相关的多项其他操作(表3)。以单个批次接种卵块4~8瓶,二换时保留幼虫1 200~2 400头为例,其他各项相关操作及具体耗时如下:(1)养虫室打扫及养虫笼的清理,耗时约2 h/周;(2)育苗室及养虫室稻苗浇水3次,耗时约3 h/周;(3)成虫养虫笼内糖水碗、收蛹盒和采卵苗的准备,耗时约1 h/周;(4)配制人工饲料所需饲料瓶等用具的清洗、灭菌和烘干,耗时约3.5~6.0 h/周;(5)浸种、催芽和产卵苗种植等相关操作,耗时约2.5 h/周;(6)每月饲养6个批次需配制3~6次人工饲料:耗时约4 h/次,即单个批次饲养全程所需饲料的配制耗时为2~4 h。故每月其他操作耗时约为63~86 h。每月常规饲养操作及其他操作耗时共计147~230 h。
3 讨论与结论
二化螟36 d标准化饲养技术与管理体系通过划分幼虫人工饲料用量、规范各项饲养操作的时间节点、加强饲养全程的管理、多批次重叠循环饲养等方法,使所得种群健康稳定,各项适合度指标良好,饲养效率亦得到了极大地提高。该体系以每5 d采集到的虫卵作为1个批次,并进行多批次重叠循环饲养,因此每5 d中有4 d可以收集到虫蛹;且不同批次成虫羽化高峰互相重叠,消除了整个种群雌雄虫羽化高峰与低谷的时间限制(表1、表3)。利用这种全新的管理体系进行室内继代和规模化饲养时,每天均可获得一定数量的蛹、羽化成虫、新鲜虫卵及不同龄期的幼虫,可以极大地满足多类型试验的用虫需求。
笔者所在实验室已采用该体系连续饲养二化螟累积超过150批次。饲养过程中的各批次适合度指标均保持较高水平,且不同批次之间的各项参数基本一致(表2)。卵孵化率、幼虫存活率、化蛹率、羽化率均高于80%,与已报道的1~3代人工饲料配方的饲养效果[30,31,35]基本一致。雌、雄蛹质量分别为(79.1±0.6)、(60.1±0.5) mg,与尚稚珍等的结果[30]基本持平,但优于其他已报道的人工饲养方法[31]。单雌产卵量为(206.7±3.6)粒,与戴长庚等的报道[4,25]基本一致,但优于其他饲养方法[26,30,33,35-36]。因此,本体系在提高室内种群各项适合度参数的综合效果上,优于其他饲养方法,尤其是可以使产卵量和蛹质量同时提高;所得二化螟室内种群健康稳定,再未出现退化现象;说明本饲养管理体系可以很好满足种群长期继代飼养的基本需求。
如表3所示,本饲养管理体系下单个批次常规饲养耗时为14~24 h,对应用量的饲料配制耗时为2~4 h,可获得1 000~2 000头蛹,与胡阳等所述饲养耗时[31]基本一致。说明本体系有效地降低了人工耗时,提高了饲养效率,并且能够保证正常的室内继代和规模化饲养。通过在饲养过程中设置相关操作的时间节点,可使日常管理更加规范化;多批次重叠循环饲养不仅使每日的饲养工作量均匀分散,避免了单个批次大量饲养时某项操作(如二换、一蛹)的工作量过分集中的问题,而且有利于室内种群的健康稳定发展。在幼虫饲养过程中,通过改变卵块采集与接种(1 d)、分瓶(10 d)、二换(20 d)这3个步骤的初始虫量,可以随时扩大繁殖量,仅需很短的等待周期(1~5 d),便可满足不同虫龄的大规模用虫需求。
在幼虫期饲养管理方面,由于28 ℃下二化螟的卵块在被产下后的5~6 d进入黑头期[22-23],故本饲养管理体系以5 d为间隔周期新建批次,保证了在幼虫孵化前完成卵块的采集和接种,有效地避免了虫量损失。本体系所采用的罐头瓶饲养法操作相对简单,单瓶处理虫量明显大于指形管饲养法[35-36],幼虫饲养前期(即卵块接种至分瓶)和后期(即分瓶至二换)单个容器的处理虫量分别扩大了10~60倍和12~25倍,极大地节约了人工耗时;且本体系对初孵幼虫及2~3龄幼虫的干扰极小,有效地避免了单头转移可能带来的幼虫身体损伤和疾病感染等风险[31]。此外,与接入虫卵后第14~15 d更换1次饲料的指形管饲养法相比,本体系在幼虫饲养全程的第10、20 d更换2次饲料,更能保证人工饲料的新鲜度,因而有效地提高了蛹质量与存活率[30]。
在化蛹管理方面,与需要单独收集老熟幼虫的三角瓶收蛹法[30]相比,本饲养管理体系在一蛹至四蛹的整个化蛹过程中所选用的饲养容器广口罐头瓶更易操作,且仅需每隔4 d集中收集瓶内及瓶盖垫纸上已经成形的蛹,减少了对幼虫化蛹的人为干扰,简化了操作步骤,节约了人工耗时。由于现有二化螟人工饲养方法中对化蛹管理的描述不够细致,或观察和收集虫蛹的时间间隔不明确[23,35],本体系首次将收集虫蛹的时间固定为卵块接种后第24~36 d,间隔为4 d。其中间隔4 d的方法,既保证了虫蛹不会在饲料瓶内羽化,也在一定程度上避免了少量老熟幼虫化蛹前取食虫蛹造成的损失。此外,到第36天的“四蛹”时,已经可以收集到足够的蛹(化蛹率>80%),可充分保证室内种群的正常繁衍。因此,本体系中单个批次幼虫饲养时间截止于第36日。
在成虫的羽化管理方面,由于二化螟室内人工饲养中雌雄蛹发育进度不一致,故单个批次持续饲养时通常需要对雌雄蛹分别进行温度调节,使两性羽化高峰一致,以提高交配及产卵质量[35]。而本研究的循环饲养与交配方法(即多批次重叠循环饲养法),消除了雌雄虫羽化高峰与低谷的时间限制,因此节约了单个批次持续饲养时温度调节、雌雄蛹区分等相关操作的人工耗时,避免了种群生活力衰退的风险,同时保证了种群基因库的完整[23,29-30]。因此,本体系更利于二化螟室内种群的健康稳定发展。
在灭菌管理方面,本研究不仅将饲养相关的饲料瓶、黑布等用具进行灭菌,也注意常规饲养和饲料配制中使用工具的灭菌,以及被污染物的及时处理和养虫室的定期清洁。此外,由于本研究所述卵块接种至化蛹的饲养全过程均在无菌操作台上完成,很好地避免了病原菌的传播和感染风险。
综上所述,二化螟36 d标准化饲养技术与管理体系通过区分幼虫人工饲料用量、规范各项饲养操作的时间节点、加强饲养全程的管理、多批次重叠循环饲养等方法,所得二化螟种群健康稳定,各项生物学指标良好。该体系可使饲养工作量均匀分散,避免了单批次饲养时工作量过分集中的问题,饲养效率亦得到了极大地提高。二化螟36 d标准化饲养技术与管理体系具有操作简单、管理规范、实用性强、节约人工等优点,不仅可以满足室内种群长期继代饲养的基本需求,而且可以随时扩繁,极大方便了各类试验中不同虫龄、不同虫态的大规模用虫需求,也可以用于维持二化螟重要种群或品系。该体系是对现有人工饲养方法的补充完善和改进发展,是一种全新的标准化饲养与管理方法,实施效果良好,可作为二化螟室内人工饲养技术规范加以推广。
致谢:感谢江西省农业科学院黄水金老师提供二化螟室内种群原始虫源,感谢江苏省农业科学院粮食作物研究所朱镇老师及江苏明天种业科技股份有限公司王平老师提供南梗52水稻种子。
參考文献:
[1]鲁艳辉,白 琪,郑许松,等. 不同地理种群二化螟对诱集植物香根草的选择趋性比较[J]. 植物保护学报,2017,44(6):968-972.
[2]盛承发,王红托,盛世余,等. 我国稻螟灾害的现状及损失估计[J]. 昆虫知识,2003,40(4):289-294.
[3]方继朝,杜正文,程遐年. 水稻螟害上升态势与控害减灾对策分析[J]. 昆虫知识,1998,35(4):193-197.
[4]戴长庚,张昌容,李鸿波,等. 染料标记对二化螟生长发育的影响[J]. 应用昆虫学报,2018,55(3):393-398.
[5]彭少兵. 转型时期杂交水稻的困境与出路[J]. 作物学报,2016,42(3):313-319.
[6]张 扬,王保菊,韩 平,等. 二化螟抗药性检测方法比较和抗药性监测[J]. 南京农业大学学报,2014,37(6):37-43.
[7]Xu L,Zhao J,Sun Y,et al. Constitutive overexpression of cytochrome P450 monooxygenase genes contributes to chlorantraniliprole resistance in Chilo suppressalis (Walker)[J]. Pest Management Science,2019,75(3):718-725.
[8]Yao R,Zhao D D,Zhang S,et al. Monitoring and mechanisms of insecticide resistance in Chilo suppressalis (Lepidoptera:Crambidae),with special reference to diamides[J]. Pest Management Science,2017,73(6):1169-1178.
[9]Jiang X J,Qu M J,Denholm I,et al. Mutation in acetylcholinesterase1 associated with triazophos resistance in rice stem borer,Chilo suppressalis (Lepidoptera:Pyralidae)[J]. Biochemical and Biophysical Research Communications,2009,378(2):269-272.
[10]Li Y H,Hallerman E M,Liu Q S,et al. The development and status of Bt rice in China[J]. Plant Biotechnology Journal,2016,14(3):839-848.
[11]Chen M,Shelton A,Ye G Y.Insect-resistant genetically modified rice in China:from research to commercialization[J]. Annual Review of Entomology,2011,56(1):81-101.
[12]Vila L,Quilis J,Meynard D,et al. Expression of the maize proteinase inhibitor (mpi) gene in rice plants enhances resistance against the striped stem borer (Chilo suppressalis):effects on larval growth and insect gut proteinases[J]. Plant Biotechnology Journal,2005,3(2):187-202.
[13]Liu Q S,Romeis J,Yu H L,et al. Bt rice does not disrupt the host-searching behavior of the parasitoid Cotesia chilonis[J]. Scientific Reports,2015,5:15295.
[14]Wu S F,Sun F D,Qi Y X,et al. Parasitization by Cotesia chilonis influences gene expression in fatbody and hemocytes of Chilo suppressalis[J]. PLoS One,2013,8(9):e74309.
[15]Yuan X H,Song L W,Zhang J J,et al. Performance of four Chinese Trichogramma species as biocontrol agents of the rice striped stem borer,Chilo suppressalis,under various temperature and humidity regimes[J]. Journal of Pest Science,2012,85(4):497-504.
[16]Xiao H J,Chen J H,Chen L Y,et al. Exposure to mild temperatures decreases overwintering larval survival and post-diapause reproductive potential in the rice stem borer Chilo suppressalis[J]. Journal of Pest Science,2017,90(1):117-125.
[17]Luo G H,Yao J,Yang Q,et al. Variability in development of the striped rice borer,Chilo suppressalis (Lepidoptera:Pyralidae),due to instar number and last instar duration[J]. Scientific Reports,2016,6:35231.
[18]陆玉荣,苏建坤,吉春明,等. 水稻二化螟的室内饲养方法初探[J]. 安徽农业科学,2003,31(2):270-271.
[19]Tamaki Y,Kamano S,Yushima K. Rearing methods of insects [M]. Tokyo:Japanese Society of Plant Protection,1991:122-125.
[20]尚稚珍,王银淑,邹永华. 二化螟饲养方法的研究[J]. 昆虫学报,1979,22(2):164-168,239.
[21]Sato Y.Technique for mass rearing of the rice stem borer and development studies of new insecticides[J]. Journal of Pesticide Science,1977,2(3):333-343.
[22]Sato Y,Sakai M. Mass rearing of the rice stem borer,Chilo suppressalis (Walker) rearing on rice seedling[J]. Symposium on Rice Insects,1971,197(2):63-67.
[23]郑福山,强承魁,董红霞,等. 二化螟的采集与室内饲养方法[J]. 安徽农业科学,2009,37(17):7837-7838.
[24]孟凤霞,吴孔明,高希武. 利用茭白、荸荠及水稻饲养二化螟的技术研究[J]. 昆虫知识,2003,40(5):469-472.
[25]徐艳博,王孟伦,韩兰芝,等. 人工饲料、转Bt水稻及其亲本稻苗饲养下二化螟种群适合度的比较研究[J]. 应用昆虫学报,2012,49(6):1535-1540.
[26]王世贵.不同食料对人工饲养的二化螟生长发育和产卵量的影响[J]. 植物保护,2001,27(3):1-4.
[27]Ishii S.Nutritional studies of the rice stem borer,Chilo suppressalis Walker,and its mass rearing[J]. Entomophaga,1971,16(2):165-173.
[28]Ishii S. Some problems on the rearing method of rice stem borer by synthetic media under aseptic condition[J]. Oyo Kontyu,1952,8(3):93-98.
[29]Kamano S. Studies on artificial diet of the rice stem borer,Chilo suppressalis Walker. Japanese Journal of Applied Entomology & Zoology[J]. 1971,25:1-45.
[30]尚稚珍,王銀淑.二化螟人工饲料实用化的研究[J]. 昆虫知识,1984,21(1):5-9.
[31]胡 阳,郑永利,曹国连,等. 利用半人工饲料大规模简便化饲养二化螟[J]. 中国水稻科学,2013,27(5):535-538.
[32]刘慧敏,李闪红,王满囷,等. 二化螟人工饲料关键因子的优化及其优化配方的饲养效果[J]. 昆虫知识,2008,45(2):310-314.
[33]刘慧敏,张国安.用正交试验法优选二化螟人工饲料配方[J]. 昆虫知识,2007,44(5):754-757.
[34]刘慧敏,李闪红,王 满,等. 二化螟人工饲料研究初报[J]. 昆虫知识,2005,42(6):714-716.
[35]李 波,韩兰芝,彭于发.二化螟人工饲养技术[J]. 应用昆虫学报,2015,52(2):498-503.
[36]Han L Z,Li S B,Liu P L,et al. New artificial diet for continuous rearing of Chilo suppressalis (Lepidoptera:Crambidae)[J]. Annals of the Entomological Society of America,2012,105(2):253-258.
[37]何 珊,徐杨洋,韩兰芝,等. 二化螟Cry1Ac汰选品系对不同Bt蛋白的敏感性[J]. 植物保护学报,2017,44(3):371-376.
[38]周艳聪,徐杨洋,陈秀萍,等. 二化螟Cry1Ac敏感和耐受品系的适合度差异及中肠蛋白酶活性比较[J]. 环境昆虫学报,2015,37(5):996-1002.
