彩色多普勒超声联合乳腺钼靶对乳腺导管原位癌诊断的临床应用价值
2021-01-07左晓林陈成生苏巧斌
左晓林,陈成生,胡 伟,苏巧斌
(福建医科大学附属闽东医院 福建 宁德 355000)
女性乳腺导管原位癌(ductal carcinoma in situ,DCIS)又称导管内癌,绝大多数在终末导管小叶单位内的小导管或腺泡化的小导管内病变,是一组肿瘤性导管内病变,其不一定转化为浸润癌,但进展为浸润性癌的危险较常人增高,约20%~30%DCIS可发展为浸润癌。自1983年乳腺钼靶检查推广,DCIS的检出率逐渐增多,但钼靶主要针对微钙化检出较敏感,而对无成簇微钙化的DCIS诊断比较困难。随着高频超声、乳腺钼靶等影像技术的快速发展,DCIS的新发病例数明显增加,目前已占乳腺癌新发病例的12%~20%[1]。诊断DCIS,彩色多普勒超声可以清晰显示DCIS在腺体的具体位置、外形、结节大小、内部回声及血流信号情况,为DCIS的临床诊断提供较为有用的影像资料。本文旨在探讨彩色多普勒超声联合钼靶在DCIS诊断方面的临床应用价值。
1 资料与方法
1.1 研究对象
选取我院2017年7月—2019年7月经本院手术、活检及病理证实DCIS病例32例。所有病例均为女性,年龄在28~74岁间,平均年龄(45.00±10.48)岁,全部患者均在术前于我院超声科行常规彩色多普勒超声检查,所有患者均无乳腺癌家族史及既往史。排除诊断标准为首次活检证实为DCIS而后行乳房切除术病理发现为浸润癌的患者,本组乳腺DCIS病例术前均没有行新辅助化疗或激素替代治疗。
1.2 仪器与方法
(1)使用GE LOGIQ S8和日立 VISION Avius等彩色多普勒超声仪器,探头频率为7~12MHz。所有受检者采取平卧位,双侧乳腺和双侧腋窝扫查全面,特别是乳房边缘及乳头乳晕区,如发现可疑病变区域,多角度多切面观察,尽量显示病变细节。观察结节的大小、外形、内部回声、微钙化及血流信号情况,测量血流速度(Psv)和阻力指数(RI)。(2)医学统计分析依据DCIS病理学特性将病例分为高级别DCIS和中-低级别DCIS两组,对照超声、钼靶对不同级别DCIS的诊断准确率及超声表现(分析结节大小、外形、微钙化、血流信号及RI)的不同。数据分析采用SPSS 16.0软件包,数据对照采用卡方检验,P<0.05时有统计学差异。
2 结果
32例DCIS患者中行彩色多普勒超声检查出乳腺结节的有30例,其中出现于左乳的结节有16例,出现于右乳的结节14例。出现在外上象限有20例,出现在乳晕区有5例,另外5例位于其他象限。
32个DCIS患者中,有11例高级别DCIS(图1),有21例中-低级别DCIS(图2)。彩色多普勒超声诊断22例(68.75%)为典型恶性或恶性可能,诊断8例典型良性或良性可能(误诊),诊断正常(漏诊)2例。出现8例误诊均为低级别DCIS,出现漏诊2例患者中,1例为高级别DCIS,1例为低级别DCIS。彩色多普勒超声诊断高级别DCIS和中-低级别DCIS的诊断符合率分别为90.9%(10/11)和57.1%(12/21),彩色多普勒超声在两组DCIS的诊断符合率上存在显著性差异。
30例DCIS,彩色多普勒超声均表现为实性低回声,结节最大直径为5~46mm,平均(18.82±11.06)mm,高级别DCIS平均(22.23±13.55)mm,中-低级别DCIS平均(15.87±8.99)mm,F=2.623,P>0.05,两组结节大小比较上无统计学意义差异。
微钙化检出率50.0%(15/30),高级别DCIS与中-低级别DCIS微钙化检出率分别为81.8%(9/11)和31.58%(6/19),两组比较存在显著性差异(P<0.01),见表1。
外形不规则的占60%(18/30),高级别DCIS与中-低级别DCIS结节外形不规则的分别为81.8%(9/11)、47.36%(9/19),两组比较有统计学差异(P=0.044),见表1。
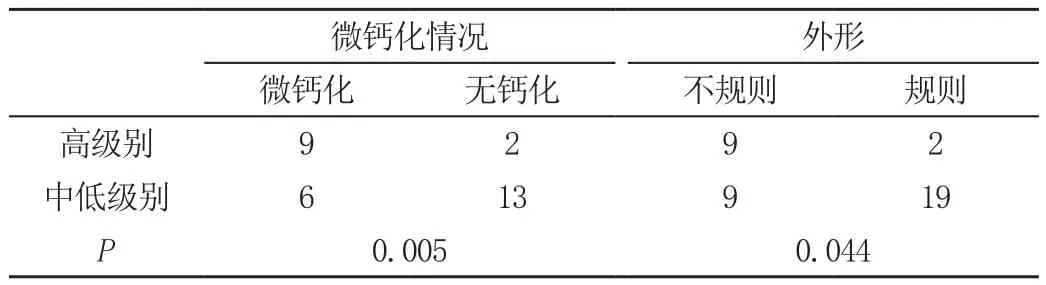
表1 超声对不同级别DCIS的微钙化和外形的比较(例)
血流信号丰富(Ⅱ级以上)的结节占43.3%,高级别DCIS占56.7%,中-低级别DCIS占43.3%,两组比较无显著性差异;其中18例DCIS可测及血流阻力指数(RI),有16例RI>0.70,其中高级别DCIS10例,中-低级别6例,两组比较无显著性差异。
3 讨论
DCIS是因乳腺导管上皮细胞非典型性增生,但恶性病灶仅仅发生于导管基底膜内的异质性肿瘤,其来源于远端末梢导管。以往文献多将DCIS分为肿块型、导管型、单纯微钙化型等[2]。有统计显示[3],我国DCIS的发病率占20%以上,部分地区甚至超过40%,致死率高,且发病率逐渐趋向年轻化,引起了广泛关注与重视。因此,早诊断,早治疗是DCIS的治疗原则,能显著提高患者生存率[4]。
微钙化为浸润性乳腺癌的特异征象,其原理是肿瘤局部缺血、坏死、钙盐沉积所致,低级别DCIS内没有坏死,乳腺钼靶为成簇的细颗粒状微小钙化影像。彩色多普勒超声仅仅表现病灶内或周边稀疏散在分布针尖样强回声,难以辨认。本研究病例中大多被误诊为良性可能。部分中级别DCIS可出现局部坏死,但没有表现成蔟微小钙化与低级别DCIS类似,或者表现出低级别DCIS与高级别DCIS两者的声像图特征,彩色多普勒超声同样表现散在分布的针尖样强回声。高级别DCIS病理学典型特征为粉刺样坏死,乳腺导管内出现大量细胞坏死碎屑,没有出现针尖样强回声较常见,而乳腺钼靶表现线状、成簇状微小钙化灶。彩色多普勒超声声像图表现为沿(或不沿)导管走行的成簇针尖样强回声、斑点状强回声,因此较容易甄别。少数DCIS球体感不明显,仅仅表现出散在分布的微钙化。本研究病例行彩色多普勒超声检查发现针尖样强回声时需高度警惕,必须结合乳腺钼靶检查综合分析后给予诊断。需要注意的是导管中一旦有透声差且管腔内小低回声区时,应提高警惕及时采取进一步检查[5-6]。
8例彩色多普勒超声诊断良性病变其声像图特征为外形规则,边界清晰实性低回声结节5例,壁厚囊性结节2例,囊实混合性结节1例。其超声表现与良性病变相类似,后经手术、病理确认为低级别DCIS。上述病例中7例为导管内乳头状瘤伴局部导管低级别DCIS,1例表现非典型性增生病灶伴低级别DCIS。被误诊7例乳头状瘤伴局部低级别DCIS的声像图特征近似乳腺导管乳头状瘤,这是引起诊断错误的首要原因。彩色多普勒超声诊断导管内乳头状瘤,对扩张导管部分要认真仔细扫查,避免加压,注意导管内及周边有无微钙化、粗大穿入型血流信号等,以免漏诊乳腺DCIS。遇到良恶性难以判断时须结合病史、乳腺钼靶及超声造影检查后综合分析给出结论。研究表明[7],在乳腺恶性肿瘤的早期,肿瘤即诱发大量新生血管,新生血管的形成往往早于肿瘤形态学上的变化,这为早期乳腺癌的超声造影诊断提供了重要的理论依据。近年来,超声造影技术在乳腺疾病中的应用有了一定的发展。目前,大多数乳腺超声造影的研究主要集中于对良恶性肿块的鉴别诊断上,其诊断价值存在一定的争议[8-9]。常规超声联合超声造影的优势在于DCIS的声像图不典型时,尤其是表现为多发的边界不清的小低回声区及局部乳腺结构紊乱,常规超声鉴别困难,造影检查可以发现病灶内较丰富的造影剂进入剂造影后病灶范围扩大等特征,根据经验可以作出乳腺导管内癌的诊断[10]。
低级别DCIS和高级别DCIS遗传学表现存在明显不同,高级别DCIS可能转变为分化差的浸润性导管癌或髓样癌,而低级别DCIS可能转变为分化较好的浸润性导管癌。本研究病例中高级别DCIS超声声像图特征均表现为实性低回声,绝大多数外形不规则,存在微钙化及粗大穿入型血流信号,与浸润性乳腺癌的部分特征相似,但没有出现典型毛刺征、成角征等。然而低级别DCIS大部分表现边界清晰,彩色多普勒超声没有检出针尖样强回声,声像图也没有典型浸润性乳腺癌的超声特征。
2例漏诊的DCIS仅见导管扩张,此时联合乳管镜和(或)乳腺钼靶检查以提高超声诊断准确率。
4 结论
总而言之,早期明确诊断乳腺DCIS对其后续治疗非常重要。一旦出现疑似DCIS症状,须高度重视,及时行超声检查。高频超声诊断DCIS具有两点优势:(1)操作简单,具无创性、价格低廉,可短期内重复检查;(2)提高超声联合钼靶对乳腺DCIS的早期诊断率,尽早明确诊断,临床及时干预,能够改善患者预后。
