低氧环境对椎间盘自发性吸收的影响及其作用机制
2021-01-07卢岩凯陈宏亮袁峰陈聆华谷涛邵礼晖范煜昕
卢岩凯 陈宏亮 袁峰 陈聆华 谷涛 邵礼晖 范煜昕
临床上大部分腰椎间盘突出症患者通过保守治疗后可获得较为令人满意的生活质量。但是,对腰椎间盘大块突出患者,尤其是当突出物对硬膜囊的压迫超过1/3使神经根受到明显挤压时,手术治疗效果更好[1]。随着医学影像学的发展,腰椎间盘大块突出组织自发性吸收的相关报道越来越多[2-3]。腰椎间盘突出组织自发性吸收可以被认为是腰椎间盘突出症的自然转归,但临床上这一现象的发生仍有偶然性。关于是否存在促进椎间盘组织自发性吸收的微环境及其作用机制目前仍不明确。缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是缺氧反应的主要调节剂。在缺氧条件下,其调节亚基缺氧诱导因子-1α(HIF-1α)的降解受到阻碍,在细胞中迅速聚集[4]。同时,HIF-1α的活性增强,移至细胞核,与HIF-1结合并形成活化的HIF-1蛋白质。HIF-1参与细胞存活和凋亡的平衡调节,在细胞凋亡过程中发挥的作用随细胞类型不同而变化[5]。在不同细胞中,HIF-1显示出促进或抵抗细胞凋亡的不同效果。水通道蛋白(aquaporin,AQP)是具有选择性水渗透性的膜通道蛋白质家族,与晶状体的主要内在蛋白质同源[6]。在缺氧条件下水通道蛋白3(AQP3)的表达下降,而在复氧后会增加[7]。本研究在不同时效低氧环境下培养兔髓核细胞,观察各组髓核细胞中HIF-1α、3 型酸敏感离子通道(acid-sensing ionchannel 3,ASIC3)及AQP3的表达,通过对髓核细胞凋亡率的检测探讨促进自发性吸收的最优环境及其可能机制,以期为临床腰椎间盘突出症的保守治疗提供依据。
资料和方法
一、资料
1.实验动物:SPF级成年日本大耳兔9只(南昌龙平兔业有限公司,中国),雌雄不限,平均体质量2 kg。实验在深圳中洪博远生物技术有限公司进行并完成。动物实验方案经徐州医科大学附属医院动物实验伦理委员会审查通过。
2.试剂和仪器:DMEM/F-12培养基、胎牛血清、Opti-ME培养基、减血清培养基和Lipofectamine 3000试剂(Gbico公司,美国);Trizon试剂(总RNA提取)、超纯RNA提取试剂盒(ultrapure RNA)、HiFiScript cDNA 第一链合成试剂盒和UltraSYBR Mixture(康为世纪公司,中国);蛋白酶-EDTA消化液(0.25%)不含酚红(Invitrogen公司,美国);荧光聚合酶链反应仪(上海伯乐生命医学产品有限公司,中国);低温高速离心机(常州中捷实验仪器制造有限公司,中国);NovoCyteTM流式细胞仪(杭州艾森生物有限公司,中国);细胞周期染色试剂盒(杭州联科生物技术股份有限公司,中国);旋涡混合器(常州越新仪器制造有限公司,中国);单道可调移液器(上海宝予德科学仪器有限公司,中国);CO2培养箱(上海皓庄仪器有限公司,中国);三目倒置显微镜(上海领成生物科技有限公司,中国)。
二、方法
1.髓核细胞的获取、鉴定和分组:9只兔经耳缘静脉注射空气处死,于70%乙醇溶液中浸泡3 min。沿兔背部脊柱正中线剪开皮肤,分离并剥开椎旁肌,取出脊柱。仔细剥离椎体周围所附着的肌肉及软组织,以尖刀轻轻切开纤维环,暴露髓核组织。以眼科镊小心夹取胶冻样髓核组织,以眼科镊及组织剪去除残留的纤维环和终板,将髓核组织剪成1 mm×1 mm×1 mm大小碎块。将剪碎的髓核组织置入0.1%Ⅱ型胶原酶液中37 ℃消化15~20 min,期间用吸管轻轻吹打,待大部分组织被消化、培养液浑浊后,用100目不锈钢网进行过滤。悬液1 000 r/min,离心8 min,混悬计数细胞,以(1×105)/ml接种到6孔培养板和培养皿中。生长培养液为DMEM/F-12,置于37 ℃、5% CO2孵箱中培养。于倒置显微镜下观察细胞形态。第6天进行第1次换液,以后每隔3 d换液1次,记录融合至90%的时间。待细胞融合至90%后以0.25%胰蛋白酶液消化并传代。髓核细胞爬片后行HE染色和甲苯胺蓝染色鉴定。将生长良好的髓核细胞制成细胞悬液。将所获得的每只兔髓核细胞分为5组进行培养:对照组(常氧浓度下培养6 h)、低氧6 h组(2% O2浓度下培养6 h)、低氧12 h组(2% O2浓度下培养12 h)、低氧24 h组(2% O2浓度下培养24 h)和低氧48 h组(2% O2浓度下培养48 h)。
2.各组髓核细胞凋亡率检测:取生长良好的兔髓核细胞,以1 ml 磷酸盐缓冲液冲洗每个孔2次,并置入200 μl含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰蛋白酶液中进行消化,制备细胞悬液。将所得细胞悬液以2 500 r/min 离心3 min,弃上清液。加入磷酸盐缓冲液1 ml,以2 500 r/min再次离心3 min,弃上清液。每管各加入磷酸盐缓冲液300 μl,混匀。每管各加入Annexin V-FITC 双标记试剂5 μl 和 胰蛋白酶抑制剂5μl,轻微混匀,室温下避光孵育10 min后以流式细胞仪进行检测。在流式细胞仪上,通过FITC通道检测Annexin V-FITC双标记髓核细胞(Ex=488 nm;Em=530 nm),通过PE通道检测胰蛋白酶抑制剂。
3.各组髓核细胞中HIF-1α、ASIC3及AQP3 mRNA表达水平检测:采用实时聚合酶链反应法(real-time PCR,RT-PCR)。以Trizol法提取各组细胞中总RNA。取总 RNA 1μg进行逆转录。以 GAPDH 为内参设计引物:HIF-1α上游为5'-TTTGATTTTACCCATCCGTG-3',下游为5'-CTTCCAGGTGGCAGACTTTA-3';ASIC3 上游为5'-GAGCAGAAGAAGGCTTACGAA-3',下游为5'-TAGAGGCGAGTGACGAGGT-3';AQP3上游为5'-TGGCTACGCTGTCAACCCT-3',下游为5'-ACGAAGACGCCCGCAAT-3'。对通过逆转录合成的cDNA 1 μl 进行 RT-PCR 扩增。反应条件为 95 ℃预变性10 min,95 ℃变性10 s,55 ℃~59 ℃退火30 s,72 ℃延伸 30 s,40 个循环。反应完毕后进行产物溶解曲线分析以判断反应的特异性,并通过2-ΔΔCt 得到目的基因的相对表达量。

结 果
一、兔髓核细胞的鉴定
兔髓核细胞HE染色效果良好,组织结构清晰,细胞核内染色质与胞质内核糖体呈紫蓝色,细胞质和细胞外基质中的成分呈红色(图1,2)。甲苯胺蓝染色效果良好,组织结构清晰,软骨细胞呈深蓝色(图3,4)。
图1 显微镜下见兔髓核细胞(HE,×40)

图2 显微镜下见兔髓核细胞(HE,×100)
图3 显微镜下见兔髓核细胞(甲苯胺蓝,×40) 图4 显微镜下见兔髓核细胞(甲苯胺蓝,×100)
二、各组兔髓核细胞凋亡率的比较
与对照组比较,低氧各组髓核细胞凋亡率均明显升高,差异均有统计学意义(均P<0.01);与低氧12、24和48 h组比较,低氧6 h组细胞凋亡率最高,差异均有统计学意义(均P<0.01)。见图5。
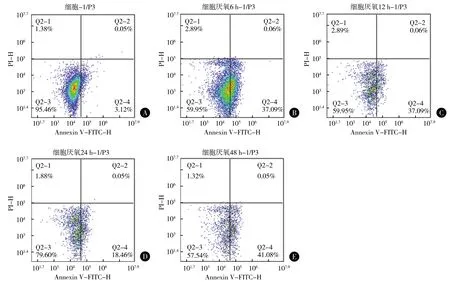
图5 各组兔髓核细胞凋亡率比较 A 对照组 B 低氧6 h组 C 低氧12 h组 D 低氧24 h组 E 低氧48 h组
三、各组兔髓核细胞HIF-1α、ASIC3 和AQP3 mRNA表达水平的比较
与对照组比较,低氧各组HIF-1α、ASIC3 mRNA表达水平均明显上升,差异均有统计学意义(均P<0.01);与低氧12、24和48 h组比较,低氧6 h组HIF-1α、ASIC3 mRNA表达水平最高,差异均有统计学意义(均P<0.01)。与对照组比较,低氧各组AQP3 mRNA表达水平均明显下降,差异均有统计学意义(均P<0.01)。见表1。

表1 各组兔髓核细胞HIF-1α、ASIC3 和AQP3 mRNA表达水平的比较
讨 论
腰椎间盘突出组织自发性吸收是指腰椎间盘突出组织未经消融或手术治疗等措施自发缩小甚至完全吸收的现象。关于其机制目前尚不明了,得到相对公认的机制包括炎性细胞的吞噬作用、突出组织血管化、免疫反应、金属基质蛋白酶和组织金属蛋白酶抑制剂的作用等[8-10]。文献报道细胞凋亡也可能在其中起重要作用[11]。然而,是否存在一个可以促进腰椎盘突出组织自发性吸收进程的微环境?目前仍未知。本研究在不同时效的低氧环境下培养兔髓核细胞,观察细胞凋亡情况,检测细胞HIF-1α、ASIC3和AQP3 mRNA表达水平,从而探讨缺氧环境对腰椎间盘突出组织自发性吸收的影响及其可能的作用机制。
椎间盘的微环境以低氧为特征,椎间盘细胞通过限制氧的消耗来适应局部缺氧环境。其中HIF-1α是缺氧时调节细胞能量代谢和存活能力的关键调节因子[12]。Ha等[13]发现破裂的椎间盘组织中HIF-1α的含量较未破裂椎间盘组织显著升高,认为HIF-1α在椎间盘自发性吸收中起重要作用。但是截至目前为止,对HIF-1α与细胞凋亡间的关系仍未完全阐明。Zeng等[14]研究发现HIF-1α可诱导大鼠髓核细胞半乳糖凝集素-3的表达,从而抑制由凋亡相关因子介导的细胞凋亡进程,因此认为HIF-1α可能有抑制髓核细胞凋亡的作用。但也有学者提出与之相反的观点,通过实验发现严重缺氧及高表达的HIF-1α可能促使髓核细胞凋亡,认为通过HIF-1α的高表达来促使部分细胞凋亡有助于在不利环境下维持椎间盘的内稳态[11-15]。本研究在不同时效低氧环境下培养兔髓核细胞,与对照组相比其凋亡率均明显升高,表明低氧环境下可以促进细胞凋亡,且以低氧培养6 h时细胞凋亡最为明显。此时伴随的HIF-1α mRNA高表达,可能与低氧环境下细胞凋亡密切相关,在后续研究中可通过加入其特异性阻断剂来进一步揭示其内在联系。
髓核为无血管的组织,被包裹在纤维环内,可被认为是一个特异性抗原。随着纤维环撕裂,髓核组织突出,将导致机体自身免疫反应,从而引起一系列炎性反应。组织学研究结果显示突出的髓核组织内有大量新生血管长入,存在巨噬细胞、淋巴细胞和肥大细胞等炎性细胞浸润[16-18],从而促进了椎间盘自发性吸收的进程。因此炎症水平的高低与突出的髓核组织自发性吸收密切相关。有研究结果表明,激活ASIC3可促进多种炎性因子如TNF-α和IL-6的表达[19],同时HIF-1α与缺氧状态下机体众多炎性因子表达、免疫反应的各种应答机制密切相关[20]。本研究发现低氧各组细胞ASIC3 mRNA表达水平均明显高于对照组,以低氧6 h组最为显著,同时ASIC3 mRNA表达水平与HIF-1α mRNA表达水平呈同步状态。ASIC3和HIF-1α mRNA表达水平上调使局部炎性反应加强,通过炎性细胞的吞噬作用促进突出髓核组织自发性吸收。HIF-1α和ASIC3之间是否存在协同促进作用有待进一步研究。
AQP 是一种膜主体内在蛋白,可以介导自由水分子的跨生物膜转运[21]。在形态学上,细胞凋亡的特点之一是水流失和体积缩小。高励斌等[22]研究发现通过抑制AQP3的表达可降低细胞自噬水平从而促进细胞凋亡。本研究发现低氧环境下髓核细胞AQP3 mRNA表达水平较对照组明显下降,与细胞凋亡率呈负反馈关系,提示AQP3可能也参与了髓核细胞凋亡的过程,这一结果与文献报道一致。
综上所述,短时间的低氧环境可以促进髓核细胞凋亡,其机制可能与HIF-1α和ASIC3 mRNA表达增加及AQP3 mRNA表达降低有关。
