基于锌(II)-二甲基吡啶胺的靶向探针成像研究
2021-01-06余雅珺周治国
余雅珺 周治国

摘 要: 锌(II)-二甲基吡啶胺(ZnDPA)作为小分子靶向基团,靶向凋亡或死亡细胞中的阴离子磷脂质膜——磷脂酰丝氨酸(PS).文章总结了ZnDPA与其他分子成像探针结合的体内成像,如荧光成像、磁共振成像(MRI)、光声成像(PAI)、正电子发射型计算机断层显像(PET),并且结合药物分子成为诊疗一体化探针,在炎症、细菌感染、癌症等方面都有着广泛的应用.最后讨论并展望了ZnDPA小分子探针未来的发展趋势.
关键词: 锌(II)-二甲基吡啶胺(ZnDPA); 靶向; 成像
中图分类号: O 611.3 文献标志码: A 文章编号: 1000-5137(2021)06-0728-09
Abstract: As a small molecule targeting group, Zinc(II)-dipicolylamine(ZnDPA) can target phosphatidylserine(PS), an anionic phospholipid membrane in apoptotic or dead cells. In this review, we summarize the in vivo imaging performed by ZnDPA with other molecular imaging probes, such as fluorescence imaging, magnetic resonance imaging(MRI), photoacoustic imaging(PAI), and positron emission computed tomography(PET). ZnDPA can also be combined with drug molecules to become an integrated probe for diagnosis and treatment, which has a wide range of applications in inflammation, bacterial infection, cancer, and other aspects. Finally, we discuss and predict the future development trend of ZnDPA small molecule probe.
Key words: zinc(II)-dipicolylamine(ZnDPA); target; imaging
0 引 言
细胞膜又称质膜,它包裹着细胞,将细胞内物质和外部环境隔离开.质膜主要由蛋白质和磷脂双分子层构成,对内维持着细胞微环境的相对稳定,对外进行物质交换和能量转移.磷脂双分子层的亲水端是磷酸基团,富含两性离子磷脂酰胆碱(phosphatidyl choline,PC)和鞘磷脂;疏水端是两条长短不一的烃链,含有磷脂中最丰富的阴离子磷脂质膜——磷脂酰丝氨酸(PS)[1].磷脂双分子层通过三磷酸腺苷(ATP)转位酶维持着电化学梯度,为细胞提供稳定的环境[2].健康动物细胞膜的膜外表面上静电荷接近中性,当细胞程序性死亡或凋亡时,转位酶活性减弱,导致PS外翻暴露在细胞外环境中,使细胞表面呈电负性.
二甲基吡啶胺(DPA)可以结合磷酸根阴离子,具有灵活的配位数和强路易斯酸性,能降低阴离子的水合能[2].锌离子(Zn2+)可以提高材料的水溶性,由于血液中Zn2+浓度较高,因此Zn2+不会限制材料在体内的富集[3].DPA桥连Zn2+产生一个开放的位点连接阴离子受体[4],与磷酸基团中的氧阴离子配位[5],所以锌(II)-二甲基吡啶胺(ZnDPA)配合物可以特异性靶向阴离子膜,如图1所示.
本文作者系统地总结了ZnDPA与成像分子结合形成具有选择性、广谱性的探针,可用来识别生物体内的死亡细胞和垂死细胞.虽然ZnDPA本身并没有治疗和杀菌作用,但是可以结合药物分子,通过靶向PS递送药物.因此,基于ZnDPA的多功能成像探针有着广阔的应用前景.已知多种疾病与暴露的PS息息相关,阴离子膜被认为是疾病的生物标记.
1 ZnDPA靶向探针成像
1.1 荧光成像
分子成像技术可以针对早期生化变化,并用于疾病的诊断和预防[7].在细胞凋亡的早期阶段,PS翻转到外层,导致膜电位改变,膜联蛋白与乳酸脱氢酶等蛋白质结合[8].目前普遍用蛋白质成像探针——膜联蛋白V,靶向PS检测凋亡細胞[9].然而蛋白质成像探针药代动力学特征较差,限制了其向临床的转化[10-12].荧光光学成像因其固有的高安全性和高灵敏度、相对较深的组织穿透深度,可作为无创成像成为临床研究的一个重要方面,因此急需开发靶向凋亡细胞的小分子成像探针.
1.1.1 炎症荧光成像
炎症是指具有血管系统的活体组织对损伤因子的自动防御反应,有时也会攻击自身组织.一方面炎症中的损伤因子直接或间接地造成组织和细胞的损坏,另一方面通过炎症充血和渗出反应可以稀释、杀伤和包围损伤因子.因此,炎症是损伤和抗损伤的一体化过程.
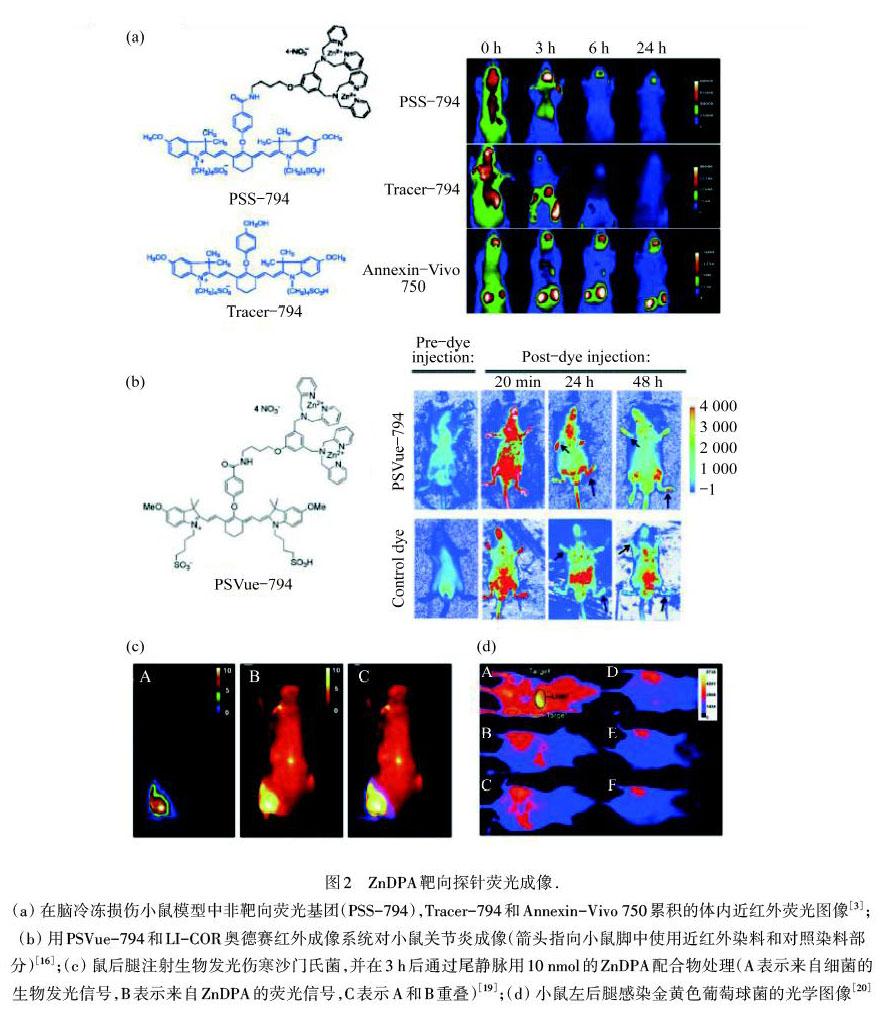
PS出现在凋亡和坏死的中性粒细胞外叶上,通常被隔离在质膜内叶中,可作为定位炎症的靶点[5,13].创伤性脑损伤是一种由炎症引发的疾病,在临床上通常使用正电子发射型计算机断层显像(PET)和磁共振成像(MRI)[14].这两种方式都依赖于疾病后期发生的变化.因此,需要一种针对早期生化变化的分子成像技术对创伤性脑损伤进行诊断.SMITH等 [3]使用含有非靶向荧光基团(Tracer-794)连接ZnDPA分子形成的荧光探针——PSS-794和穿透血脑屏障示踪剂的二元混合物,对动物脑死亡细胞进行成像.PSS-794探针有显著的靶向效应,比蛋白质探针——膜联蛋白750(Annexin-Vivo 750)在冷冻损伤处的信号对比度更强,在体内更易清除,有很大的发展前景,如图2(a)所示.
在复杂的生物系统中,单一波长下的测量易受背景荧光的干扰,导致结果不准确.比率成像是通过测量两种不同波长下的吸收或发射比率来区分结合和未结合的荧光探针,能实现更精确的分析.KIM等[15]合成了一系列由ZnDPA和近红外染料吲哚菁绿(ICG)组成的近红外比率探针,靶向阿尔茨海默病早期形成的磷酸化tau寡聚体.材料在缓冲溶液中显示出对磷酸化与非磷酸化tau蛋白显著的不同吸收,当其与磷酸化tau蛋白结合时,磷酸根阴离子导致Zn2+配位重排,比率光谱发生变化,因此可以用来诊断早期阿尔茨海默病.
大多数荧光染料的激发和检测波长都位于可见光谱区,在此范围内化学高分子物质(膜、胶、微孔塑料板等)也会发出荧光,易产生高背景荧光干扰.然而在红外波长区,这些大分子物质几乎不发出任何荧光信号,使得红外荧光染料在长波检测时背景荧光低,具有很好的信噪比,因此可以在核酸和蛋白膜上进行荧光检测.CHAN等[16]使用近红外荧光染料与ZnDPA连接的复合物材料(PSVue-794)和LI-COR奥德赛成像系统,对小鼠关节炎进行体内成像,比较了不同严重程度的关节炎小鼠注射材料后伤处的荧光发射水平,通过组织学切片验证发现两者高度重合,可以进一步对类风湿性关节炎进行非侵入性分子成像,如图2(b)所示.
1.1.2 细菌荧光成像
大多数细菌表面覆盖着阴离子膜,同时具有疏水性质,因此可以通过电荷作用和疏水作用把材料富集在细菌的膜外表面.TURKYILMAZ等[17]合成了聚乙二醇(PEG)连有两个DPA包覆的脂质体,这种两性物质不与健康细胞表面不带电荷的脂质体相互作用,只与含有阴离子磷脂的目标脂质体交联沉淀,因此可以在健康细胞存在下选择性凝集细菌.ZnDPA对革兰氏阴性细菌和革兰氏阳性菌均显示出良好的靶向性质.FENG等[18]合成了具有聚集诱导发射特性的Zn(II)-四齿配位的红色发射探针,探针分散在水溶液中不发射荧光,然而遇到含有阴离子磷脂的细菌会聚集在表面发射荧光.并且由于成像产生的背景信号低,因此不需要清洗材料,简化了成像过程.材料在与大肠杆菌(革兰氏阴性细菌)和枯草芽孢杆菌(革兰氏阳性菌)结合后均显示出强光毒性,因此可以选择性地杀死哺乳动物细胞上的细菌,有望成为新型的成像杀菌一体化探针.WHITE等[19]将ZnDPA共价连接到Cy5荧光染料上形成荧光探针,探针选择性地与阴离子囊泡膜结合,靶向活鼠体内感染伤寒沙门氏菌(革兰氏阴性细菌)的部位,如图2(c)所示.LEEVY等[20]用近红外荧光团结合双ZnDPA探针,对活体小鼠腿部感染金黄色葡萄球菌(革兰氏阳性细菌)处进行无创光学成像,如图2(d)所示.因此,ZnDPA复合材料可开发为成像杀菌一体化探针.
ZnDPA复合材料除了在细菌中有良好的靶向作用,也可以靶向表面含有负电荷磷脂的寄生虫.RICE等[21]研究了ZnDPA配位复合物对利什曼原虫的选择性靶向.荧光标记的ZnDPA探针在利什曼原虫的前鞭毛体中有明显的聚集,对其有显著的化学毒性,而对哺乳动物细胞几乎没有影响.寄生虫繁殖会破坏红细胞中的膜脂,导致PS暴露在膜外侧,因此刺激了血管内皮细胞上CD36与血小板反应素受体的粘附[22],也给膜表面带来负电荷.因此,ZnDPA复合物可以负载药物送至感染恶性疟原虫的红细胞上,对病变部分进行成像治疗.
1.1.3 肿瘤荧光成像
肿瘤细胞表面糖蛋白等物质减少,流动性强,因此癌细胞容易扩散和转移.某些癌细胞的PS会外翻出现在膜表面,同时癌细胞的迅速增殖会引起周围健康组织的坏死,造成周围细胞表面出现阴离子膜,因此阴离子膜可成为肿瘤的特异性靶点.基于DPA设计的共轭物靶向HeLa和MCF-7细胞前后,细胞核的形态保持不变,说明复合物不与细胞核相互作用,因此可以对无核细胞器进行特异性荧光成像[23].CHEN等[24]将细胞毒性药物SN38与ZnDPA偶联,在荧光成像的同时以低剂量的SN38诱导癌细胞凋亡.SMITH等[25]合成了由ZnDPA与近红外荧光团组成的荧光探针,表现出对异种移植动物模型中的前列腺和乳腺肿瘤坏死区域的选择性靶向.ZnDPA作为一个优良的靶向基团,针对肿瘤部分的阴离子膜结合药物进行精准给药治疗,在未来攻克癌症相关问题中有着巨大的发展前景.
1.2 磁共振成像(MRI)
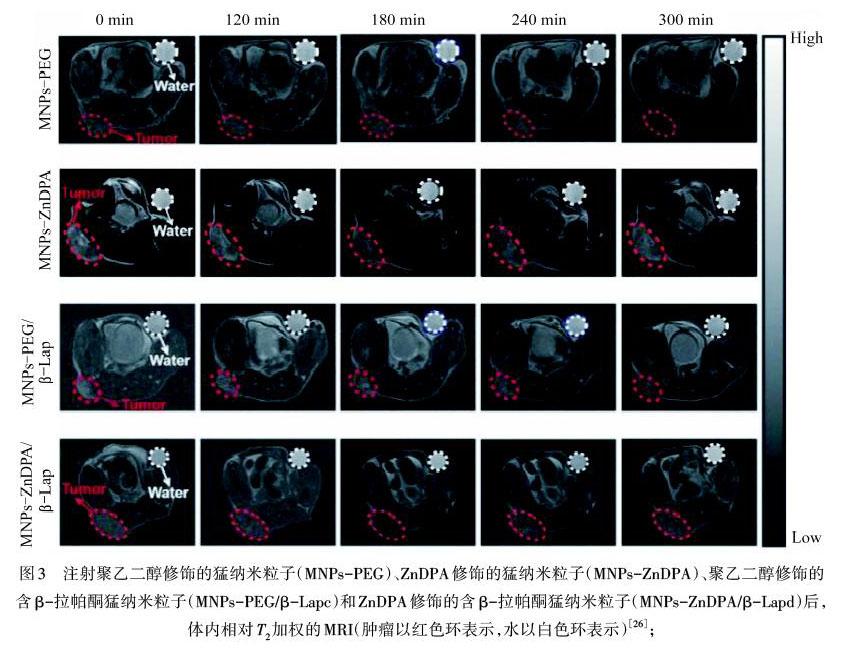
MRI作为临床诊断最常用的成像方式之一,是在磁场作用下原子核吸收运动频率相同的脉冲发生共振吸收,去除脉冲后原子核把吸收能量的一部分以电磁波的形式发射出来,通过分析释放的电磁波绘制物体内部的立体图像.MRI可以较为安全、快速、準确地进行体内成像,然而某些肿瘤自身发射的磁共振信号会与器官的信号重合,增加MRI诊断的难度,因此需要MRI造影剂提高弛豫率,增强图像的信号.LIU等[26]利用ZnDPA对PS的靶向特性结合β-拉帕酮(β-Lap)促进细胞凋亡,共同合成了猛纳米粒子,材料与凋亡的4T1细胞共孵育后横向弛豫率变化(ΔT2 /T2)显著提高,表现出增强的靶向性,可以将其定义为该纳米粒子具有出色的自扩增靶向凋亡性质,如图3所示.ZHAO等[27]基于ZnDPA设计的铁与四氧化三铁混合的纳米颗粒(MNPs/ZnDPA)可放大磁共振信号,进行光热治疗.在凋亡异种肿瘤移植模型中,由于ZnDPA的高亲和力和凋亡癌细胞外表面上PS水平的上调,MNPs/ZnDPA的积累量提高了2倍,肿瘤/肌肉的T2值比正常异种移植模型降低了50%,表明纳米颗粒可以提高肿瘤的靶向效率.然而在已有的关于ZnDPA配合物与磷酸盐阴离子之间相互作用的研究中,并没有具体研究磷酸盐的种类,这种相互作用是否具有特异性仍需要进一步探究.
1.3 光声成像(PAI)
PAI是脉冲激光照射到生物组织中,组织吸收光产生超声信号,通过探测光声信号重建出组织中的光吸收分布图像.PAI结合了纯光学成像中高选择性和纯超声成像中深穿透特性的优点,可得到高分辨率和高对比度的组织图像,从原理上避开了光散射的影响,可实现深层活体内组织成像.
将靶向基团与金属配合物一起合成的纳米粒子作为PAI的造影剂,纳米粒子可提高材料在生物体内的稳定性,并且在吸收光信号后释放出超声信号,结合ZnDPA进行成像.多形性胶质母细胞瘤是一种常见的恶性颅内肿瘤,用阳离子蛋白或细胞穿透肽修饰的治疗剂可以通过胞吞作用穿过血脑屏障(BBB)[28].多功能纳米粒子可以将治疗剂和成像剂一起输送到靶位点,并在肿瘤细胞中释放有效载荷[29].GAO等[30]合成了基于精氨酸-甘氨酸-天冬氨酸(RGD)修饰的亚硫酸氢盐-锌Ⅱ-二甲基吡啶胺-精氨酸-甘氨酸-天冬氨酸(Bis(DPA-Zn)-RGD)和ICG修饰的超小金纳米粒子(Au-ICG)形成原位自组装纳米给药系统.材料表面显示出正电荷,因此可以靶向新生血管,選择性地递送到肿瘤部位,然后自组装成纳米簇.由于其超小的粒径,金纳米粒子可以穿过BBB和血脑肿瘤屏障(BBTB),在肿瘤中具有更高的渗透性,显示出近红外强吸收和肿瘤滞留增强效应,形成精确的原位荧光/光声成像.
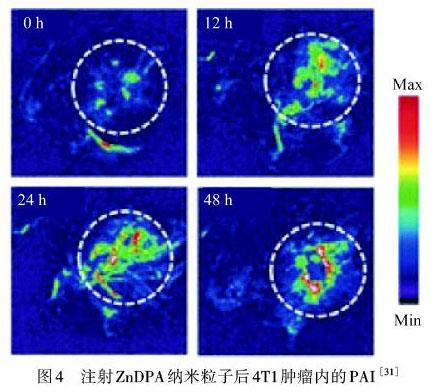
ZnDPA除了结合造影剂,还可以在合成过程中加入核糖核酸(RNA),既提高了生物相容性,又可以协同基因进行治疗.MIN等[6]合成了DPA包覆金纳米棒用于PAI和协同基因光热治疗,通过DPA配位的Zn2+与磷酸盐阴离子之间的相互作用,小干扰RNA(siRNA)与ZnDPA的配位被破坏,siRNA从内体/溶酶体运输到胞质溶胶中,诱导了肿瘤组织的凋亡.CHU等[31]合成了负载ICG和治疗基因survivin-siRNA的ZnDPA纳米粒子,在沉默基因的同时下调热休克蛋白70(HSP70)的表达,实现荧光/光声成像,如图4所示.由上述研究可以看出,根据结合成像基团和结合金属的不同进行多模态成像,能对病灶部分进行更精准的成像,甚至协同治疗,对研究有着重要的意义.
1.4 正电子发射型计算机断层显像(PET)
PET是通过在探针上标记放射性核素(如18F,11C等),对探针进入生物体后在代谢中的富集,来反映生命代谢的活动情况,从而达到诊断的目的.
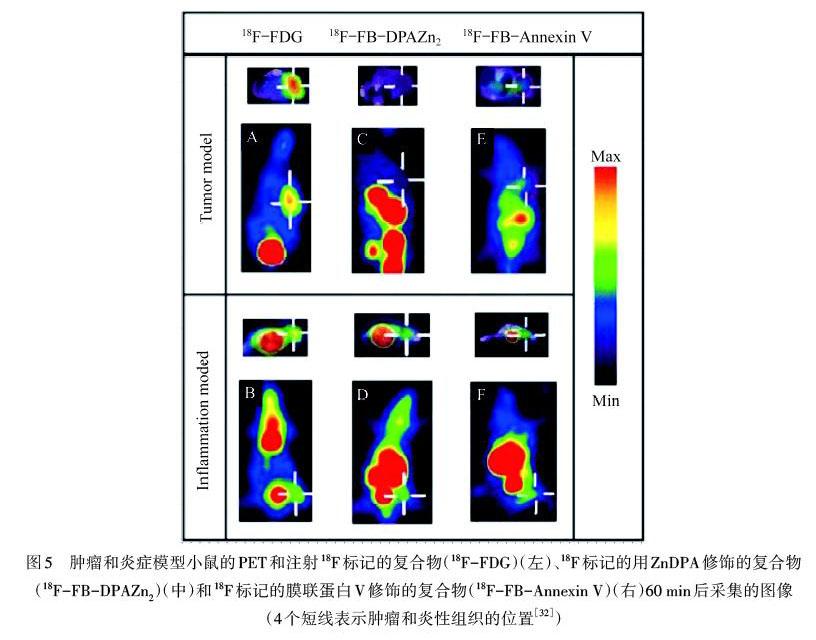
ZnDPA复合物对凋亡细胞中的阴离子PS膜具有选择性亲和性,可用于定位由细菌或非细菌途径诱导的感染组织,结合放射性元素进行靶向成像.WANG等[32]合成了18F标记的ZnDPA复合物小分子探针(18F-ZnDPA),用于无菌炎症的成像,在纤维肉瘤小鼠模型和无菌炎症小鼠模型中,肿瘤和炎症的摄取比例显著增高,生物分布和PET研究表明18F-Zn DPA能够区分肿瘤与炎症,如图5所示.HUANG等[33]用11C标记ZnDPA([11C]DPA-Zn2+)靶向细菌炎症组织以及松节油诱导的炎症,细菌炎症组织中富集的[11C]DPA-Zn2+高于松节油诱导的炎症组织,表明微生物感染导致更多凋亡中性粒细胞的募集.此外还有研究开发99m Tc标记的ZnDPA配合物,作为放射性示踪剂检测体内细胞的死亡[34].由于PET灵敏度高,特异性高,因此可以较为灵敏地区分出肿瘤和炎症.
2 结论与展望
ZnDPA作为小分子探针可以较好地进入体内,满足临床诊断需要.在近几年的研究中,ZnDPA结合成像基团靶向炎症、细菌和肿瘤进行多模态成像,弥补了单一成像中本身固有的缺点.同时ZnDPA可以结合多种分子基团以及生物体中的RNA片段,形成诊疗一体化探针,监测肿瘤死亡和活性代谢,来迅速评估实体肿瘤和周围组织中的治疗反应.
然而ZnDPA的靶向也不可避免地存在着一些问题,由于生物体内磷酸盐种类繁多,大多数材料在成像过程中没有研究ZnDPA与不同磷酸盐结合的区别,以及对成像的影响.随着技术的发展以及学科技术的交叉融合,ZnDPA的相关研究工作正在逐步深入,其应用也有进一步发展,且不断在传感器、精准医学分析、制药等领域焕发出新的生命力.
参考文献:
[1] RICE D R, CLEAR K J, SMITH B D. Imaging and therapeutic applications of zinc(II)-dipicolylamine molecular probes for anionic biomembranes [J]. Chemical Communications, 2016,52(57):8787-8801.
[2] SAKAMOTO T, OJIDA A, HAMACHI I. Molecular recognition, fluorescence sensing, and biological assay of phosphate anion derivatives using artificial Zn(II)-DPA complexes [J]. Chemical Communications,2009,2:141-152.
[3] SMITH B A, XIE B W, VAN BEEK E R, et al. Multicolor fluorescence imaging of traumatic brain injury in a cryolesion mouse model [J]. ACS Chemical Neuroscience,2012,3(7):530-537.
[4] LEE D H, IM J H, SON S U, et al. An azophenol-based chromogenic pyrophosphate sensor in water [J]. Journal of the American Chemical Society,2003,125(26):7752-7753.
[5] KWON T H, KIM H J, HONG J I. Phosphorescent thymidine triphosphate sensor based on a donor-acceptor ensemble system using intermolecular energy transfer [J]. Chemistry:A European Journal,2008,14(31):9613-9619.
[6] MIN K H, KIM Y H, WANG Z, et al. Engineered Zn(II)-dipicolylamine-gold nanorod provides effective prostate cancer treatment by combining siRNA delivery and photothermal therapy [J]. Theranostics,2017,7(17):4240-4254.
[7] CHAPON C, FRANCONI F, LACOEUILLE F, et al. Imaging E-selectin expression following traumatic brain injury in the rat using a targeted USPIO contrast agent [J]. Magnetic Resonance Materials in Physics Biology and Medicine,2009,22(3):167-174.
[8] SMITH C, GIBSON D F, TAIT J F. Transmembrane voltage regulates binding of annexin V and lactadherin to cells with exposed phosphatidylserine [J]. BMC Biochemistry,2009,10(1):5-13.
[9] FUTTER C E, WHITE I J. Annexins and endocytosis [J]. Traffic,2007,8(8):951-958.
[10] NTZIACHRISTOS V, SCHELLENBERGER E A, RIPOLL J, et al. Visualization of antitumor treatment by means of fluorescence molecular tomography with an annexin V-Cy5.5 conjugate [J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(33):12294-12299.
[11] BEEKMAN C A C, BUCKLE T, VAN LEEUWEN A C, et al. Questioning the value of 99m Tc-HYNIC-annexin V based response monitoring after docetaxel treatment in a mouse model for hereditary breast cancer [J]. Applied Radiation and Isotopes,2011,69(4):656-662.
[12] VANDERHEYDEN J L, LIU G Z, HE J, et al. Evaluation of 99m Tc-MAG3-annexin V: influence of the chelate on in vitro and in vivo properties in mice [J]. Nuclear Medicine and Biology,2006,33(1):135-144.
[13] THAKUR M L, ZHANG K J, PAUDYAL B, et al. Targeting apoptosis for optical imaging of infection [J]. Molecular Imaging and Biology,2012,14(2):163-171.
[14] KIM J J, GEAN A D. Imaging for the diagnosis and management of traumatic brain injury [J]. Neurotherapeutics,2011,8(1):39-53.
[15] KIM H Y, SENGUPTA U, SHAO P, et al. Alzheimer’s disease imaging with a novel tau targeted near infrared ratiometric probe [J]. American Journal of Nuclear Medicine and Molecular Imaging,2013,3(2):102-117.
[16] CHAN M M, GRAY B D, PAK K Y, et al. Non-invasive in vivo imaging of arthritis in a collagen-induced murine model with phosphatidylserine-binding near-infrared (NIR) dye [J]. Arthritis Research and Therapy,2015,17(1):50-66.
[17] TURKYILMAZ S, RICE D R, PALUMBO R, et al. Selective recognition of anionic cell membranes using targeted liposomes coated with zinc(II)-bis(dipicolylamine) affinity units [J]. Organic and Biomolecular Chemistry,2014,12 (30):5645-5655.
[18] FENG G, ZHANG C J, LU X, et al. Zinc(II)-tetradentate-coordinated probe with aggregation-induced emission characteristics for selective imaging and photoinactivation of bacteria [J]. ACS Omega,2017,2(2):546-553.
[19] WHITE A G, GRAY B D, PAK K Y, et al. Deep-red fluorescent imaging probe for bacteria [J]. Bioorganic and Medicinal Chemistry Letters,2012,22(8):2833-2836.
[20] LEEVY W M, GAMMON S T, JOHNSON J R, et al. Noninvasive optical imaging of staphylococcus aureus bacterial infection in living mice using a bis-dipicolylamine-zinc(II) affinity group conjugated to a near-infrared fluorophore [J]. Bioconjugate Chemistry,2008,19(3):686-692.
[21] RICE D R, VACCHINA P, NORRIS-MULLINS B, et al. Zinc(II)-dipicolylamine coordination complexes as targeting and chemotherapeutic agents for leishmania major [J]. Antimicrobial Agents and Chemotherapy,2016,60(5):2932-2940.
[22] EDA S, SHERMAN I W. Cytoadherence of malaria-infected red blood cells involves exposure of phosphatidylserine [J]. Cellular Physiology and Biochemistry,2002,12(5):373-384.
[23] WONG Y S, NG M, YEUNG M C L, et al. Platinum(II)-based host-guest coordination-driven supramolecular co-assembly assisted by Pt…Pt and π-π stacking interactions: a dual-selective luminescence sensor for cations and anions [J]. Journal of the American Chemical Society,2021,143(2):973-982.
[24] CHEN Y Y, LO C F, CHIU T Y, et al. BPRDP056, a novel small molecule drug conjugate specifically targeting phosphatidylserine for cancer therapy [J]. Translational Oncology,2021,14(1):100897-100908.
[25] SMITH B A, AKERS W J, LEEVY W M, et al. Optical imaging of mammary and prostate tumors in living animals using a synthetic near infrared zinc(II)-dipicolylamine probe for anionic cell surfaces [J]. Journal of the American Chemical Society,2010,132(1): 67-69.
[26] LIU W, CHEN L, CHEN M, et al. Self-amplified apoptosis targeting nanoplatform for synergistic magnetic-thermal/chemo therapy in vivo [J]. Advanced Healthcare Materials,2020,9(18):2000202-2000211.
[27] ZHAO H, ZHOU P, HUANG K, et al. Amplifying apoptosis homing nanoplatform for tumor theranostics [J]. Advanced Healthcare Materials,2018,7(14):1800296-1800305.
[28] ANDREONE B J, CHOW B W, TATA A, et al. Blood-brain barrier permeability is regulated by lipid transport-dependent suppression of caveolae-mediated transcytosis [J]. Neuron,2017,94(3):581-594.
[29] CHEN C T, DUAN Z Q, YUAN Y, et al. Peptide-22 and cyclic RGD functionalized liposomes for glioma targeting drug delivery overcoming BBB and BBTB [J]. ACS Applied Materials and Interfaces,2017,9(7):5864-5873.
[30] GAO H Y, CHU C C, CHENG Y, et al. In situ formation of nanotheranostics to overcome the blood-brain barrier and enhance treatment of orthotopic lioma [J]. ACS Applied Materials and Interfaces,2020,12(24):26880-26892.
[31] CHU C C, REN E, ZHANG Y M, et al. Zinc(II)-dipicolylamine coordination nanotheranostics: toward synergistic nanomedicine by combined photo/gene therapy [J]. Angewandte Chemie International Edition,2019,58(1):269-272.
[32] WANG H, TANG G, HU K, et al. PET imaging of sterile inflammation with a 18F-labeled bis(zinc(II)-dipicolylamine) complex [J]. Journal of Radioanalytical and Nuclear Chemistry,2014,302(1):273-280.
[33] HUANG T, WANG H, TANG G, et al. A comparative uptake study of multiplexed PET tracers in mice with turpentine-induced inflammation [J]. Molecules,2012,17(12):13948-13959.
[34] WYFFELS L, GRAY B D, BARBER C, et al. Synthesis and preliminary evaluation of radiolabeled bis(zinc(II)-dipicolylamine) coordination complexes as cell death imaging agents [J]. Bioorganic and Medicinal Chemistry,2011,19 (11):3425-3433.
(責任编辑:郁慧,冯珍珍)
