氧化铈纳米材料的合成及其在癌症治疗方面的研究进展
2021-01-06杨馨雨林焦敏杨仕平
杨馨雨 林焦敏 杨仕平


摘 要: 近年来,氧化铈纳米颗粒(CeO2 NPs)材料的合成及其在生物医学,尤其是在癌症治疗方面的应用研究引起了研究者们的广泛关注.一方面,CeO2 NPs对癌细胞具有明显的细胞毒性,能用于光动力治疗(PDT)和化学药物治疗(CHT)等方面,并且能够使癌细胞对放射治疗(RT)敏感;另一方面,CeO2 NPs能保护正常细胞,具有抗氧化活性.这种具有差异细胞毒性的材料为开发新型癌症治疗试剂提供了新的思路.文章系统地介绍了近年来CeO2 NPs的合成及其在癌症治疗方面的研究进展,希望对该材料将来的研究工作起到一定推动作用.
关键词: 氧化铈纳米颗粒(CeO2 NPs); 光动力治疗(PDT); 放射治疗(RT); 联合治疗
中图分类号: O 611.62 文献标志码: A 文章编号: 1000-5137(2021)06-0754-10
Abstract: In recent years, the synthesis of cerium oxide nanoparticles(CeO2 NPs) and their application in biomedicine, especially in cancer treatment, have attracted wide attention from scientists. On the one hand, with obvious cytotoxicity to cancer cells, CeO2 NPs can be used in photodynamic therapy(PDT), chemotherapy(CHT), etc, and can make cancer cells sensitive to radiotherapy(RT). On the other hand, CeO2 NPs can protect normal cells and have antioxidant activity. The material with differential cytotoxicity provides a new idea for the development of cancer treatment reagents. The synthesis of CeO2 NPs in recent years and the research progress in cancer treatment are summarized.
Key words: cerium oxide nanoparticles(CeO2 NPs); photodynamic therapy(PDT); radiotherapy(RT); synergistic therapy
0 引 言
稀土元素具有镧系收缩现象,即镧系元素的原子半径和离子半径,在总的趋势上随着原子序数的增大而减小.稀土元素的许多通性是电子层结构的反映,其独特的电子构型使其出现独特的光电磁现象.例如,丰富的可跃迁的电子能级和长寿命的激发态能级能使其产生可见‒红外发射光谱.由于稀土元素具备特殊的4f电子排布,其纳米氧化物在癌症治疗方面引起了极大的关注,氧化铈纳米颗粒(CeO2 NPs)便是其中之一.CeO2 NPs在工业上被用作催化剂、紫外线吸收剂和抛光材料,同时也是气体传感器、光学设备、燃料电池的重要成分[1].由于价格低廉且具有高附加值的特性,吸引了科学家将它应用于癌症治疗方面,其在光动力治疗(PDT)[2]、光热治疗(PTT)[3]、化学药物治疗(CHT)[4]和放射治疗(RT)[5]等癌症治疗方面显示出广阔的应用前景.
1 二氧化铈(CeO2)的结构与特点
铈(Ce)是稀土元素中含量最为丰富的元素,CeO2是Ce最稳定的存在形式,具有萤石结构[4].有趣的是,Ce3+/Ce4+氧化还原对共存于CeO2表面,随着Ce3+被氧化成Ce4+,在CeO2表面产生了氧空位,这些氧缺陷可以成为催化活性的位点,并随着颗粒尺寸的减小而增加.混合价态的存在以及氧缺陷的特性使其在癌症治疗的氧化和抗氧化等方面产生重要的作用[6].
研究表明,活性氧(ROS)既可以驱动癌症发展的进程,又可以下调与自由基产生反应的抗氧化酶的水平.因此,在健康细胞中ROS的細胞水平受到严格控制.CeO2 NPs由于具有Ce3+/Ce4+共存以及氧缺陷的特性,能调节细胞的氧化还原状态,被用于治疗ROS水平失调的疾病 [5,7].有文献指出,CeO2 NPs既对癌细胞具有先天的细胞毒性,又具有抗侵袭性[8],能保护正常组织.聚合物涂布的CeO2 NPs可通过肿瘤‒基质相互作用来杀死癌症细胞,并抑制肿瘤转移进程.无化学修饰的CeO2 NPs可通过启动线粒体介导的凋亡信号通路来诱导肿瘤细胞的凋亡[3].
CeO2 NPs通过转换Ce3+/Ce4+两种价态,可以像金属酶一样作用.一方面,CeO2将Ce3+转换为Ce4+,并将超氧化物还原为过氧化氢(H2O2),它可以像超氧化物歧化酶(SOD)一样发挥作用,减少羟基自由基(·OH)和超氧自由基(·O2-)等自由基的含量[9].多项研究表明,CeO2 NPs的抗氧化活性可用于减轻ROS介导的疾病,例如糖尿病、慢性炎症、神经退行性疾病、视网膜炎和癌症等[10].另一方面,CeO2 NPs可作为过氧化物酶,Ce4+在中性环境下可以促进H2O2分解,生成水(H2O)和氧气(O2).其中,pH值是决定CeO2 NPs在肿瘤中充当氧化剂还是抗氧化剂的条件之一,在酸性环境下它促进H2O2分解生成·OH等自由基[11].由于在肿瘤微环境中H2O2是过表达和呈现酸性的,这使CeO2 NPs可以作为一种有效的化学动力学试剂来对抗肿瘤,而不会对正常组织造成额外的毒性,因而在癌细胞中起氧化剂作用,在正常细胞中起抗氧化剂的作用,具有差异细胞毒性[12].此外,铈离子的价态循环,可以在体内长时间发挥生物活性,因而可以通过极少的剂量实现最优的效果.
2 CeO2的制备方法
目前,制备CeO2 NPs的方法可以分为固相法、液相法和气相法.其中液相法是制备该材料的主要方法.液相法是通过控制液相体系中的化学反应条件(反应物浓度、反应温度、反应pH值、反应时间和搅拌速度等)来形成前驱体的方法,主要包括化学沉淀法、喷雾热分解法、电化学法、微波法、溶剂热法、溶胶‒凝胶法、水热法、喷雾反应法、超声波化学法、微乳液法等,其中沉淀法是目前制备CeO2的主要方法.此外,其他液相法如模板法、溶胶‒凝胶法、水热法等也被广泛利用[13].相比于固相法和气相法,液相法具有成本低、工艺及设备简单、成核快、易控制、产量高、产品纯度高等一系列优点,因此在工业化生产和实验室科研中是制备CeO2 NPs的首选方法.
沉淀法[14]是一种用沉淀操作从溶液中制备纳米量级水不溶化合物的液相制备方法.沉淀法具有操作简单、对设备技术要求较低、产品纯度高和成本较低的优点.例如NOURMOHAMMADI[1]通过共沉淀法合成了CeO2 NPs,将固体硝酸铈(Ce(NO3)3)溶解于去离子水中,并添加硝酸(HNO3)和氨水(NH3·H2O),将pH值维持在10左右进行沉淀,洗涤、干燥、煅烧后制备出平均直径为31.84 nm的CeO2 NPs.粉末X射线衍射(PXRD)图谱中的布拉格峰显示的米勒指数为(111),(200),(220),(311),(222),(400),(331),(420)和(422),可以以萤石立方结构进行索引.
另外模板法也常用于制备CeO2 NPs.例如XU等[15]采用模板法制备了中空的CeO2 NPs,其以145 nm左右的二氧化硅(SiO2)球为模板,将Ce(NO3)3·6H2O加入到SiO2纳米球和聚乙烯吡咯烷酮的混合水溶液中,收集沉淀并在氩气(Ar)中煅烧后,得到CeO2沉积在SiO2表面的纳米球.用2 mol·L-1的氢氧化钠(NaOH)溶液蚀刻SiO2模板,并用去离子水洗涤数次,在60 ℃下干燥后得到了直径为(170±12) nm的空心CeO2 NPs.如图1所示,通过比表面积测试可知,空心CeO2 NPs的比表面积和平均孔径分别为199.13 m2·g-1和3.82 nm,表明了其具有潜在高效的药物传递和释放特性.
3 CeO2 NPs在癌症治疗方面的应用
CeO2 NPs对正常细胞表现出的抗氧化活性以及对癌细胞具有氧化作用的特性,已被广泛应用于肿瘤的CHT,PDT,PTT和RT等研究中.然而单一的治疗方法不足以杀死癌症细胞,联合治疗逐渐成为新兴的趋势,下文将对常用的治疗方式进行简要介绍,并对CeO2 NPs在其中的应用进行举例.
3.1 CHT
CHT是利用化学药物阻止癌细胞的增殖、浸润、转移,直至最终杀灭癌细胞的一种治疗方式.由于它是一种全身性的治疗手段,CHT药物的选择性不强,在杀死癌细胞的同时会不可避免地损伤人体正常的细胞,从而出现药物的不良反应[16].在进行CHT时,一方面要达到最佳的抗肿瘤作用,另一方面要注意预防和识别CHT药物的不良反应.因此,对癌细胞具有杀伤作用而不会对正常组织造成额外毒性的CeO2 NPs吸引了众多科学家的关注.
SACK等[17]合成了CeO2 NPs,并研究了其是否能作为经典的化学疗法的补充剂的问题.将CeO2 NPs与常规CHT代表药物阿霉素(DOX)对A375恶性黑色素瘤和HDF人类皮肤成纤维细胞进行对比治疗[18-19].与对照组相比,单独用0.5 µmol·L-1 DOX对恶性黑色素瘤孵育24 h后,肿瘤细胞活力下降了40%至50%,而用CeO2 NPs与DOX共孵育后,细胞活力降低至20%,表明CeO2 NPs增强了DOX对人黑色素瘤细胞中的细胞毒性.并且,用CeO2 NPs和DOX对人类皮肤成纤维细胞进行孵育,与单独用DOX处理的细胞相比,共孵育后细胞活力增加了100%,表明CeO2 NP对正常组织具有保护作用.此外,通过检测DNA链损伤来判别遗传毒性,与CeO2 NPs单独处理组相比,共孵育组A375细胞的彗星实验(即单细胞凝胶电泳实验)面积增加了2.5倍,产生了极大的DNA损伤,侧面说明CeO2是无基因毒性的.因此,CeO2 NPs对肿瘤细胞有明显的细胞毒性,与ROS产生和氧化损伤具有协同作用.与DOX相反,其不会引起DNA损伤,会保护人类皮肤成纤维细胞免受DOX诱导产生细胞毒性作用.将经典化学疗法与没有遗传毒性但具有抗肿瘤活性的CeO2 NPs的组合,可以提高肿瘤治疗效果,从而为癌症提供新的治疗策略.
3.2 PDT
PDT在治疗恶性肿瘤方面是最有前景的治疗方法之一,该方法利用光敏剂、激发光和O2分子来产生具有细胞毒性的单线态氧(1O2),以损伤生物分子并最终导致癌细胞死亡.其中,O2是PDT过程中不可缺少的要素之一.然而,由于不规则的肿瘤细胞增殖和异常的肿瘤血管发育使肿瘤微环境乏氧.乏氧严重削弱了PDT的功效[20-21].此外,PDT过程中光敏剂介导的O2消耗将进一步加剧肿瘤乏氧.因此,增加O2的含量,克服氧依赖是提高PDT疗效的重要方式之一.在PDT中,一方面,CeO2 NPs具有很强的紫外吸收能力,可直接作为光敏剂,但紫外线损伤和紫外线在组织中穿透距离短的问题限制了它的应用;另一方面,CeO2 NPs具有优异的氧化还原性能,即使在没有光照的情况下,也可以可逆地从Ce4+转化为Ce3+.同时,将H2O2转化为H2O和O2,进而可以实现O2的补充.
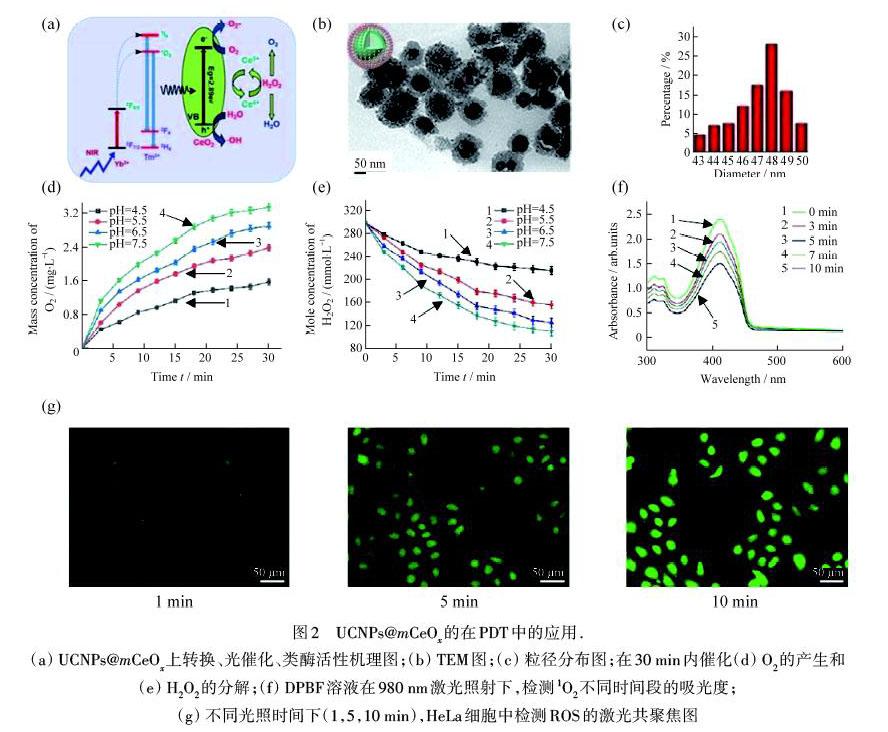
JIA等[22]通過在上转换纳米粒子(UCNPs)上涂覆空心CeO2(UCNPs@mCeOx),设计了具有中孔核壳结构的纳米粒子,该结构能够实现原位O2生成和近红外光(NIR)触发的PDT,从而实现有效的PDT.如图2(a)所示,CeO2一方面在生理pH值或弱酸性肿瘤微环境下有效而稳定地将内源性H2O2分解为O2,产生了足够的O2,增强了PDT的作用.另一方面,将镱离子(Yb3+)和铥离子(Tm3+)掺杂于NaGdF4内层,可以吸收具有相对较高的组织穿透深度的NIR,并将NIR连续转换为紫外光发射,然后触发基于CeO2的光催化反应,产生电子‒空穴对,有效地将H2O和O2分解为·OH和·O2-,在肿瘤细胞中诱导细胞凋亡,从而提高PDT的效果.如图2(b)所示,UCNPs@mCeOx中空结构明显,其内部为球形的UCNPs,外层为CeO2微小颗粒.如图2(c)所示,其平均尺寸小于50 nm,这样的尺寸可以通过高通透性和滞留效应(EPR)促进纳米药物在肿瘤部位更好地聚集.为了评估UCNPs@mCeOx的催化能力,在980 nm激光照射下测量了不同时间段通过消耗H2O2产生的O2的能力,如图2(d)和图2(e)所示.在生理pH值条件下(pH=7.5),O2产量达到2.97 mg·L-1,而H2O2含量逐渐减少.此外,进一步研究了在980 nm激光照射下不同时间段的UCNPs@mCeOx的1,3‒二苯基异苯并呋喃(DPBF)溶液的吸光度的变化.显然,DPBF的吸收峰在350~470 nm处下降,表明ROS产量随着辐照时间逐渐增加,如图2(f)所示.2,7‒二氯荧光素‒二乙酸酯(DCFH‒DA)是一种ROS检测剂,DCFH‒DA可以被细胞吸收,本身没有荧光,之后被胞内酯酶水解成2,7‒二氯二氢荧光素(DCFH)后,也无荧光的DCFH可被ROS氧化形成2,7‒二氯荧光素(DCF),DCF在488 nm的光照射下发出绿色荧光.图2(g)显示了带有DCF荧光的HeLa细胞的共聚焦照片,更强的绿色荧光说明了在980 nm光照射下材料会导致ROS产生.
3.3 RT
RT是最常见的癌症治疗手段之一,RT中使用的电离辐射会产生ROS,例如超氧化物和羟基自由基,在细胞中可能导致细胞DNA损伤.减少RT有害副作用的研究中产生了两类化合物:辐射防护剂和辐射敏化剂.辐射防护剂有选择地保护了正常组织免受电离辐射的有害影响,而辐射敏化剂有选择地增加了电离辐射在癌细胞中引起的伤害[23].目前可用的辐射防护剂(如氨磷汀)具有副作用,比如导致恶心、呕吐和低血压,以及费用高昂等缺点[24].而辐射敏化剂(如SAHA)會导致疲劳、脱水、恶心和呕吐等副作用[25].CeO2 NPs的价态和氧缺陷的特性使其能够充当可再生氧化还原状态调节剂,有希望成为一种提高RT疗效和治疗指数的新型化合物,进一步改善癌症的RT.
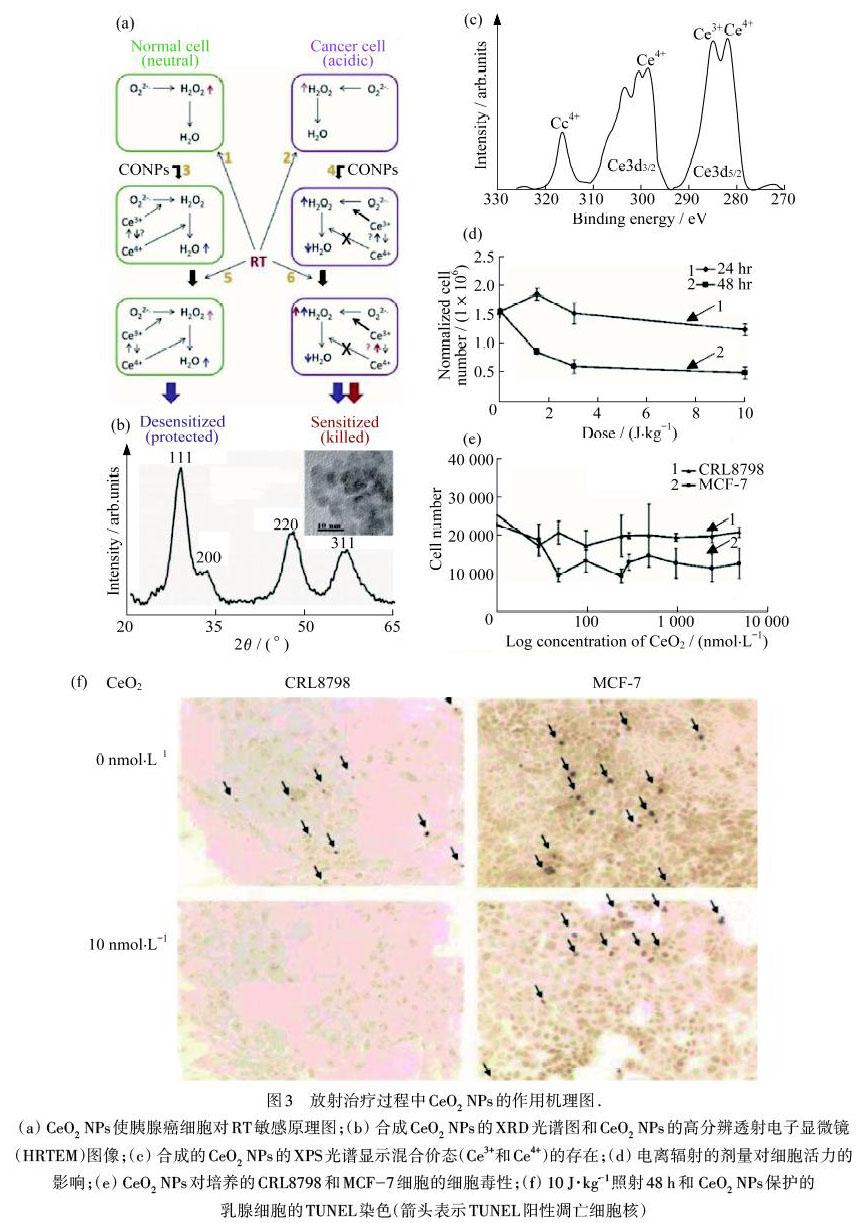
TARNUZZER等[26]研究了CeO2 NPs是否可以作为RT过程中永生化的正常乳腺上皮细胞系CRL8798的保护剂以及对乳腺癌细胞系MCF‒7是否有毒性作用,如图3(a)所示.其通过微乳液法制备了尺寸在2~5 nm范围内的超细非团聚CeO2 NPs,X射线衍射(XRD)光谱图中的宽峰证实了纳米晶体的存在,如图3(b)所示.另外,X射线光电子能谱(XPS)表明:合成的CeO2 NPs存在混合价态(Ce3+和Ce4+),其中Ce3+的含量高达44%,如图3(c)所示.首先,通过细胞毒性测试,研究了电离辐射的剂量对细胞活力的影响,10 J·kg-1照射对MCF‒7人类乳腺肿瘤细胞具有较大杀伤作用,如图3(d)所示.然后,用CeO2 NPs对永生化的正常乳腺上皮细胞系CRL8798和乳腺癌细胞系MCF‒7进行了细胞毒性测试,少量CeO2 NPs对CRL8798没有显著的毒性,在物质的量浓度大于50 μmol·L-1时,对MCF‒7细胞只有轻微的影响,表明CeO2有良好的生物相容性,如图3(e)所示.如果直接用10 J·kg-1的剂量照射孔板,40%~50%的CRL8798和MCF‒7将被杀死,但如果在辐射前24 h用CeO2 NPs预处理后,CRL8798细胞几乎可以得到完全的保护.而对于MCF‒7细胞,材料对辐射诱导的细胞死亡没有显示出统计学上显著的保护作用,细胞凋亡实验TUNEL染色也进一步证明了这一结果,如图3(f)所示.以上结果进一步证明,CeO2 NPs可以作为RT过程中正常细胞的保护剂,而其对癌细胞则没有保护作用.
3.4 联合治疗
3.4.1 PTT和PDT联合治疗
PTT是基于NIR热转换试剂在激光的照射下将光能转换成热能,诱导肿瘤细胞的细胞膜破裂或蛋白质变性来杀死肿瘤细胞的方法.因其侵袭性小、穿透深度深、效率高等优点越来越受到人们的关注.然而,PTT治疗存在温度控制困难和光热剂非特异性等缺陷,高温消融可导致肿瘤附近的正常组织损伤,而低温通过热休克反应削弱了治疗效率,从而限制了其发展.因此,将其与其他治疗方式联合使用,有助于提高治疗效果.
ZHANG等[27]建立了一种基于近红外诱导·OH生成的细胞样仿生纳米材料(MCSCe),该材料以碳纳米球(CS)为基础,在808 nm激光照射下,可以通过吸收NIR形成高温,并催化H2O2产生·OH.同时,将CeO2 NPs点缀在CS表面,在酸性的肿瘤微环境下,Ce3+可以将超氧化物分解以积累H2O2,自身转化为四价,Ce4+和超氧化物反应生成O2,改善肿瘤微环境.MCSCe的形态如图4(a)所示,粒子尺寸为142 nm.拉曼谱图上的2个峰,对应于CS碳原子sp2和sp3中的电子,其使CS具有化学活性,在温和的高温刺激下,它可以催化H2O2产生·OH,如图4(b)所示.XPS分析表明,Ce3+/Ce4+在CS表面上的含量比例高达49∶51,如图4(c)所示.为了评估MCSCe的类超氧化物歧化酶活性,将MCSCe溶解在超氧化钾(KO2)溶液中,用DPBF来检测超氧化物O2.-,其可以与超氧化物反应,降低自身的紫外吸光度,如图4(d)所示.同时,通过O2的产生来评估H2O2的分解,实验结果表明:材料表面的Ce具有优异的类超氧化物歧化酶活性,如图4(e)所示.需要说明的是,MCSCe的类超氧化物歧化酶活性略低于没有包覆细胞膜的氧化铈涂布碳纳米球(CSCe),主要是由于表面细胞膜阻碍了O2.-与Ce的接触.此外,用电子自旋共振谱研究二甲基吡啶N-氧化物电子捕获剂(DMPO)作为自旋捕集剂时MCSCe的催化性能,在辐照MCSCe和H2O2的混合物后,顺磁共振波谱仪(ESR)光谱显示强度比为1∶2∶2∶1的4个峰,表明了·OH的产生,如图4(f)所示.进一步通过香豆素的光致发光光谱监测·OH的量,其可以与·OH反应产生荧光7-羟基香豆素.如图4(g)所示,发光强度随着照射时间的增加而逐渐增加,表明·OH的积累.该现象说明也可以通过直接热诱导的·OH产生来观察.值得注意的是,Ce3+也可以通过类芬顿反应产生·OH,这取决于pH值,但产率相对较低.此外,进一步在细胞中进行了O2.-,H2O2和·OH的检测,如图4(h)和图4(i)所示.分别以DCFH‒DA和二氢乙啶(DHE)为指示剂,研究了O2.-分解使细胞内H2O2的积累的情况.如图4(h)所示,DHE的荧光强度在8 h内降低到56%,在16 h的培养中降低到31%,反映了在存在MCSCe的情况下O2.-的分解.同时,DCF‒DA的荧光强度在8 h内增加了2.3倍,在16 h内增加了3.5倍,表明H2O2的高效生成.这些结果证实了MCSCe能通过类超氧化物歧化酶催化有效地将细胞内O2.-转化为H2O2,从而增强癌症治疗.
3.4.2 CHT、PTT和化学动力治疗(CDT)联合治疗
CDT是一种新兴的治疗策略,该疗法是基于铁介导的芬顿反应将活性较低的H2O2转化为高毒性的·OH,该方法具有内源性触发、高选择性和调节肿瘤缺氧等优点.迄今为止,除了铁材料外,CeO2也表现出类芬顿反应活性,可用于CDT.由于其单一的癌症治疗策略不能使治疗效果最大化,常联合其他治疗的方法来达到增强治疗的效果.例如,结合PTT增强将H2O2转化为·OH的能力,并加速药物释放速率,改善CDT性能.此外,CHT可以通过抑制某些特定的细胞信号来提高CDT的疗效.因此,PTT/CDT/CHT联合治疗可作为一种有效的肿瘤治疗策略.
Xu等[15]制备了聚多巴胺(PDA)和碳酸氢铵(NH4HCO3)涂层和DOX负载的中空CeO2 NPs(即PDAC NPs),在PTT,CHT和CDT中显示出了优异的协同作用.在近红外激光照射下,PDA外壳可以吸收入射光,并将其转化为热量,不仅可以杀死耐高温的肿瘤细胞,还可以触发NH4HCO3分解为气态二氧化碳(CO2)和氨气(NH3),从而导致结构破坏.结构的破坏进一步加速了DOX释放和CeO2的暴露,DOX可以进入细胞核以誘导化学疗法,而CeO2可以催化细胞H2O2转化为羟基自由基,从而进行化学动力学治疗.PDAC NPs在体外和体内均显示出优异的治疗功效,该设计为协同肿瘤治疗提供了新的策略.
4 结 语
CeO2 NPs材料已被广泛用于生物领域,包括CHT,PDT和RT等方面,不同的实验都证明了该材料在实际应用中具有良好的效果.CeO2的类酶活性为肿瘤的治疗提供了简便有效的方案.但是在实验过程中如何避免材料的团聚,如何通过表面修饰提高其靶向性,仍是首要研究问题.随着科学家们不断的努力和科技的进步,相信该材料在生物领域上会有更大的突破.
参考文献:
[1] NOURMOHAMMADI E, KHOSHDEL-SARKARIZI H, NEDAEINIA R, et al. Cerium oxide nanoparticles: a promising tool for the treatment of fibrosarcoma in vivo [J]. Materials Science and Engineering C,2020,109:110533.
[2] LIU X,LIU J, CHEN S, et al. Dual-path modulation of hydrogen peroxide to ameliorate hypoxia for enhancing photodynamic/starvation synergistic therapy [J]. Journal of Materials Chemistry B,2020,8(43):9933-9942.
[3] ZENG L,CHENG H,DAI Y, et al. In vivo regenerable cerium oxide nanozyme-loaded pH/H2O2-responsive nanovesicle for tumor-targeted photothermal and photodynamic therapies [J]. ACS Applied Materials and Interfaces,2021,13(1):233-244.
[4] INBARAJ B S, CHEN B H. An overview on recent in vivo biological application of cerium oxide nanoparticles [J]. Asian Journal of Pharmaceutical Sciences,2020,15(5):558-575.
[5] GAO Y, CHEN K, MA J L, et al. Cerium oxide nanoparticles in cancer [J]. Onco Targets and Therapy,2014,7:835-840.
[6] WASON M S, COLON J, DAS S, et al. Sensitization of pancreatic cancer cells to radiation by cerium oxide nanoparticle-induced ROS production [J]. Nanomedicine: Nanotechnology, Biology, and Medicine,2013,9(4):558-569.
[7] SRIDHARAN P, VINOTHKUMAR G,PRATHEESH P, et al. Biomimetic potential of cerium oxide nanoparticles in modulating the metabolic gene signature in GBM-derived cell lines [J]. Journal of Materials Science,2020,55(25):11622-11636.
[8] CVON M, ALILI L, TEUBER-HANSELMANN S, et al. Redox-active cerium oxide nanoparticles protect human dermal fibroblasts from PQ-induced damage [J]. Redox Biology,2015,4:1-5.
[9] BEKESCHUS S. Combined toxicity of gas plasma treatment and nanoparticles exposure in melanoma cells in vitro [J].Nanomaterials,2021,11(3):806-816.
[10] HUANG X, LI L D, LYU G M, et al. Chitosan-coated cerium oxide nanocubes accelerate cutaneous wound healing by curtailing persistent inflammation [J]. Inorganic Chemistry Frontiers,2018,5(2):386-393.
[11] GAO R, MITRA R N, ZHENG M, et al. Developing nanoceria-based ph-dependent cancer-directed drug delivery system for retinoblastoma [J]. Advanced Functional Materials,2018,28(52):201806248.
[12] NIU J, AZFER A, ROGERS L M, et al. Cardioprotective effects of cerium oxide nanoparticles in a transgenic murine model of cardiomyopathy [J]. Cardiovascular Research,2007,73(3):549-559.
[13] SANE P K, TAMBAT S, SONTAKKE S, et al. Visible light removal of reactive dyes using CeO2 synthesized by precipitation [J]. Journal of Environmental Chemical Engineering,2018,6(4):4476-4489.
[14] HUANG X, LIU H, LIU J, et al. Synthesis of micro sphere CeO2 by a chemical precipitation method with enhanced electrochemical performance [J]. Materials Letters,2017,193:115-118.
[15] XU K,CHENG Y,YAN J, et al. Polydopamine and ammonium bicarbonate coated and doxorubicin loaded hollow cerium oxide nanoparticles for synergistic tumor therapy [J]. Nano Research,2019,12(12):2947-2953.
[16] CINZIA P, GABRIELE G S, FABIO M, et al. Cardiac side effects of chemotherapy: state of art and strategies for a correct management [J]. Current Vascular Pharmacology,2014,12(1):106-116.
[17] SACK M, ALILI L, KARAMAN E, et al. Combination of conventional chemotherapeutics with redox-active cerium oxide nanoparticles: a novel aspect in cancer therapy [J]. Molecular Cancer Therapeutics,2014,13(7):1740-1749.
[18] MINOTTI G, MENNA P, SALVATORELLI E, et al. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity [J]. Pharmacological Reviews,2004,56(2):185-229.
[19] DU C, DENG D, SHAN L, et al. A pH-sensitive doxorubicin prodrug based on folate-conjugated BSA for tumor-targeted drug delivery [J]. Biomaterials,2013,34(12):3087-3097.
[20] GENIER F S, BIZANEK M, WEBSTER T J, et al. Increased viability of fibroblasts when pretreated with ceria nanoparticles during serum deprivation [J]. International Journal of Nanomedicine,2018,13:895-901.
[21] YAO C, WANG W, WANG P, et al. Near-infrared upconversion mesoporous cerium oxide hollow biophotocatalyst for concurrent pH-/H2O2-responsive O2-evolving synergetic cancer therapy [J]. Advanced Materials,2018,30(7):1704833.
[22] JIA T, XU J, DONG S, et al. Mesoporous cerium oxide-coated upconversion nanoparticles for tumor-responsive chemo-photodynamic therapy and bioimaging [J]. Chemical Science,2019,10(37):8618-8633.
[23] WASON M S, LU H, YU L, et al. Cerium oxide nanoparticles sensitize pancreatic cancer to radiation therapy through oxidative activation of the JNK apoptotic pathway [J]. Cancers,2018,10(9):303-319.
[24] KOUVARIS J R, KOULOULIAS V E, VLAHOS L J. Amifostine: the first selective-target and broad-spectrum radioprotector [J]. The Oncologist,2007,12(6):738-747.
[25] KRUG L M, CURLEY T, SCHWARTZ L, et al. Potential role of histone deacetylase inhibitors in mesothelioma: clinical experience with suberoylanilide hydroxamic acid [J]. Clinical Lung Cancer,2006,7(4):257-261.
[26] TARNUZZER R W, COLON J, PATIL S, et al. Vacancy engineered ceria nanostructures for protection from radiation-induced cellular damage [J]. Nano Letters,2005,5(12):2573-2577.
[27] ZHANG C, LIU W L, BAI X F, et al. A hybrid nanomaterial with NIR-induced heat and associated hydroxyl radical generation for synergistic tumor therapy [J]. Biomaterials,2019,199:1-9.
(責任编辑:郁慧,包震宇)
