葡萄糖氧化酶介导的癌症多模态协同治疗研究进展
2021-01-06曹雨诗杨红
曹雨诗 杨红


摘 要: 简要介绍了葡萄糖氧化酶(GOx)在癌症治疗研究中的单一疗法(包括饥饿疗法(ST)、氧化疗法)、双模态疗法(包括协同化学疗法(CT)、化学动力学疗法(CDT)、声动力学疗法(SDT)、光动力学疗法(PDT)、光热疗法(PTT)、气体疗法、放射疗法),以及GOx介导的多模态联合疗法(协同免疫疗法/CDT/PTT/SDT),系统地阐述了GOx介导的相关癌症治疗研究的进展和最新动态.
关键词: 葡萄糖氧化酶(GOx); 癌症治疗; 免疫治疗; 多模态协同治疗
中图分类号: Q 554+.9 文献标志码: A 文章编号: 1000-5137(2021)06-0764-10
Abstract: This article briefly introduces the application of glucose oxidase(GOx) in cancer treatment research, including monotherapy(starvation therapy(ST), oxidation therapy), bimodal therapy(synergistic chemotherapy(CT), chemical dynamic therapy(CDT), sonodynamic therapy(SDT), photodynamic therapy(PDT), photothermal therapy(PTT), gas therapy, radiotherapy), and GOx-mediated multimodal combination therapy(synergistic immunotherapy/CDT/PTT/SDT). This paper systematically reviews the research progress and latest developments of GOx-mediated cancer therapy.
Key words: glucose oxidase(GOx); cancer therapy; immunotherapy; multimodal synergistic therapy
0 引 言
葡萄糖氧化酶(GOx)是一种由2个相同的多肽链亚基和2个非共价结合的黄素腺嘌呤二核苷酸(FAD)辅酶组成的二聚体糖蛋白[1].它是一种内源性氧化还原酶,广泛应用于监测糖尿病的生物传感器、生物燃料电池、食品和饮料添加剂等领域[2].作为生物催化剂,GOx能有效地利用分子加氧电子受体将葡萄糖氧化成葡萄糖酸,并同时产生过氧化氢(H2O2),因此吸引了大量癌症诊断和治疗领域研究人员的兴趣[3].GOx不仅可以消耗葡萄糖,引发饥饿疗法(ST),还可以增强肿瘤微环境(TME)内的缺氧情况,放大缺氧激活化疗的疗效,增加TME酸性程度用于增强铁基化学动力学疗法(CDT),并提高H2O2的含量用于氧化治疗[4].
本文作者介绍了GOx介导的单一/多模态疗法的研究进展,讨论了GOx在癌症治疗方面所面临的挑战和发展前景.由于GOx可负载于多种多功能生物材料中,形成更多功能的治疗药物,这种新型的协同治疗理念,引起了科学界不同领域的广泛兴趣,并且促进了基于GOx纳米药物的开发和临床应用.
1 GOx介导的单一治疗
GOx催化反应可消耗葡萄糖并生成H2O2.利用这2个特点,GOx已被用作许多癌症单一疗法的基础,如以消耗葡萄糖为主的ST[5]和H2O2介导的氧化疗法.
1.1 单一ST
肿瘤细胞可通过厌氧糖酵解(即Warburg效应)获取新陈代谢所需能量,这一特性使癌细胞对其细胞内部葡萄糖的浓度变化极其敏感.鉴于葡萄糖在肿瘤生长和能量代谢方面的关键性作用,2018年DINDA等[5]设计了一种使用基于均苯三甲酸的生物素化两亲物的自组装囊泡(TMB)包裹GOx的生物传感器,通过GOx介导的葡萄糖耗竭反应阻断肿瘤细胞之间的能量供应,从而消灭癌细胞.结果显示,这一疗法对癌细胞(HeLa,B16‒F10)比正常细胞(CHO,NIH3T3)具有更高的杀伤性.但GOx催化葡萄糖的反应是一个耗氧的过程,导致肿瘤内部的缺氧水平进一步升高,这给ST带来了很大的环境限制.为了克服这一困难,ZHANG等[6]构建了一个基于GOx和二氧化锰纳米粒子(MnO2 NPs),使用聚合物透明质酸(HA)包裹GOx的循环性葡萄糖耗竭纳米系统(MnO2‒GOx‒HA).此纳米系统可靶向肿瘤细胞表面的特征蛋白(糖蛋白CD44),一方面可以提供反应所需要的氧气(O2)环境,另一方面特异地靶向肿瘤细胞,从而提高了实体瘤的癌症ST效果.
1.2 单一氧化疗法
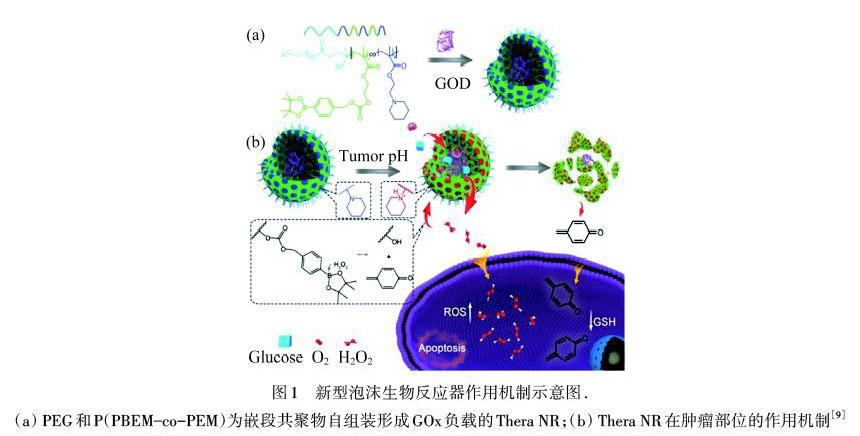
氧化治疗是指通过产生大量的活性氧(ROS),如过氧化氢(H2O2)、羟基自由基(·OH)、超氧阴离子自由基(·O-2)和单线态氧(1O2)等,来增加肿瘤细胞的氧化应激,从而诱导细胞死亡.根据产生ROS的途径不同,氧化疗法可分为PDT,SDT,CDT等几种疗法.GOx的注入可以使TME中产生足够量的H2O2,但是持续产生的H2O2会对全身产生很大的毒副作用[4].常见的解决方法有2种:一种是将凝胶[7]或其他物质与GOx结合或包裹[8],将其固定在肿瘤区域,防止其扩散至正常组织;另一种是设计激活反应载体,这种载体在健康组织中不被激活,但可以被独特的TME[9]或外部刺激激活.LI等[9]以聚乙二醇(PEG)和共聚苯硼酸酯或哌啶功能化甲基丙烯酸酯(P(PBEM?co‒PEM))为嵌段共聚物,构建了一种结合GOx的新型泡沫型生物反应器(Thera NR),如图1(a)所示.在GOx的催化下,肿瘤组织大量地消耗葡萄糖,这种反应显著增加了肿瘤部位的氧化应激效果.同时,高浓度的H2O2会导致癌细胞自身破坏,释放出甲基醌(QM)来耗尽谷胱甘肽,从而抑制癌细胞的抗氧化能力,达到杀伤肿瘤的效果,如图1(b)所示.
2 GOx介导的多模态协同治疗
TME的异质性、多样性和复杂度促使癌症研究逐渐从单一治疗模式转向多模式协同治疗的方向,多项研究证明了多模式协同治疗相较于单一治疗,可大大提高治疗效果.例如:协同化学疗法(CT)、CDT、声动力学疗法(SDT)、光动力学疗法(PDT)、光热疗法(PTT)、气体疗法、放射疗法和免疫联合疗法等等.
2.1 协同CT
GOx对葡萄糖的催化作用可以大大改变TME中O2和H2O2的浓度以及pH值,加剧瘤内缺氧情况.这种乏氧、增酸、高H2O2浓度的环境变化都可以激活相应的前体药物,达到增强CT的效果.
2.1.1 低氧激活型CT
实体瘤内部缺氧的实际情况导致治疗效果欠佳.为了提高GOx的治疗效果,ZHANG等[10]设计了一种新型的癌症治疗策略,将基于GOx的ST和二盐酸班诺蒽醌(AQ4N)的缺氧激活疗法相结合,使用脂质体纳米载体将GOx和AQ4N包裹在长循环的隐形脂质体中,可以有效地输送到肿瘤部位,具有很高的肿瘤归巢效应.GOx通过催化葡萄糖达到ST和耗氧的目的,AQ4N可以被缺氧激活,有效地对肿瘤进行进一步的联合治疗.
2.1.2 酸度激活型CT
GOx在消耗瘤内葡萄糖的同时,还可以产生大量的葡萄糖酸,有效地降低TME的酸度.ZHANG等[11]报道了一种新型的ST协同酸响应治疗的研究,该研究使用HA包裹GOx和碳酸钙(CaCO3)负载的低氧前药替拉帕明(TPZ)纳米粒子,其中CaCO3可以在酸性环境中被降解,释放出TPZ,如图2所示.由于被动降解和主动靶向机制的协同作用,这种混合态纳米粒子在肿瘤中注射后体现出高度蓄积状态.这种使ST和CT协同作用的设计达到了显著的治疗效果.
2.1.3 H2O2激活型CT
H2O2可將一些低毒的前体药物转化为具有高度细胞毒性的治疗药物,LI等[12]构建了一种催化剂纳米生物反应器聚合物,如图3所示,其可在肿瘤部位被激活,实现氧化/化疗协同的新型肿瘤治疗方法.由PEG、营托霉素(CPT)和烟斗素改性地甲基丙烯酸酯(P(CPTMA‒co‒PEMA))的聚合物单体组成的块状聚合物和GOx被一同包裹,组装成了纳米级生物反应器(GOx@PCPT‒NR).GOx@PCPT‒NR在正常组织中保持失活状态,到达肿瘤部位后,肿瘤酸性触发聚丙烯‒甲基丙烯酸酯共聚单体(PPEMA)质子化导致聚合物体膜的高渗透性,扩散的GOx耗竭瘤内葡萄糖和O2,产生的H2O2增加肿瘤内的氧化应激效应.同时,高浓度的H2O2进一步激活前体药物(PCPTMA),释放活性CPT药物,这种酸响应激活的氧化/化疗协同的新型癌症疗法给癌症治疗带来了新的发展方向.
2.2 协同CDT
CDT是一种基于Fenton或类Fenton反应的CT,它通过催化剂将H2O2直接转化为有高细胞毒性的·OH,且不需要外部能量激发便可以达到杀伤肿瘤的治疗效果.H2O2不需要先转化为O2,简化了治疗的反应路径,有助于降低毒副性.但是瘤内H2O2的浓度十分低(内源性H2O2只有5×10-5~1×10-4 mol·L-1,不足以产生所需的·OH,故CDT的治疗效果受到限制[13].由于GOx介导的催化反应可以为CDT提供所需的H2O2,ZHOU等[14]设计了一种制备含二硫化钼(MoS2)和GOx的海藻酸钠水凝胶(MoS2‒ALG‒Fe/GOx,MAF),如图4所示.水凝胶中包裹的GOx可发生消耗葡萄糖生成H2O2的酶促反应,以及三价铁离子(Fe3+)与MoS2发生氧化还原反应生成二价铁离子(Fe2+)和钼酸根(MoO42-).生成的Fe2+可被氧化成Fe3+,再与MAF反应生成Fe2+.此外,产生的Fe2+诱导Fenton反应,使H2O2持续转化为有细胞毒性的·OH,用于肿瘤的CDT.结合MoS2的高光热转化能力,该水凝胶被用于肿瘤治疗中的PTT,ST和CDT的联合治疗,有望为水凝胶在临床医学上的开发和应用提供一条新的途径.
2.3 协同SDT
SDT是指在分子氧存在的情况下使用低强度超声波代替光来激活增敏剂,是基于PDT的一种新型疗法.相较于PDT,SDT的主要优点是大幅度增加了治疗的穿透深度,软组织中的穿透深度甚至可以达到几十厘米[15].SDT和GOx介导的ST虽然大大提高了治疗效果,但是所引起的氧耗会使肿瘤的缺氧环境恶化,从而进一步影响治疗效果.为了解决这些问题,ZHANG等[16]将介孔二氧化锰(MnO2)纳米颗粒作为TME中的原位产氧材料,通过负载声敏剂(如血卟啉单甲醚(HMME))和表面修饰GOx,构建了一种基于介孔MnO2纳米颗粒的级联催化纳米平台,这种纳米材料有望加强肿瘤的特异性治疗.超声可使纳米粒子中的HMME产生ROS,GOx可介导ST,MnO2纳米粒子在肿瘤部位催化H2O2生成O2.此外,体系中释放的Mn2+能够增强磁共振成像(MRI)信号.该研究将GOx介导的ST协同HMME介导的SDT,为生物医学在癌症治疗中的应用提供了良好的前景.
2.4 协同PDT
PDT中的光敏药物将能量传递给周围的氧原子,生成活性很强的1O2.1O2能与附近的生物大分子发生氧化反应,产生细胞毒性进而杀伤肿瘤细胞,但低氧实体瘤和肿瘤特异性光敏剂的缺乏阻碍了O2依赖型PDT的进一步应用.FU等[17]设计了一种可生物降解、自供氧的特异性级联催化反应纳米平台的新增强型PDT.在掺杂Mn和GOx的磷酸钙矿化纳米粒子(GM NPs)中,分别加入过氧化氢酶(CAT)和卟啉钠(DVDMS),构建了纳米级的生物催化反应器(命名为GMCD).GMCD可以有效地积聚在肿瘤部位,实现“关转开”的荧光转导和TME介导的“关转开”型MRI.内源性H2O2内化进入癌细胞后,可被CAT催化生成O2,不仅促进GOx催化反应消耗更多的肿瘤内葡萄糖,还能缓解肿瘤缺氧,增强光触发DVDMS产生1O2的能力.此外,GOx催化产生的H2O2可以通过Mn2+介导的类Fenton反应转化为剧毒的·OH,进一步放大癌细胞的氧化损伤.DVDMS的负载广泛地改善了GMCD的肿瘤蓄积,而GM NPs良好的蓄积能力和pH响应性降解导致长期的药物释放行为.当GMCD内化到癌细胞内时,由于ROS(包括1O2和·OH)的强烈氧化应激,GMCD的级联催化反应在耗尽葡萄糖营养物质的同时,破坏了细胞结构.结果表明,GMCD通过长期级联催化反应增强PDT对4T1荷瘤小鼠显示出良好的治疗效果.
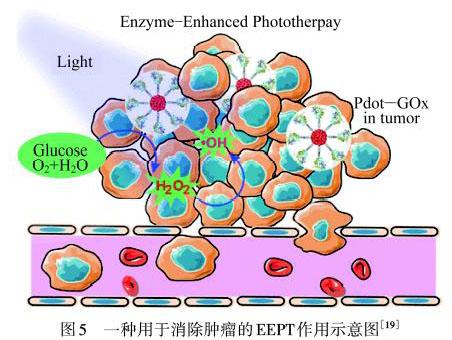
除此之外,其他光敏剂也可以通过产生ROS来达到氧化应激效果.基于GOx的催化葡萄糖产生H2O2的特性,CHANG等[18]设计了一种使用GOx与小聚合点(Pdot)的共价连接构建的纳米催化反应器(Pdot‒GOx),开创了一种用于消除肿瘤的新型酶促光疗(EEPT).该研究通过GOx催化瘤内葡萄糖氧化,同时生成大量的H2O2.在外加光照下,生成的H2O2被光解生成·OH,如图5所示.体外和体内实验都表明,Pdot‒GOx纳米生物反应器可以有效地消灭荷瘤小鼠的癌细胞并抑制肿瘤的生长,表明EEPT方法在癌症治疗中的良好前景.但该方法依然存在不足之处,即正常组织若长时间暴露在短波长蓝光下会造成损伤,并且光照本身的穿透深度并不够深,无法对深层肿瘤进行治疗.因此,YU等[19]设计了一种仿生纳米反应器(bio‒NR)来实现ST协同CT及PDT达到抑制肿瘤转移的目的.中空介孔二氧化硅(SiO2)纳米颗粒(HMSNs)负载的光敏剂在深转移瘤的原位化学能的激发下产生1O2,用于PDT,这一过程不仅阻断了肿瘤组织中的营养供应,而且还提供了丰富的H2O2来协同增强PDT.纳米粒子表层的癌细胞膜涂层,使纳米粒子增加了同源粘附和免疫逃逸的生物学特性.因此,在转移性肿瘤组织中,bio‒NR能有效地生成1O2,其在体内外的良好治疗效果表明其在肿瘤转移治疗方面具有巨大的潜力.
2.5 协同PTT
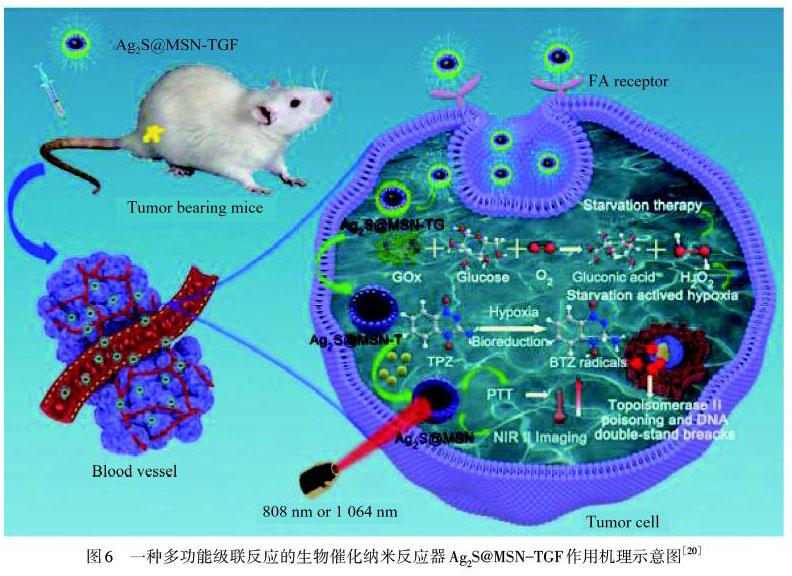
PTT是将光能转化为热能来杀死癌细胞的一种治疗方法.然而热休克蛋白(HSP)会上调肿瘤细胞的耐热性,限制治疗效果.温度过高会导致肿瘤周围的健康组织受损,因此可将PTT与ST相结合解决这个难题.ST可减少瘤内HSP的表达,增强PTT的治疗效果.同时PTT可提高瘤內温度,为GOx提供更好的催化环境[4].LI等[20]在硫化银纳米颗粒(Ag2S NPs)表面包覆介孔SiO2,然后在介孔SiO2中负载缺氧活性前药替拉帕胺,并在其表面负载GOx,合成了一种多功能级联反应的生物催化纳米反应器(命名为Ag2S@MSN‒TGF),如图6所示.将GOx与替拉帕明联合使用,可以同时达到消耗O2和增强缺氧环境的双重效果.此外,该研究还率先将Ag2S NPs用于二区近红外光(NIR‒II,1 064 nm)激发PTT,其光热转换效率(44.7%)高于808 nm激光照射下的光热转换效率(38.2%).体内NIR‒II荧光成像结果表明,Ag2S@MSN‒TGF对治疗过程具有明显的示踪作用.因此,Ag2S@MSN‒TGF在体内外协同ST、低氧活性前药治疗和PTT作用下,显示出优于任何单一治疗模式的抑瘤效果,NIR‒II影像导向抗肿瘤治疗表现出了良好的应用前景.
2.6 协同气体疗法
近年来,有一种新兴的绿色气体疗法被大家所关注,有望成为CT的替代疗法[21].在气体治疗的方案中,一氧化氮(NO)参与了机体中许多生理和病理的活动[22].特别是在癌症治疗领域,高浓度(>1 mmol·L-1)的NO不仅可以通过线粒体内的DNA亚硝化直接杀死癌细胞[23],还能协同PDT或放射治疗增强其效果.FAN等[24]受GOx催化葡萄糖转化为葡萄糖酸和毒性H2O2的启发,开发了一种新型的类ST,具有显著的肿瘤杀伤作用,比传统的ST效果更佳.此外,生成的酸性H2O2可以将L‒精氨酸(L‒Arg)氧化成NO,以加强气体治疗效果.利用中空介孔有机SiO2纳米颗粒(HMON)作为生物相容性/生物可降解性的纳米载体共传递GOx和L‒Arg,首次构建了一种新型的葡萄糖响应型纳米药物(命名为L‒Arg‒HMON‒GOx),用于协同ST和气体治疗以起到抗癌作用,不需要外界刺激即可产生大量的H2O2,几乎无不良反应.
2.7 协同放射疗法
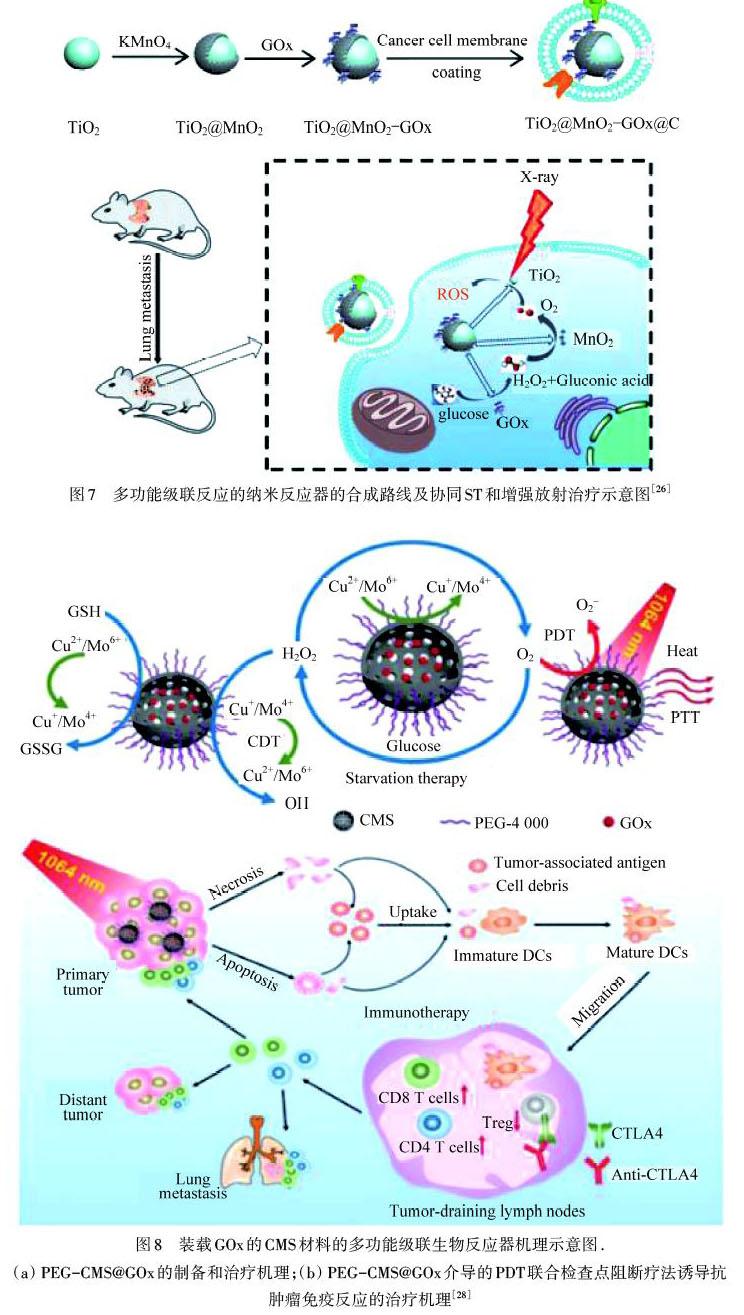
放射治疗是一种利用高强度电离辐射(例如X‒ray和γ‒rays)诱导DNA损伤,从而杀死肿瘤细胞的治疗方法.然而,低氧的微环境和较差的电离吸收限制了放射治疗的发展[25].PAN等[26]构建了一种使用癌细胞膜包裹,并掺杂GOx的核壳结构(TiO2@MnO2)纳米反应器,用于增强抑制肿瘤转移的放射治疗方案,如图7所示.该纳米反应器可以特异性地靶向肿瘤组织,催化葡萄糖氧化生成H2O2,并在X射线照射下产生丰富的ROS.GOx和MnO2催化级联反应可以消耗瘤内葡萄糖达到治疗效果,同时MnO2的降解产氧反应可以缓解肿瘤内缺氧情况,TiO2可通过具有高电离能量转换效率的X射线将O2转化为ROS.这种多功能级联反应的纳米反应器协同了ST和增强了放射治疗,为癌症治疗提供了很好的应用前景.
2.8 多模态协同免疫疗法/CDT/PTT/ST
免疫疗法通过激活患者自身的免疫系统来对抗肿瘤,可以有效地减少复发和转移,最近已成为一种潜在的有效治疗方法[27].免疫检查点阻断疗法(如anti‒PD‒1和anti‒CTLA‒4),是肿瘤免疫治疗中最重要的治疗方法之一.为此,CHANG等[28]构建了一种装载GOx的中空介孔四硫化钼二铜(Cu2MoS4,CMS)的多功能级联生物反应器(命名为GOx@CMS),协同CDT/ST/PDT/免疫疗法等联合疗法,如图8所示.这一治疗方法开启了ST的四模态协同治疗时代,具有重要的参考价值.含有多价元素正一价/正二价铜(Cu1+/2+)、正四价/正六价钼(Mo4+/6+)的CMS具有类Fenton、类谷胱甘肽(GSH)和类过氧化氢酶(CAT)的活性.CMS一旦内化到肿瘤内,可通过Fenton反应产生·OH触发CDT,并清除TME中过表达的GSH,从而降低肿瘤的抗氧化能力.此外,在低氧TME条件下,CMS中的类CAT可与内源H2O2反应生成O2,激活GOx催化葡萄糖氧化,触发ST,并伴随H2O2的产生.再次产生的H2O2可触发类Fenton反应,GOx催化实现了CDT的增强.同时,在1 064 nm激光照射下,CMS具有良好的光热转化效率(63.3%),以及产生细胞毒性超氧阴离子(·O2-)的能力,表现出显著的光动力学效应.更重要的是,CMS协同免疫疗法,与检查点阻断治疗相结合,可以有效地消融原发肿瘤和抑制癌症转移,从而引发强大的免疫反应.
3 结论与展望
由于TME中的异质性、复杂性和多样性,给癌症治疗研究带来了不小的困难和挑战.GOx催化反应可以有效地消耗肿瘤内部的葡萄糖和O2供应,导致TME中酸度、缺氧水平和H2O2含量的增加.这种独特且珍贵的催化特性使GOx成为目前较为热门的癌症治疗药物.目前,协同ST的多模态疗法层出不穷,通过将GOx与其他酶、光敏剂、缺氧激活的前体药物、金属纳米颗粒或Fenton试剂等结合起来,可以将两种或两种以上的治疗方法整合到一个纳米平台上,从而产生优异的治疗效果.但是基于GOx的癌症疗法在正式应用于临床治疗之前,对GOx产生饥饿效应的分子机制仍需在蛋白分子层面上继续深入研究,了解其作用机制,确保其安全性和有效性.并且GOx作为一种蛋白酶,具有稳定性差、半衰期短等缺点,因此需要扬长避短,开发更多生物相容且生物降解的载体材料(如水凝胶),实现更为安全有效的治疗.尽管现阶段仍然有一些悬而未解的问题,但GOx介导的癌症治疗的确是一个新兴的前沿研究,值得进一步去探索.希望基于GOx的多模态癌症治疗方法、纳米药物的设计和进一步的研究发展可以为患者提供更加行之有效的治疗方法.
参考文献:
[1] AKTER R, RHEE C K, RAHMAN M A. A highly sensitive quartz crystal microbalance immunosensor based on magnetic bead-supported bienzymes catalyzed mass enhancement strategy [J]. Biosensors & Bioelectronics,2015,66:539‒546.
[2] CHANG K W, LIU Z H, FANG X F, et al. Enhanced phototherapy by nanoparticle-enzyme via generation and photolysis of hydrogen peroxide [J]. Nano Letters,2017,17(7):4323‒4329.
[3] CHENG L, WANG C, FENG L Z, et al. Functional nanomaterials for phototherapies of cancer [J]. Chemical Reviews, 2014,114(21):10869‒10939.
[4] WANG C, YANG J, DONG C, et al. Glucose oxidase-related cancer therapies [J]. Advanced Therapeutics,2020,3(10):2000110.
[5] DINDA S, SARKAR S, DAS P K. Glucose oxidase mediated targeted cancer-starving therapy by biotinylated self-assembled vesicles [J]. Chemical Communications,2018,54(71):9929‒9932.
[6] ZHANG Y H, QIU W X, ZHANG M, et al. MnO2 motor: a prospective cancer-starving therapy promoter [J]. ACS Applied Materials & Interfaces,2018,10(17):15030‒15039.
[7] ZHAO W, HU J, GAO W. Glucose oxidase-polymer nanogels for synergistic cancer-starving and oxidation therapy [J]. ACS Applied Materials & Interfaces,2017,9(28):23528?23535.
[8] KARIMZADEH S, JAVANBAKHT S, BARADARAN B, et al. Synthesis and therapeutic potential of stimuli-responsive metal-organic frameworks [J]. Chemical Engineering Journal,2021,408:127233.
[9] LI J, DIRISALA A, GE Z, et al. Therapeutic vesicular nanoreactors with tumor-specific activation and self-destruction for synergistic tumor ablation [J]. Angewandte Chemie,2017,56(45):14025‒14030.
[10] ZHANG R, FENG L, DONG Z, et al. Glucose and oxygen exhausting liposomes for combined cancer starvation and hypoxia-activated therapy [J]. Biomaterials,2018,162:123‒131.
[11] ZHANG M K, LI C X, WANG S B, et al. Tumor starvation induced spatiotemporal control over chemotherapy for synergistic therapy [J]. Small,2018,14(50):1803602.
[12] LI J, LI Y, WANG Y, et al. Polymer prodrug-based nanoreactors activated by tumor acidity for orchestrated oxidation/chemotherapy [J]. Nano Letters,2017,17(11):6983‒6990.
[13] LIU X, LIU Y, WANG J, et al. Mild hyperthermia-enhanced enzyme-mediated tumor cell chemodynamic therapy [J]. ACS Applied Materials & Interfaces,2019,11(26):23065‒23071.
[14] ZHOU L L, ZHAO J L, CHEN Y K, et al. MoS2‒ALG‒Fe/GOx hydrogel with Fenton catalytic activity for combined cancer photothermal, starvation, and chemodynamic therapy [J]. Colloid Surf B:Biointerfaces,2020,195:111243.
[15] WU M, DING Y, LI L. Recent progress in the augmentation of reactive species with nanoplatforms for cancer therapy [J]. Nanoscale,2019,11(42):19658‒19683.
[16] ZHANG Y J, WANG H L, JIA X D, et al. Cascade catalytic nanoplatform for enhanced starvation and sonodynamic therapy [J]. Journal of Drug Targeting,2020,28(2):195‒203.
[17] FU L H, WAN Y, LI C, et al. Biodegradable calcium phosphate nanotheranostics with tumor-specific activatable cascade catalytic reactions-augmented photodynamic therapy [J]. Advanced Functional Materials,2021,31(14):2009848.
[18] CHANG K, LIU Z, FANG X, et al. Enhanced phototherapy by nanoparticle-enzyme via generation and photolysis of hydrogen peroxide [J]. Nano Letters,2017,17(7):4323‒4329.
[19] YU Z, ZHOU P, PAN W, et al. A biomimetic nanoreactor for synergistic chemiexcited photodynamic therapy and starvation therapy against tumor metastasis [J]. Nature Communications,2018,9:5044.
[20] LI W T, LIU S K, DONG S M, et al. A smart nanoplatform for synergistic starvation, hypoxia-active prodrug treatment and photothermal therapy mediated by near-infrared-II light [J]. Chemical Engineering Journal,2021,405:127027.
[21] KANG J, LI Z, ORGAN C L, et al. pH-controlled hydrogen sulfide release for myocardial ischemia-reperfusion injury [J]. Journal of the American Chemical Society,2016,138(20):6336‒6339.
[22] FROST M C, MEYERHOFF M E. Controlled photoinitiated release of nitric oxide from polymer films containing S‒Nitroso‒N‒acetyl-dl-penicillamine derivatized fumed silica filler [J]. Journal of the American Chemical Society,2004,126(5):1348‒1349.
[23] ZHANG X, TIAN G, YIN W, et al. Controllable generation of nitric oxide by near-infrared-sensitized upconversion nanoparticles for tumor therapy [J]. Advanced Functional Materials,2015,25(20):3049?3056.
[24] FAN W P, LU N, HUANG P, et al. Glucose-responsive sequential generation of hydrogen peroxide and nitric oxide for synergistic cancer starving-like/gas therapy [J]. Angewandte Chemie International Edition,2017,56(5):1229‒1233.
[25] GAO M, LIANG C, SONG X, et al. Erythrocyte-membrane-enveloped perfluorocarbon as nanoscale artificial red blood cells to relieve tumor hypoxia and enhance cancer radiotherapy [J]. Advanced Materials,2017,29(35):1701429.
[26] PAN W, CUI B, GAO P, et al. A cancer cell membrane-camouflaged nanoreactor for enhanced radiotherapy against cancer metastasis [J]. Chemical Communications,2020,56(4):547‒550.
[27] SONG W, KUANG J, LI C X, et al. Enhanced immunotherapy based on photodynamic therapy for both primary and lung metastasis tumor eradication [J]. ACS Nano,2018,12(2):1978‒1989.
[28] CHANG M, WANG M, WANG M, et al. A multifunctional cascade bioreactor based on hollow-structured Cu2MoS4 for synergetic cancer chemo-dynamic therapy/starvation therapy/phototherapy/immunotherapy with remarkably enhanced efficacy [J]. Advanced Materials,2019,31(51):1905071.
(责任编辑:郁慧,包震宇)
