聚苯胺纳米复合材料用于癌症诊疗的研究进展
2021-01-06周学素程玉莹闫歌田启威杨仕平
周学素 程玉莹 闫歌 田启威 杨仕平
摘 要: 共轭聚合物以其独特的结构和性能得到了广泛的关注.聚苯胺(PANI)纳米复合材料制备工艺简单、成本低廉、毒性低、易于功能化,从而在癌症治疗方面取得了巨大的进展.通过不同功能的化合物修饰制备的PANI纳米复合材料极大地拓宽了癌症治疗领域.基于PANI纳米复合材料,文章总结了其在癌症诊疗领域的光热治疗、协同治疗、多模态成像引导治疗和智能响应治疗的研究进展,并分析了其发展趋势.
关键词: 聚苯胺(PANI)纳米复合材料; 光热治疗; 协同治疗; 多模态成像; 智能响应
中图分类号: O 611.3 文献标志码: A 文章编号: 1000-5137(2021)06-0721-07
Abstract: Conjugated polymers have attracted much attention due to their unique structure and properties. Polyaniline(PANI) nanocomposites have the advantages of simple preparation process, low cost, low toxicity, easy functionalization, etc., and have made great progress in tumor treatment. PANI nanocomposites prepared by modifying different functional compounds have greatly broadened the field of tumor treatment. Based on PANI nanocomposites, this article reviews their research progress in photothermal therapy, collaborative therapy, multimodal imaging guided therapy, and intelligent response therapy in the field of cancer diagnosis and treatment, and analyzes its development trends.
Key words: polyaniline(PANI) nanocomposite; photothermal therapy; synergy therapy; multimodal imaging; intelligent response
0 引 言
癌症作为世界上高死亡率的疾病之一,一直以来都是人类面临的最严重的健康问题之一.在2018年,全世界因癌症死亡的人数就达到960万.目前在癌症临床治疗中应用比较多的是传统方法,包括手术、化学疗法和放射疗法.虽在杀死癌细胞方面具有明显效果,但传统疗法也会杀死正常细胞及组织,给病人带来副作用大、缺乏特异性等问题.光热疗法是一种通过外部刺激从而杀死癌细胞,侵入性小的微创疗法[1].由于近红外光具有很好的组织穿透能力,光能量可以充分传递到作用部位,光热疗法采用能够吸收近红外光的纳米材料,将光能转化为热能,从而在体内实现局部高温,杀死癌细胞,并且不损害其他正常组织[2].
共轭聚合物是一类特殊的聚合物,存在π电子共轭主链和高度离域化的结构,具有很高的光热转换效率,可以作为近红外光诱导的光热转换纳米材料.目前,共轭聚合物已广泛用于癌症治疗的研究领域[3],主要分为两大类:一类是有机共轭聚合物纳米粒子,例如聚吡咯(Pyy)、聚苯胺(PANI)、聚多巴胺[4]等;第二类是基于π共轭和离域电子的供体-受体(DA)体系设计的供体-受体共轭聚合物纳米粒子.共轭聚合物纳米粒子具有很高的光热转换效率,远远超过其他的纳米粒子,且具有优异的光稳定性和良好的生物降解性.
聚苯胺掺杂后其离域轨道电子易发生迁移,导带与价带之间的能隙减小,导致紫外可见吸收峰发生红移.当受到近红外光(NIR)照射时,PANI价带中的电子将受激发,跃迁至导带,具有显著的光电转换效应,实现光热转换,使得PANI可作為诊疗一体化试剂进行癌症治疗[5].PANI具有制备工艺简单、成本低廉、毒性低,以及可调节的结构和表面形态,有增强肿瘤治疗的效果.本文主要概述了PANI纳米复合材料的制备和改性,以及其在肿瘤诊断领域的研究进展.
1 PANI纳米复合材料的制备及改性
1.1 制 备
PANI纳米粒子合成的常用方法有化学氧化聚合法[6-7].化学氧化法是在酸性条件下使用氧化剂将苯胺单体氧化聚合成PANI,广泛应用的氧化剂有过硫酸铵、过氧化氢、氯化铁、高锰酸钾[8]等.通过改变质子酸的种类、氧化剂、原料浓度、反应时间、反应环境等因素,获得不同结构和形貌的PANI纳米粒子,从而实现不同的功能.例如,LIU等[7]采用氧化铁作为氧化剂,并改变氧化剂与苯胺之间的浓度比,制备得到纳米梭状的PANI. MONDAL等[9]将掺杂剂改为芳族羧酸,并改变有机酸中的-COOH基团数目,获得不同长径比的管状PANI纤维,其吸附效果良好,可用于油水分离.
1.2 表面改性
对纳米粒子表面改性,可以减少材料在体内的聚集,降低细胞毒性,阻止免疫系统对材料的清除,延长材料在血液的循环周期等,从而实现功能化治疗癌症.由于纳米材料进入体内后,在其表面会形成蛋白冠,粒子破坏蛋白冠后被体内的免疫系统识别,并当作有害物质从体内清除,降低了治疗效果[10].表面改性可以掩盖纳米粒子或阻止蛋白冠的形成,延长PANI纳米粒子在血液中的循环时间,并到达作用部位,提高治疗效果[11].
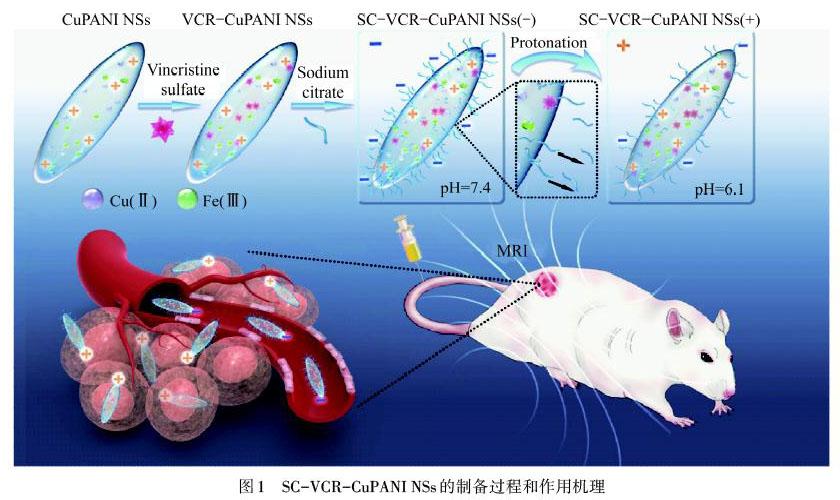
目前对PANI纳米材料的表面改性,主要通过物理吸附或采用共价键将配体结合在纳米颗粒表面等方式以实现其功能化.较常用于纳米颗粒改性的化合物是聚乙二醇.通过聚乙二醇改性可改善材料的亲水性,改变材料药代动力学效果,同时具有实现其他功能的优势[12].为了改善PANI在水中的分散性,WANG等[13]设计了一种核-壳结构的复合材料聚苯胺-聚吡咯烷酮(PANi@PVP),PVP作为空间稳定剂对PANI进行改性,在水中有优异的溶解性和良好的细胞相容性.LIU等[7]提出了一种分级靶向策略,设计了pH敏感的柠檬酸钠修饰的铜掺杂PANI纳米梭(SC-VCR-CuPANI NSs),如图1所示,该材料在血液中呈负电,显示出增强的隐身效果,血液循环周期延长,且在肿瘤微酸环境中实现质子化,提高细胞内在化效果.通过这种分级靶向的策略,材料在血液中的循环半衰期从4.35 h增加到7.33 h,磁共振成像分辨率和信号强度得到显著提高.
为了提高肿瘤的治疗效果,基于透明质酸(HA)可以特异性结合受体(CD44)靶向肿瘤细胞[14], JIANG等[15]设计了一种水溶性透明质酸-杂交PANI纳米材料,靶向光热治疗肿瘤.通过细胞实验,材料可以针对性地杀死癌细胞HeLa和HCT-116,而对正常细胞HFF没有影响.将HA修饰的二氧化硅荧光纳米颗粒连接到PANI,在靶向肿瘤的同时,二氧化硅提供的荧光成像可以引导光热治疗.
2 PANI纳米复合材料在肿瘤诊疗上的应用
2.1 光热治疗
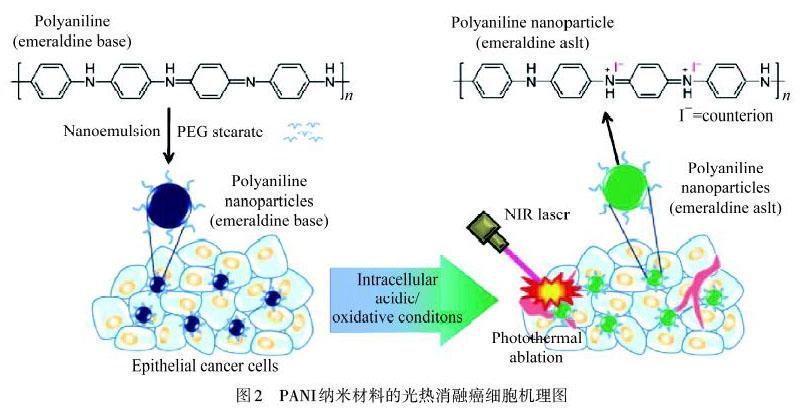
PANI经掺杂后在近红外区(700~900 nm)有很强的吸收,PANI具有成为光热剂的可能[16].如图2所示,YANG等[5]首次报道了PANI在酸性条件下进行掺杂,具有有机光热剂的潜力.用808 nm,2.45 W·cm-2的NIR激光照射5 min,掺杂态PANI温度升高了54.8 ℃,采用相同条件,本征态PANI温度升高了15 ℃左右,表明了掺杂后的PANI光热效果明显.为评估PANI对癌细胞在体外和体内的光热消融能力,将本征态的PANI用上皮癌细胞A431处理后发现,PANI颜色从紫色变成绿色,并在808 nm NIR激光下照射,台盼蓝染色实验发现大量细胞被破坏.同样在体内实验中,经瘤内注射材料,用激光照射治疗后,肿瘤组织切片显示有严重的细胞损伤.这说明PANI可以在癌细胞中掺杂,并诱导产生光热效应,从而杀死癌细胞.
2.2 协同治疗
光热疗法是微创治疗技术,通过外部激光刺激富集到肿瘤部位的材料导致局部升温,致使细胞结构发生破坏,但研究表明:受制于纳米材料在肿瘤部位的富集程度及机体代谢的影响,光热治疗的效果并不佳,同时材料也会给机体带来一定的毒性.对于深部肿瘤,激光强度会由于深度而依赖性改变,这些因素迫使光热疗法同其他的疗法相结合,从而增强肿瘤治疗的效果,降低治疗对机体正常组织的损伤[17-18].
将光热疗法和光动力疗法相结合,两种疗法均采用外部激光照射激发.光动力疗法是利用光敏剂和组织细胞中的氧气(O2)的共同存在,经激光照射产生活性氧(ROS),ROS会氧化生物大分子,从而破坏细胞结构,促使细胞死亡[19-20].由于肿瘤中低氧的限制,会降低光动力疗法的治疗效果,将光动力疗法和光热疗法相结合,可以提高整体治疗效果,同时光热疗法会促进血液的流动,提高肿瘤中的氧气浓度,得到1+1>2的效果.TAN等[21]合成了一种PANI包覆吲哚菁绿载银纳米复合材料(ICG-Ag@PANI),银/聚苯胺核壳纳米粒子(Ag@PANI)通过π-π堆积和疏水相互作用的方式负载光敏剂吲哚菁绿(ICG),实现单光触发的光热疗法和光动力疗法协同治疗.
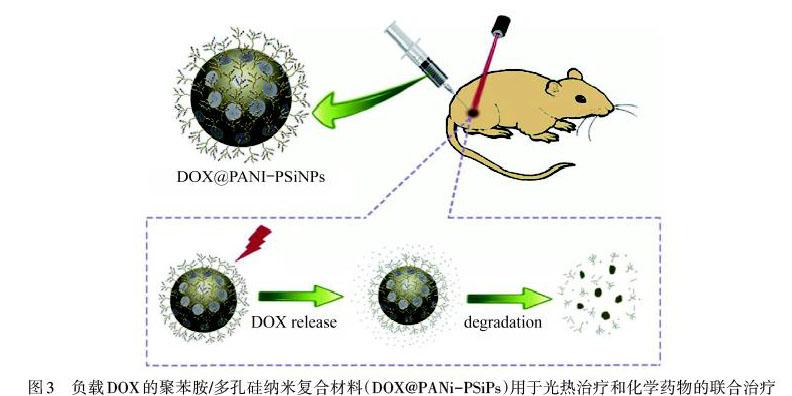
将光热剂与化疗药物结合,可控制药物在肿瘤部位的释放[22],降低药物对正常细胞的损伤,协同化疗和光热疗法能很好地提高癌症治疗能力.结合药物的方法有两种:一是将光热剂同可载药的载体结合;二是将光热剂自身设计为药物载体.SILVA等[23]设计了装载5-FU的二甲基咪唑结合PANI纳米粒子(PANI@ZIF-8),在NIR和pH=5.2的缓冲溶液中,5-FU的累计释放量达到80%,PANI吸收NIR会促使温度的升高,增强了5-FU的释放,具有很好的化学光热效应.如图3所示,XIA等[24]采用多孔硅包覆阿霉素(DOX),并将PANI共价接枝到其表面,通过pH和NIR响应控制药物释放,多孔硅可降解为无毒氢氧化硅(Si(OH)4)排出体外,解决了光热剂不可生物降解所带来的长期毒性问题,化学与光热结合疗法展现了巨大的潜力.
2.3 多模式成像引導治疗
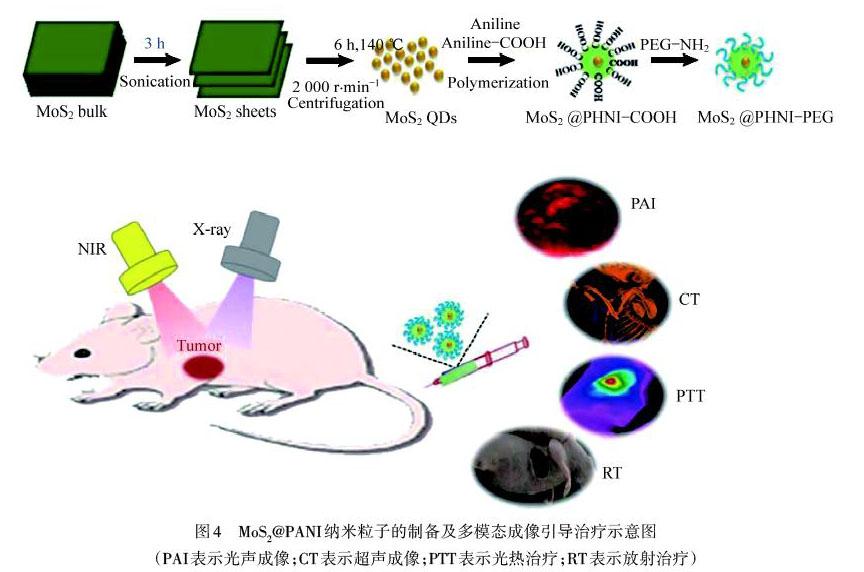
通过成像的方式来引导治疗可以有效地提高肿瘤治疗效率.掺杂态PANI在近红外区具有独特的光吸收特性,是一种优异的光声成像剂[25].光声成像是探测激光照射产生的光声信号后,产生组织分布图像的成像方式,具有高信噪比和高分辨率的优点[26].但是单一的成像依旧存在缺陷,尤其对深部肿瘤,光声成像对激光的强度存在依赖,激光过强会损伤正常的组织细胞.多模式成像方式引导治疗来提高治疗效果是目前研究的趋势.如图4所示,WANG等[27]制备一种PANI包覆二硫化钼(MoS2@PANI-PEG)量子点复合材料,MoS2量子点可产生强荧光,可用于体内成像的探针,同时MoS2是放射增敏剂,结合PANI的光热疗法和光声成像能力,协同增强癌症的治疗效果.
2.4 智能响应治疗
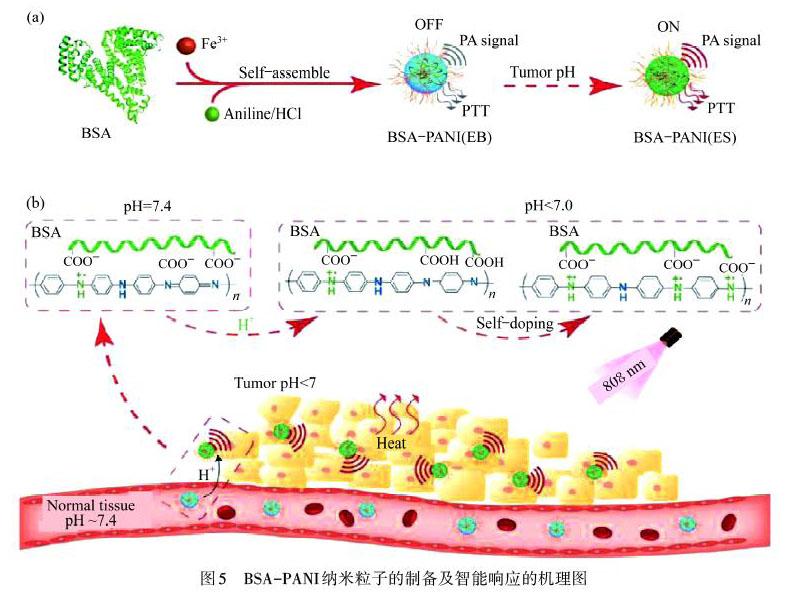
基于PANI易被质子酸掺杂和肿瘤微环境具有微酸性的特点,设计智能响应探针用于癌症治疗.由于肿瘤微酸性环境(pH为5.0~7.4)低于PANI掺杂要求的pH值(pH<3.0),限制了PANI在癌症治疗中光热治疗和光声成像的应用.JU等[28]合成了金/聚苯胺核壳纳米材料(Au@PANI),基于Au到PANI的电荷转移以及PANI掺杂过程诱导的电子传递效率的提高,Au@PANI在pH=6.5时即可实现掺杂,显示出优异的光热效应.但金离子在体内具有长期毒性,对人体会造成很大的危害.为提高智能治疗剂的治疗性能,如图5所示,LI等[29]采用牛血清白蛋白(BSA)包覆PANI,设计了BSA-PANI纳米粒子,可以实现肿瘤内源性触发的诊断和治疗,光热转换效率达到37%,且纳米粒子具有很好的生物相容性,降低体内毒性.
3 結论与展望
本文概述了PANI纳米复合材料的制备、表面修饰及其在生物医学应用上的巨大潜力.基于PANI在NIR有优良的光吸收物理特性,PANI纳米复合材料具有优异的光热治疗和光声成像效果,在临床上有很好的应用前景.但PANI纳米复合材料的生物应用发展仍处于早期阶段,一方面受制于肿瘤环境的特异性以及体外和体内效果出现的差异性,虽可以通过其他材料结合或修饰从而提高光热转化效率,但同时会对材料的生物相容性造成影响;另一方面PANI在体内难以生物降解,严重限制了其进一步的应用.因此,需通过构建更加合理的结构来解决这些具有挑战性的问题,随着科学研究的进一步发展,开发多功能的PANI纳米复合材料将在临床应用方面具有重大意义.
参考文献:
[1] MELAMED J R, EDELSTEIN R S, DAY E S. Elucidating the fundamental mechanisms of cell death triggered by photothermal therapy [J]. ACS Nano,2015,9(1):6-11.
[2] LI L, YANG Q, SHI L, et al. Novel phthalocyanine-based polymeric micelles with high near-infrared photothermal conversion efficiency under 808 nm laser irradiation for in vivo cancer therapy [J]. Journal of Materials Chemistry B,2019,7(14):2247-2251.
[3] LI S, WANG X, HU R, et al. Near-infrared (NIR)-absorbing conjugated polymer dots as highly effective photothermal materials for in vivo cancer therapy [J]. Chemistry of Materials,2016,28(23):8669-8675.
[4] YAO Y, ZHAO D, LI N, et al. Multifunctional Fe3O4@polydopamine@DNA-fueled molecular machine for magnetically targeted intracellular Zn2+ imaging and fluorescence/MRI guided photodynamic-photothermal therapy [J]. Analytical Chemistry,2019,91(12):7850-7857.
[5] YANG J, CHOI J, BANG D, et al. Convertible organic nanoparticles for near-infrared photothermal ablation of cancer cells [J]. Angewandte Chemie International Edition,2011,50(2):441-444.
[6] HE W, ZHAO Y, XIONG Y. Bilayer polyaniline-WO3 thin-film sensors sensitive to NO2 [J]. ACS Omega,2020,5(17):9744-9751.
[7] LIU S, WANG L, ZHANG M, et al. Tumor Microenvironment-responsive nanoshuttles with sodium citrate modification for hierarchical targeting and improved tumor theranostics [J]. ACS Applied Materials and Interfaces,2019,11(29):25730-25739.
[8] HUANG J, WANG Z, HOU M, et al. Polyaniline-intercalated manganese dioxide nanolayers as a high-performance cathode material for an aqueous zinc-ion battery [J]. Nature Communications,2018,9(1):2906.
[9] MONDAL S, RANA U, DAS P, et al. Network of polyaniline nanotubes for wastewater treatment and oil/water separation [J]. ACS Applied Polymer Materials,2019,1(7):1624-1633.
[10] TAVANO R, GABRIELLI L, LUBIAN E, et al. C1 q-mediated complement activation and C3 opsonization trigger recognition of stealth poly(2-methyl-2-oxazoline)-coated silica nanoparticles by human phagocytes [J]. ACS Nano, 2018,12(6):5834-5847.
[11] ZOU Y, ITO S, YOSHINO F, et al. Polyglycerol grafting shields nanoparticles from protein corona formation to avoid macrophage uptake [J]. ACS Nano,2020,14(6):7216-7226.
[12] MISHRA P, NAYAK B, DEY R K. PEGylation in anti-cancer therapy:an overview [J]. Asian Journal of Pharmaceutical Sciences,2016,11(3):337-348.
[13] WANG L, VIVEK R, WU W, et al. Fabrication of stable and well-dispersed polyaniline-polypyrrolidone nanocomposite for effective photothermal therapy [J]. ACS Biomaterials Science and Engineering,2018,4(5):1880-1890.
[14] YANG Y, ZHANG Y M, CHEN Y, et al. Targeted polysaccharide nanoparticle for adamplatin prodrug delivery [J]. Journal of Medicinal Chemistry,2013,56(23):9725-9736.
[15] JIANG B P, ZHANG L, ZHU Y, et al. Water-soluble hyaluronic acid-hybridized polyaniline nanoparticles for effectively targeted photothermal therapy [J]. Journal of Materials Chemistry B,2015,3(18):3767-3776.
[16] WANG J, GUO F, YU M, et al. Rapamycin/DiR loaded lipid-polyaniline nanoparticles for dual-modal imaging guided enhanced photothermal and antiangiogenic combination therapy [J]. Journal of Controlled Release,2016:23723-23734.
[17] WANG C, XU L, LIANG C, et al. Immunological responses triggered by photothermal therapy with carbon nanotubes in combination with anti-CTLA-4 therapy to inhibit cancer metastasis [J]. Advanced Materials,2014,26(48):8154-8162.
[18] SONG X R, WANG X, YU S X, et al. Co9Se8 nanoplates as a new theranostic platform for photoacoustic/magnetic resonance dual-modal-imaging-guided chemo-photothermal combination therapy [J]. Advanced Materials,2015,27(21):3285-3291.
[19] SUN X, SUN J, LYU J, et al. Ce6-C6-TPZ co-loaded albumin nanoparticles for synergistic combined PDT-chemotherapy of cancer [J]. Journal of Materials Chemistry B,2019,7(38):5797-5807.
[20] LO P C, RODRÍGUEZ-MORGADE M S, PANDEY R K, et al. The unique features and promises of phthalocyanines as advanced photosensitisers for photodynamic therapy of cancer [J]. Chemical Society Reviews,2020,49(4):1041-1056.
[21] TAN X, WANG J, PANG X, et al. Indocyanine green-loaded silver nanoparticle@polyaniline core/shell theranostic nanocomposites for photoacoustic/near-infrared fluorescence imaging-guided and single-light-triggered photothermal and photodynamic therapy [J]. ACS Applied Materials and Interfaces,2016,8(51):34991-35003.
[22] LIU C, GUO X, RUAN C, et al. An injectable thermosensitive photothermal-network hydrogel for near-infrared-triggered drug delivery and synergistic photothermal-chemotherapy[J]. Acta Biomaterialia,2019,96:96281-96294.
[23] SILVA J S F, SILVA J Y R, DE S G F, et al. Multifunctional system polyaniline-decorated ZIF-8 nanoparticles as a new chemo-photothermal platform for cancer therapy [J]. ACS Omega,2018,3(9):12147-12157.
[24] XIA B, WANG B, SHI J, et al. Photothermal and biodegradable polyaniline/porous silicon hybrid nanocomposites as drug carriers for combined chemo-photothermal therapy of cancer [J]. Acta Biomater,2017,51:51197-51208.
[25] LI J, XIAO H, YOON S J, et al. Functional photoacoustic imaging of gastric acid secretion using pH-responsive polyaniline nanoprobes [J]. Small,2016,12(34):4690-4696.
[26] MA G, GAO X, JIANG C, et al. pH-responsive nanoprobe for in vivo photoacoustic imaging of gastric acid [J]. Analytical Chemistry,2019,91(21):13570-13575.
[27] WANG J, TAN X, PANG X, et al. MoS2 quantum dot@polyaniline inorganic-organic nanohybrids for in vivo dual-modal imaging guided synergistic photothermal/radiation therapy [J]. ACS Applied Materials and Interfaces,2016,8(37):24331-24338.
[28] JU E, DONG K, LIU Z, et al. Tumor microenvironment activated photothermal strategy for precisely controlled ablation of solid tumors upon NIR Irradiation [J]. Advanced Functional Materials,2015,25(10):1574-1580.
[29] TIAN Q, LI Y, JIANG S, et al. Tumor pH-Responsive Albumin/Polyaniline assemblies for amplified photoacoustic Imaging and augmented photothermal therapy [J]. Small,2019,15(42):1902926.
(責任编辑:郁慧,冯珍珍)
