血管平滑肌细胞泡沫化进程差异LncRNA 的筛选与分析
2021-01-06习黄方舟
黄 艳 冯 习黄方舟 胡 亮
湖南省长沙市第四医院急诊科,湖南长沙 410006
动脉粥样硬化(atherosclerosis,AS)是冠心病、急性心肌梗死等疾病发生发展的病理基础,约70%的急性冠状动脉事件是由易损斑块所致[1]。近年来,各种高危因素导致急性心肌梗死等心血管疾病的发病率越来越高,发病年龄越来越年轻化,AS 的相关研究也成为当前研究热点。研究表明,血管壁内多种细胞在刺激因素的作用下引起的功能失调或激活是粥样斑块的病理基础[2],如激活的血管平滑肌细胞(VSMCs)对粥样斑块的形成和稳定性有重要作用[3]。因此,深入研究影响AS 斑块稳定性的因素及其机制,寻找稳定斑块、预防斑块破裂的策略和方法,通过早期诊断和积极有效地干预,对降低AS 相关疾病的致残致死率有至关重要的研究意义。
长链非编码RNA(long nocoding RNAs,LncRNAs)是一类长度大于200 个核苷酸、缺少蛋白质编码功能的长链非编码RNA,在发现之初被当做是基因组内的“噪音”[4]。研究发现人体内存在众多的LncRNA与心血管系统疾病的发生发展密切相关[5]。利用转录组测序技术(RNA-seq)对组织或细胞中提取的全部RNA 进行测序,进而获取组织或细胞在某一特定状态下基因表达转录本的全面信息[6],从中筛选对AS 病情进展有预示作用的LncRNA 作为疾病标志物[7],可为深入研究LncRNA在AS 病情进展中的功能和作用机制提供线索[8]。目前已经发现的与AS 相关的LncRNA包括RAPIA[9]、NORAD[10]、TUG1[11]、ANRIL[12]等。
鉴于VSMCs 与LncRNAs 对于AS 的重要意义[13],寻找VSMCs 泡沫化进程差异表达LncRNA,能为研究AS 相关疾病的发生发展提供重要线索。但是目前的研究大部分还是处于起步阶段,本研究对VSMC 沫化进程中差异LncRNAs 进行筛选,并对其功能进行了分析和讨论。
1 材料与方法
1.1 实验细胞及分组
家兔VSMC:细胞来源于湘雅细胞库;实验组细胞:经氧化低密度脂蛋白(ox-LDL)处理24 h,浓度为80 μg/mL;对照组细胞未经ox-LDL 刺激。实验组编码为OX1、OX2、OX3、OX4,对照组编码为:C1、C2、C3、C4。
1.2 方法与步骤
1.2.1 VSMC 的培养、冻存与复苏
从液氮罐中取出冻存的细胞,迅速放入37℃恒温水浴箱中,并不时地摇动冻存管,加快其融解。1000 r/min,r=13.5 cm,离心5 min,弃除上清。加入新鲜RPMI-1640 完全培养基(加10%胎牛血清)重悬细胞,转移至25 mL 的培养瓶培养,做好标记。细胞培养的条件为95%的空气混合5%的二氧化碳,温度为37°C。据细胞生长情况,每天或者隔天更换新鲜培养基。以1∶2传代培养2~3 代后,将生长良好且存活率高的细胞适当冻存留种,以备后续实验补充需要,冻存方法如下:a.选择处于对数生长期的细胞,去细胞培养液,用0.25%胰蛋白酶消化;b.用吸管吸取培养液反复吹打瓶壁上的细胞,使其成为均匀分散的细胞悬液,将细胞收集于离心管中离心(1000 r/min,r=13.5 cm,10 min)。c.去上清液,加20%小牛血清的完全培养基,4℃预冷15 min,逐滴加入无菌甘油,用吸管轻轻吹打使细胞均匀。d.分装于安瓿中,火焰喷灯上封口。记录日期、细胞种类、冻存数量。e.装入布袋;置于液氮罐颈口处存放过夜,次日转入液氮中。
1.2.2 实验组处理及油红O 染色
实验组细胞处理:浓度为80 μg/ml ox-LDL 刺激24 h(oxLDL 购自北京索莱宝科技有限公司,货号:H7950)。油红O 染色:收集两组细胞,PBS 离心洗涤2 次,70%乙醇固定细胞20 min,制备细胞铺片,PBS洗3 次,油红O 染色20 min,蒸馏水冲洗,苏木精染色20 s,氨水分色30 s,自来水洗返蓝,PVP 封片,显微镜下观察摄片。
1.2.3 RNA 的提取与质量分析
(1)收集生长良好的VSMC,1000 r/min,r=13.5 cm,离心5 min。
(2)Trizol 法提取RNA。①将实验组和对照组每管加入500 μL 的TRIzol,然后漩涡震荡30 s,室温静置10 min,以致核酸蛋白复合物完全分离开。②在4℃条件下,12 000 r/min(r=13.5 cm)离心15 min,取上清液,然后转入另一批新高压灭菌离心管内。每管加入200 μL 氯仿,上下颠倒15 s,室温静置7 min。③在4℃条件下,12 000 r/min(r=13.5 cm)离心15 min,样品被分为3 层(RNA 大部分溶解在上层的水相当中),将上层水相转移到新的离心管中。④向离心管中加入500 μL 异丙醇,上下颠倒15 s,室温静置7 min。在4℃条件下12 000 r/min(r=13.5 cm)离心15 min,弃上清,见RNA 沉于管底。⑤向管中加即时配置的75%乙醇500 μL,上下颠倒15 s,在4℃条件下12 000 r/min(r=13.5 cm)离心10 min,弃上清。⑥向管中加入新配置的75%乙醇500 μL,上下颠倒15 s,在4℃条件下12 000 r/min(r=13.5 cm)离心8 min,弃上清。⑦在4℃条件下8000 r/min(r=13.5 cm)离心2 min,用小Tip头吸除剩余的水分,室温静置7 min,使乙醇挥发。⑧向沉淀的RNA 中加40 μL 0.1% DEPC,接着放入65℃水浴箱中水浴5 min 以溶解RNA。⑨Nanodrop 检测提取的RNA 的浓度和纯度(OD260/280比值)。
从样本中提取高质量的RNA 后,寄往北京诺禾致源生物信息科技有限公司进行LncRNA 测序分析。
1.2.4 高通量测序(RNA-seq)
选取8 个样品寄往北京诺禾致源生物信息科技有限公司进行基因测序;测序流程大致为样品检测、rRNA 去除、双链cDNA 合成、末端修复、加测序接头、片段选择、降解cDNA 第二链、PCR 富集、文库质检、上机测序。
1.2.5 差异表达LncRNA 筛选及靶基因预测
1.2.5.1 候选LncRNA 筛选 基本筛选、编码潜能筛选基本筛选:step 1:对所有样品拼接得到的转录本使用cuffcompare 软件进行合并,选择同时被两种拼接软件拼接到,或者同时出现在至少两个样品中的转录本;step 2: 选择转录本长度≥200 bp,Exon 个数≥2 个的转录本;step 3: 通过cufflinks 计算每条转录本的reads 覆盖度,选择覆盖度≥3 的转录本;step 4:通过cuffcompare 软件,将前一步得到的转录本与已知LncRNA 进行比较,得到与已知LncRNA 相同的转录本。step 5:利用cuffcompare 分析结果中的class_code信息筛选候选LncRNA 转录本。
编码潜能筛选:具有编码潜能与否是判断转录本是否为LncRNA 的关键条件,使用CPC 分析、CNCI分析、pfam 蛋白结构域分析和PhyloCSF 分析结果的交集作为本研究分析预测得到的LncRNA 数据集。
1.2.5.2 靶基因预测 预测原理:cis 作用靶基因预测基本原理是LncRNA 的功能与其坐标临近的蛋白编码基因相关,筛选LncRNA 临近位置的(上下游100 kb)蛋白编码基因作为其靶基因。trans 作用靶基因预测基本原理是LncRNA 的功能不依赖于和编码基因的位置关系,而与其共表达的蛋白编码基因相关。可以通过样本间LncRNA 与蛋白编码基因的表达量相关性分析或共表达分析方法来预测其靶基因。
1.2.6 差异表达LncRNA 靶基因富集与功能预测
1.2.6.1 KEGG 与GO 富集分析 Gene Ontology 是基因功能国际标准分类体系。根据实验目的筛选特异基因后,研究这些基因在Gene Ontology 中的分布状况将阐明实验中样本差异在基因功能上的体现。
KEGG 是有关Pathway 的主要公共数据库。在生物体内,不同基因相互协调行使其生物学功能,通过Pathway 显著性富集能确定特异基因参与的最主要生化代谢途径和信号转导途径。
1.2.6.2 malacard 数据整理 在malacard 数据库查找动脉粥样硬化相关疾病,例如冠心病等。查找排列前20 位的AS 相关疾病的靶基因,数量总计1944 个。统计高通测序结果中反式作用靶基因,共计56 458 个。将上述两个表格中的数据在Excel 表格中利用重复项筛选工具进行筛选,共计重复靶基因数量为143 个,这些靶基因即为测序结果中可能与AS 相关的靶基因。
1.2.7 人同源LncRNA 比对与筛选
①28 个差异表达的LncRNA 中筛选出7 个显著上调LncRNA 和5 个显著下调LncRNA;筛选标准为:log2(foldchange)绝对值>1,P <0.05。
②通过ensembl 数据库中Blat Tool 对12 个差异表达显著的LncRNA 进行同源性对比参数设置方法:输入LncRNA 序列,参考数据库选择非编码RNA 数据库,比对物种为人,搜索敏感度选择远系同源,Evalue 值选择1e-4,比对长度>100 bp,选取同源性较好的LncRNA。
2 结果
2.1 油红O 染色
显微镜下实验组细胞内观察到大量红色脂滴,对照组未发现明显红色脂滴,提示ox-LDL 孵育有效。染色结果见图1(封四)。

2.2 RNA 质检及测序原始数据质量评价
Nanodrop 检测RNA 的浓度和纯度 (OD260/280比值)。经Nanodrop 检测RNA 的浓度达1000 ng/μL 以上,OD260/280比值在1.90~2.00 之间。
Agilent 2100 检测结果如表1 所示;高通量测序数据质量评估如表2 所示(委托京诺禾致源生物信息科技有限公司完成)。

表1 Agilent 2100 检测结果
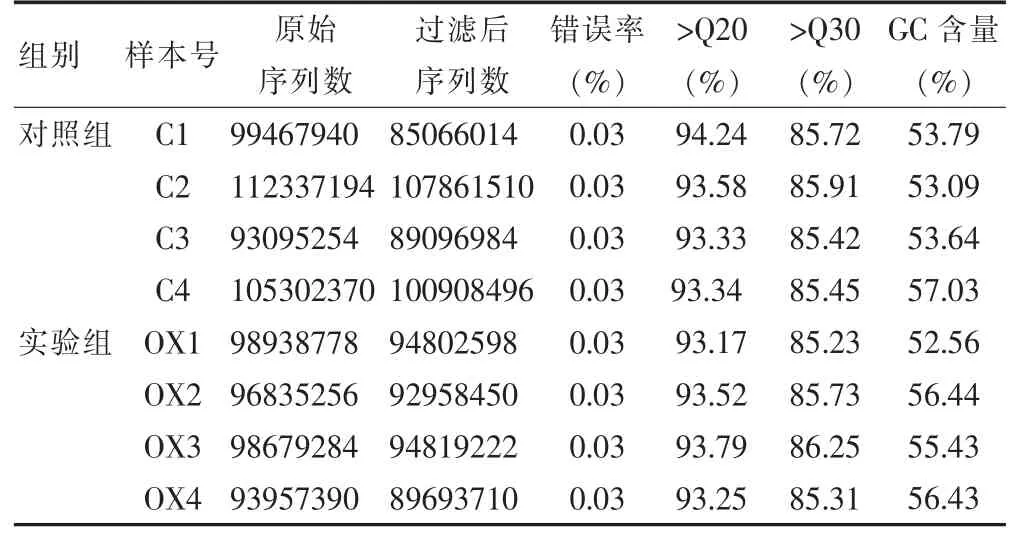
表2 测序质量评估统计
2.3 差异表达LncRNA 筛选及靶基因预测结果
基本筛选:通过方法中描述的5 个步骤,每个步骤根据要求保留符合要求的转录本,最后保留3629 个转录本。见图2。

图2 基本筛选结果展示图(横坐标5 个步骤见详见方法)
编码潜能筛选:具有编码潜能与否是判断转录本是否为LncRNA 的关键条件,通过CPC 分析、CNCI分析、pfam 蛋白结构域分析和PhyloCSF 分析分别得到各自保留的转录本,然后通过区交集区域共获得2037 个无编码潜能差异转录本。见图3。

图3 编码潜能筛选结果维恩图
筛选结果如下:①差异转录本共计506 个,部分数据见表2;其中LncRNA 转录本28 个,novel 转录本30,mRNA 转录本448 个。②448 个mRNA 转录本来自446 个编码基因,绝大部分由已知编码基因生产。③28 个LncRNA 转录本来自28 个编码基因,编码基因均未知。④30 个novel 转录本来自30 个编码基因。⑤3 种转录本的编码基因没有交集。
统计学筛选:筛选标准为log2(fold change)绝对值>1,P <0.05。能满足P <0.05 的转录本数目为28 个,同时满足两个条件的为12 个。实验组与对照组比较,其中7 个为表达显著上调的转录本,5 个为表达显著下调的转录本。见表3。
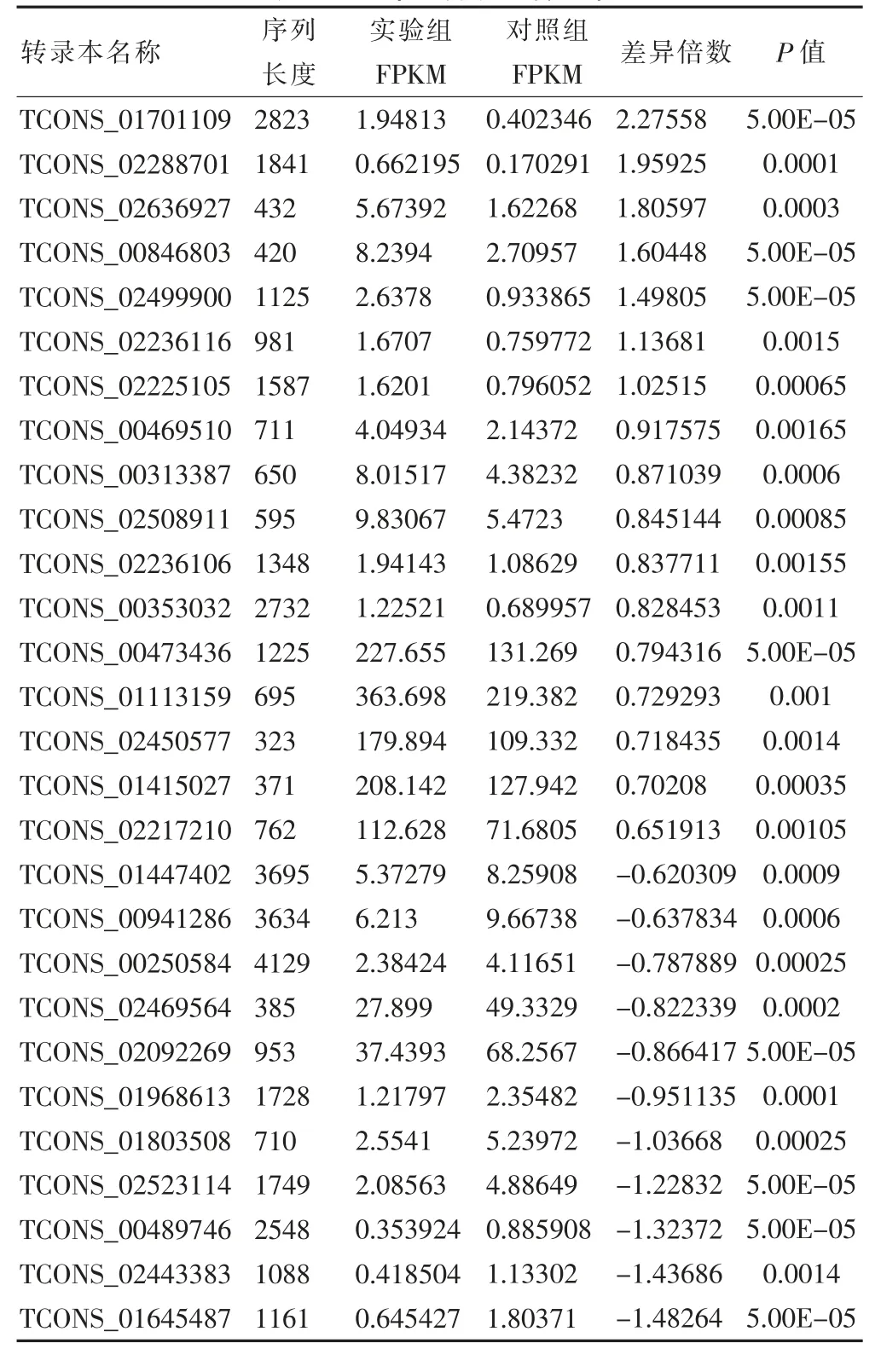
表3 28 个差异表达转录本
2.4 差异表达LncRNA 靶基因富集结果
2.4.1 功能预测
对差异表达转录本靶基因KEGG 富集分析得到如下结果,Trans 靶基因的KEGG 的聚类结果显示236 条靶基因富集到的通路中,其中Steroid biosynthesis、Selenocompoundmetabolism、Fattyacidmetabolism、HIF-1 signaling pathway、Glycolysis/Gluconeogenesis 等信号通路出现了富集差异,主要涉及细胞内脂类代谢、合成以及低氧应激等活性。见图4(封四)。

差异表达基因GO 富集分析如图5(封四)显示,Trans 作用涉及到10 867 个靶基因。富集term 中处理组与对照组在response to stress、cell death、death、pro grammed cell death、apoptotic process、intracellular 等细胞功能相关的靶基因上出现显著富集差异。其他term 主要涉及细胞内代谢合成等相关基因。

2.4.2 Malacard 数据整理
对高通量测序的LncRNA 转录本进行靶基因预测,共得到56 458 个靶基因。在malacard 数据库中以AS 关联的20 种临床疾病(心肌梗死、颈动脉闭塞、缺血性心脏病、冠心病等)为关键词进行搜索,共得到1944 个AS 相关基因,通过Venn 图计算获取预测靶基因与malacard 中收录AS 相关基因的交集,其中143 个基因为本次高通量测序结果中LncRNA 对应的靶基因。见图6。
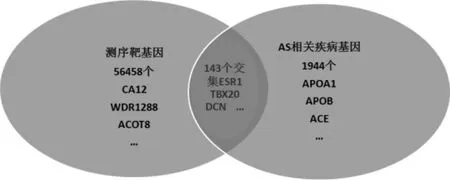
图6 malacard 靶基因预测维恩图
AS 相关疾病关联基因的交集结果:GATA4、ANXA5、SOD1、FGB、ITGAM、F7、ABCG8、HFE、PLAT、APOA4、FGA、ANKRD1、PCSK9、PTGS1、CA3、CXCL11、AGTR2、APOA5、ACTA2、EDN1、PAPPA、ACVRL1、PPARG、MGP、HMGCR、GCLM、PGF、HIF1A、PPIG、MKKS、FGF2、LRP6、ANGPT1、CHD7、BMPR2、SETD2、LMNA、MMP2、ADRB1、NOS3、HMOX1、OLR1、PON2、PALLD、HAND2、CKM、CXCL10、CAT、ADRB2、FN1、CA4、PTPN11、ADIPOQ、FABP3、VEGFA、GP1BA、TTN、CCT7、RYR2、F5、ACTC1、NPPC、SERPINC1、PLA2G7、WRN、CAMK2G、HTR2A、ABCA1、VCAM1、TNNT2、F11、NKX2-6、ADAMTS18、DSCAM、POSTN、LTA、PSEN1、CCL5、CASP3、APOB、PDE5A、NOS2、CCL2、SELE、SCN5A、TBX20、ESR1、SORT1、PPARD、ICAM1、DCN、CDH5、MTRR、SERPINE1、SELL、PHACTR1、PIK3C2A、NAMPT、GCLC、CSF1、CST3、SERPINF2、F3、IRAK4、GUCY1A3、TGFB1、LIPC、CD14、HP、MEF2A、GJA1、DSG2、MSR1、GATA6、PSMA6、TAZ、BGN、COG2、ADAMTS13、APOH、LRP8、PROCR、MMP1、NPY、PON1、LPL、IL10、SETD1A、CIITA、CXCR4、IL6、SLC39A2、MME、NR3C2、CEL、PIGL、ADD1、SELP、APOA2、ADM、MAP2、TIMP1。
2.5 人同源LncRNA 比对与筛选结果
通过ensemble 数据库分别对12 个差异表达显著的LncRNA 进行同源性对比,排除没有比对结果的LncRNA,选取同源性较好的6 个LncRNA(ID 值>80%)。见表4。
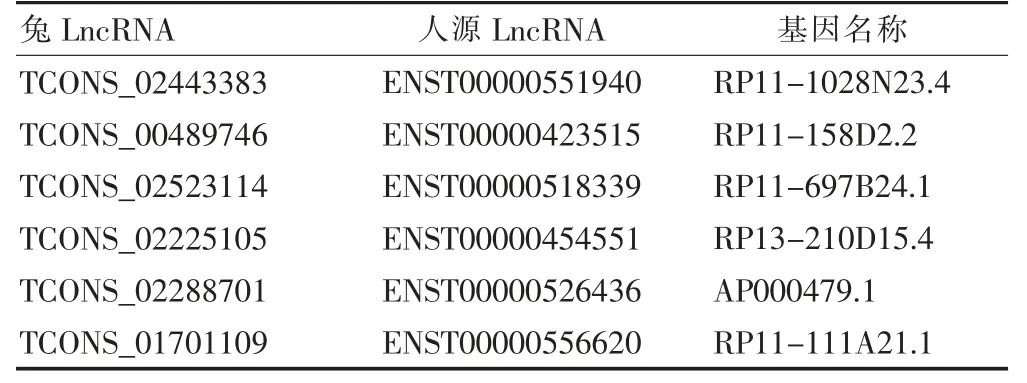
表4 人同源LncRNA 比对与筛选结果
3 讨论
本研究收集泡沫化进程的VSMC,经过RNA 测序获得原始序列数据、通过生物信息学分析及统计学分析得到28 个差异显著的转录本,本其中LncRNA全部为首次报道的新转录本。通过对28 条差异表达LncRNA 转录本进行功能注释和数据库联合分析,发现这些LncRNA 与AS 疾病存在密切关系。
AS 是最常见的心脑血管系统疾病之一。根据世界卫生组织WHO 调查数据,每年全世界有800~1000 万人因动脉硬化所引起的急性心脑血管疾病死亡,AS已成为影响全人类健康的头号杀手[14]。AS 的主要病理变化是以动脉管壁脂质沉积、内膜增生、炎性浸润和粥样斑块形成及钙化为主[15-16]。在构成血管壁的多种细胞中,VSMCs 的增殖和迁移在AS 的发展中起着重要作用[17],是引起血管损伤和再狭窄的一个关键因素。AS 发展之初,VSMCs 从收缩型变为合成型,且迁移到血管内膜,从而导致内膜增生[18]。研究结果显示,ox-LDL 能通过上调骨桥蛋白(osteopontin,OPN)表达量来影响VSMCs 的增殖和迁移,并表现为剂量依赖性[19]。在AS 形成过程中,VSMCs 受ox-LDL 刺激由收缩型转化为合成型[20-21],并向血管中膜迁移,在增殖的过程中分泌细胞外基质并聚集在病灶部位,从而致使血管内膜上纤维帽形成。这种由ox-LDL 介导的VSMCs 增殖、迁移、凋亡等一系列细胞活动能够促进粥样斑块的形成与发展,与AS 相关的血管病理改变密切相关[23]。
因此,研究VSMCs 在致病因素刺激下细胞状态、细胞活动以及相应细胞成分的改变对于揭示AS 发生发展,以及为AS 寻找新的治疗和检测靶点具有重要意义。以RNA-seq 技术为代表的二代测序技术已成为基因表达和转录组分析的常用研究手段[24],近两年三代全长转录组测序也已经开始应用在转录水平的测序任务,但目前无论实验成本和样本质量要求都还无法达到快速普及的目的[25]。RNA-seq 技术能够对绝大多数物种的整体转录活动进行检测,通过将组织或细胞中总RNA 反转录为cDNA 进行文库构建再进行测序,统计所有转录本的reads 数来计算出不同RNA转录本的表达量。在获得转录本的序列特征和表达水平的同时,还能发掘新转录本和稀有转录本,识别可变剪切位点及序列的单核酸多态性(single nucleotide polymorphism,SNP),在转录水平为研究者提供全面的参考信息[26]。
Malacard 为人类疾病基因数据库,广泛收录了大量来自实验和预测得到的人类基因信息。本研究中,靶基因预测结果与malacard 收录基因合并分析结果表明,筛选得到的LncRNA 转录本与AS 存在密切关系。同时,进一步检索143 个靶基因所对应的疾病种类,主要包括病理性肥胖、心肌梗死、颈动脉闭塞、先天性心脏病、颈动脉疾病、缺血性心脏病、流行性乙型脑炎、角膜内皮炎、冠心病等,这些疾病都是心脑血管疾病或者与AS 相关的疾病,进一步证明本研究中实验组所采用的ox-LDL 处理方法和引起VSMCs 在LncRNA 表达水平上发生改变,提示这种变化可能与AS 的发生发展具有相关性。
本研究中筛选得到的差异表达LncRNA28 个,其中显著表达差异者12 个,GO 和KEGG 数据库聚类分析结果显示差异表达LncRNA 对应的靶基因广泛涉及脂类代谢、合成,细胞凋亡、程序性死亡等生物学过程,这些过程都对AS 的发生发展都有重要作用。通过对ox-LDL 刺激的VSMC 测序分析得到28 个差异表达LncRNA,反式作用KEGG 富集分析得到3 个AS 相关通路:萜类化合物支架生物合成、类固醇生物合成、糖酵解和糖质新生。他们从分子功能、细胞成分及各类生物学过程均有富集。针对筛选出的差异LncRNAs,通过同源对比得到人源差异转录本及LncRNA信息,为下一步实验继续研究其功能与作用机制,将可能为预防AS 的发生和控制相关疾病的进展提供新的靶点。
