甲醇制乙烯和二甲醚反应机理研讨
2021-01-05贺振富
贺振富
(国家能源集团公司,北京 100011)
乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位,是衡量一个国家石油化工发展水平的重要标志之一。2018年世界新增乙烯产能8.31 Mt/a,总产能达177 Mt/a,与上年相比增长5.3%,预计2019年世界新增乙烯产能8 Mt/a,总产能将达到185 Mt/a,新增产能主要来自美国和中国。2019年中国预计新增乙烯产能3.78 Mt/a,到2023年,中国煤制烯烃和甲醇制烯烃增加的乙烯产能将超过10 Mt/a。二甲醚(DME)是清洁燃料和重要化工原料,被认为是仅次于氢的清洁能源,具有广阔应用前景[1]。甲醇制乙烯、二甲醚新技术是保障原料供应、经济稳定的重大技术进步。因此,深入研究其反应机理具有重要意义。
甲醇制烯烃(MTO)反应机理可分为串联型机理和并联型机理两大类。串联型机理认为,甲醇首先生成乙烯,但在SAPO-34上发生的MTO反应初期通常是丙烯含量高于乙烯[2]。代表性并联型机理之一是“烃池”机理[3-4],其强调B酸中心在MTO反应过程中的作用[5-6],认为甲醇首先在催化剂上形成相对分子质量较大的烃类物质,并吸附在催化剂孔道内作为活性中心,不断与甲醇反应引入甲基,同时脱烷基化生成乙烯和丙烯等低碳烯烃分子。严志敏[7]认为,B酸中心在MTO反应过程中参与了中间物种生成,但并未对其作用机理进一步说明。碳烯离子机理[2]指出,在沸石催化剂酸、碱中心的协调作用下,甲醇脱水得到碳烯(CH2),然后碳烯聚合或碳烯sp3轨道插入甲醇或二甲醚分子轨道中即可形成烯烃。Stöcker[8]认为MTO反应分3步:(1)在分子筛表面生成甲氧基;(2)生成第1个C-C键;(3)生成C3=、C4=。Li等[9]在MTO反应过程中观察到七甲基苯基碳正离子(heptaMB+)中间体和其去质子化产物(HMMC),验证了该中间体在甲醇转化生成烯烃途径中的重要作用。
Wu等[10-11]研究了甲醇在SAPO-34上转化反应的反应路径,认为在烯烃生成过程中,催化剂表面甲氧基/三甲基氧离子与二甲醚(DME)/甲醇协同活化转化,初始C-C键是由表面C1反应物、DME/甲醇和表面甲氧基物种(SMS)直接反应形成,一旦形成初始烯烃,它们将转化为大分子烃。唐宏青[12]认为,甲醇先脱水生成DME,DME与甲醇平衡混合物脱水继续转化为乙烯、丙烯为主的低碳烯烃,并可能进一步发生环化、脱氢、氢转移、缩合、烷基化等反应。Ono和Mori[13]认为,表面甲氧基起着自由甲基阳离子的作用,插入到DME的C-H键中形成五价的过渡态碳正离子,脱去H+后经β-消除反应生成乙烯和甲醇。Catizzone等[14-15]认为,在酸催化下,甲醇脱水反应复杂,涉及多个反应,产物组分多样,包括氢气、甲烷及烯烃类、芳烃类等。Haw等[16]考虑了催化剂酸强度、酸中心密度等因素,将MTO过程分为5步:(1)甲醇、DME和水快速达到平衡;(2)新鲜催化剂动力学诱导期;(3)碳氢化合物生成;(4)碳氢化合物进一步生成烯烃;(5)催化剂积炭失活。
对于甲醇制DME反应,Forester等[17]认为,甲醇在酸中心首先生成甲氧基,然后与另外一分子甲醇反应生成DME。Mirth等[18]和Wang等[19]与其观点相一致。Blaszkowski等[20]通过密度函数理论研究提出了两种DME可能生成途径:(1)两分子甲醇同时在沸石活性位吸附,然后生成DME和水;(2)两分子甲醇同时在沸石活性位吸附,其中一分子甲醇脱氢生成甲氧基,然后与另一分子甲醇反应得到DME。Frusteri等[21]认为,硅/铝比变化对催化剂酸性影响较为明显,在甲醇制二甲醚(MTD)反应中,随着MFI沸石分子筛硅/铝比降低,酸量增多,甲醇生成DME转化率提高。Yang等[22]认为,调变了催化剂弱酸/强酸的比值,利于DME生成和扩散。王艳等[23]认为,沸石分子筛和SAPO分子筛具有强酸性、低温高活性,利于MTD反应。Highfield等[24]利用光声红外光谱法研究了甲醇在12-磷钨酸上于25~150 ℃脱水机理,提出12-磷钨酸上的B酸是甲醇转化为DME的主要因素,考虑了催化剂酸性在甲醇脱水制DME过程中的作用。肖文德等[25]以HZSM-5为催化剂研究甲醇脱水合成DME反应,认为甲醇在酸的作用下转化为中间体CH3OH2+诱导C-O键断裂,进而CH3+进攻CH3OH中的O原子生成DME。
上述报道未就反应物分子与催化剂活性中心之间相互作用进行深入讨论,笔者尝试利用杂化轨道理论分析含Si、Al元素催化剂活性中心Al原子外层电子轨道结构与反应物甲醇分子中C、H和O原子间相互作用,探讨甲醇制乙烯和二甲醚的反应机理。
1 4配位B酸中心[26-27]
图1为硅铝催化剂4配位B酸中心的失活与再生过程。4配位B酸中心是由1个Al原子、4个O原子和1个H原子组成,见图1(a)。4配位B酸中心可释放1个H+离子,释放H+离子后失去了活性,失活的4配位B酸中心AlO4-结构如图1(b)所示。
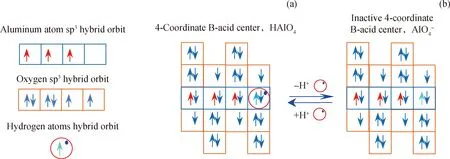
图1 4配位B酸中心失活与再生过程Fig.1 Inactivation and regeneration of 4-coordinate B-acid center(a) 4-Coordinate B-acid center; (b) Inactive 4-coordinate B-acid center
2 反应机理分析
甲醇分子在SAPO-34或ZSM-5分子筛上反应生成乙烯、二甲醚,是B酸中心作用下的酸催化反应,反应方程式如下:
2CH3OH→C2H4+2H2O
(1)
2CH3OH→CH3OCH3+H2O
(2)
笔者前期研究认为,SAPO-34或ZSM-5等分子筛是含Si、Al元素的固体酸催化剂,其催化活性来源于其酸性。催化剂酸性与Al原子的O原子配位数密切相关:2、3配位的Al原子形成L酸中心;4、5或6配位的Al原子形成B酸中心;Al原子是产生活性的中心原子。
2.1 甲基碳正离子CH3+生成
图2是甲醇在B酸中心作用下生成甲基碳正离子(CH3+)过程分析。图2(a)是甲醇分子轨道结构图;B酸中心释放H+离子攻击甲醇分子C-O键,形成H、C和O原子共用1对电子结构,见图2(b)。根据元素周期表,H、C和O原子电负性为2.20、2.55和3.44。图2(b)中,H+攻击甲醇分子C-O键,C-O键断裂有2种可能性,如果H+和含C原子基团结合会生成CH4,如果H+和含O原子基团结合会生成H2O。由于O原子电负性3.44大于C原子的电负性2.55,所以含O原子基团会吸引共用电子对并与H+结合生成H2O,如图2(c);而含C原子基团生成了甲基碳正离子CH3+,在CH3+中C原子外层有个空轨道,如图2(d)。
2.2 CH3+生成中间体 C↑↓〇H2
图3为CH3+与失活B酸中心作用生成中间体H-form C↑↓〇H2过程。由图3可知,CH3+空轨道(图3(a))吸附在失活B酸中心Al、O原子共用电子对处形成图3(b)结构,然后CH3+中H+转移到相邻Al、O和C原子重叠轨道上形成图3(c)结构。已知C、H、O和Al原子电负性分别为2.55、2.20、3.44和1.61,图3(c)中Al、O和C三原子共用1对 e-,O原子电负性3.44大于C原子电负性2.55,所以O原子吸引共用e-对并与同一结构中的Al、H原子共用,形成图3(d)所示的HAlO4结构,使失活4配位B酸中心恢复活性,结构如图3(d);而CH3+失去H+后生成中间体H-form C↑↓〇H2。C↑↓〇H2中C原子外层有1对孤对电子和1个空轨道,↑↓代表孤对电子,〇代表空轨道,如图3(e)。
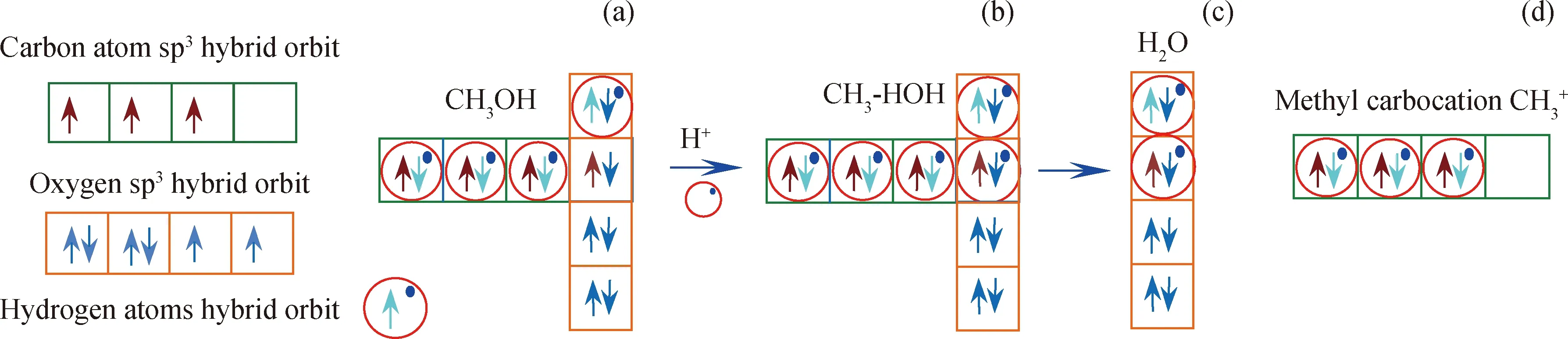
图2 H+攻击甲醇分子C-O键生成甲基碳正离子CH3+Fig.2 Hydrogen proton attack C-O bond in methanol molecule to form methyl carbocation CH3+(a) Methanlo molecule; (b) CH3-HOH; (c) Water molecule; (d) CH3+
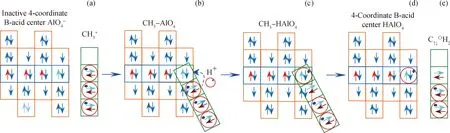
图3 CH3+与失活B酸中心作用生成H-form C↑↓〇H2Fig.3 Formation of H-form C↑↓〇H2 by CH3+ interacting with inactive B-acid center (a) CH3+; (b) CH3-AlO4; (c) CH3-HAlO4; (d) 4-Coordinate B-acid center; (e) H-form
2.3 C↑↓〇H2生成乙烯
2个C↑↓OH2结构C原子,如图4(a),1个C原子上孤对电子相互占据另1个C原子上空轨道,2个C原子共用2对电子,形成C=C键,即生成乙烯CH2=CH2,如图4(b)。
2.4 C↑↓〇H2生成二甲醚
2个C↑↓〇H2结构C原子和1个H2O分子,如图5(a),2个C原子空轨道分别与H2O分子中2个H、O原子重叠轨道再次重叠,形成C、H和O原子轨道重叠且共用2对电子结构,即2个C↑↓〇H2和1个H2O分子生成二甲醚CH3-O-CH3结构,如图5(b)。
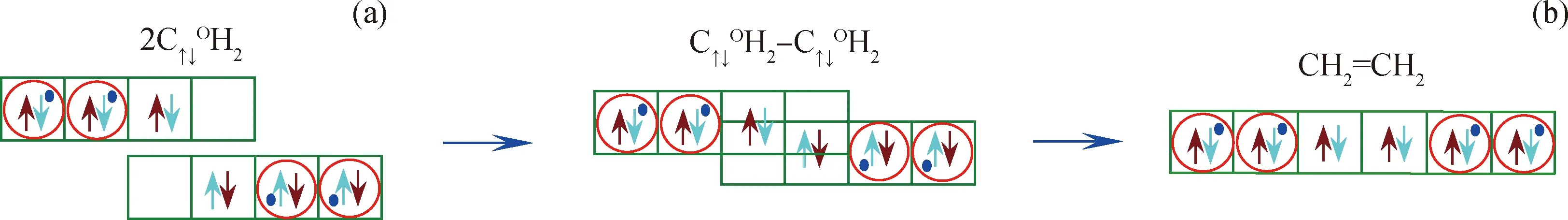
图4 2个 C↑↓〇H2生成C2H4Fig.4 Two C↑↓〇H2 form ethylene(a) C↑↓〇H2; (b) C2H4

图5 C↑↓〇H2和H2O生成二甲醚Fig.5 C↑↓〇H2 and H2O produce dimethyl ether(a) C↑↓〇H2 and H2O; (b) Dimethyl ether
2.5 反应机理
根据上面分析,甲醇在4配位B酸中心HAlO4作用下生成乙烯和二甲醚反应机理如下:
第1步
CH3OH+HAlO4→CH3++AlO4-+H2O
(3)
第2步
CH3++AlO4-→HAlO4+C↑↓〇H2
(4)
第3步
2C↑↓〇H2→CH2=CH2
(5)
2C↑↓〇H2+H2O→CH3-O-CH3
(6)
反应方程(3)×2+(4)×2+(5)相加得反应方程(1),生成乙烯;反应方程(3)×2+(4)×2+(6)得反应方程(2),生成二甲醚。上述分析探讨了甲醇分子在4配位B酸中心HAlO4作用下生成乙烯和二甲醚的反应机理。可以看出,无论在4配位B酸中心、还是5配位或者6配位B酸中心,甲醇反应制乙烯和二甲醚反应机理相同。
3 结 论
甲醇在B酸中心作用下反应生成乙烯和二甲醚机理分3步:
(1)B酸中心释放H+离子攻击甲醇分子中 C-O 键,C-O键断裂生成甲基碳正离子CH3+和H2O,B酸中心失活,CH3+结构中碳原子外层有个空轨道;
(2)失活B酸中心从CH3+处抽取H+离子恢复活性,CH3+失去H+离子反应生成中间体 C↑↓〇H2,C↑↓〇H2结构C原子中有1对孤对电子和1个空轨道;
(3)2个 C↑↓〇H2结构C原子,1个C原子上的孤对电子相互占据另1个C原子上空轨道,2个C原子共用2对电子形成C=C键,即生成乙烯CH2=CH2;2个C↑↓〇H2结构中C原子空轨道分别与H2O分子中2个H原子、O原子的重叠轨道再次重叠共用1对电子,反应生成二甲醚。
