低温溶液法制备TiO2/γ-AlO(OH)纳米复合粉体及其光催化性能
2021-01-05王飞鸿潘昆明朱鹏飞徐流杰朱宏喜
王飞鸿, 潘昆明, 朱鹏飞, 徐流杰, 赵 阳, 朱宏喜
(1.河南科技大学 材料科学与工程学院,河南 洛阳 471000;2.河南科技大学 金属材料磨损控制与成型技术国家地方联合工程研究中心,河南 洛阳 471000)
全球能源危机日益加重,由此引发的环境污染问题也不容忽视。储存太阳能及降解有机污染物,是克服当前全球能源危机和环境问题的重要途径,被科学界广泛关注[1-3]。
光触媒材料在污水治理过程中表现突出,在众多光触媒材料中TiO2以其优异的催化性、化学和光稳定性、亲水性及合适的带隙等被广泛认可。然而,作为n型宽带隙半导体,TiO2具有间接激发特性,量子产率较低,光吸收带相对有限,电子迁移率低,制备过程需要高温烧结,在降解芳香烃化合物时易催化失活。因此,对TiO2的改性研究从未间断过,包括形貌控制、结构纳米化、半导体掺杂、贵金属沉积、二次半导体耦合、表面超酸化[4]、敏化[5]等,使得TiO2具有更宽的光谱吸收带和更高的化学稳定性。近年来,多孔γ-Al2O3已被用作与TiO2复合改性的载体材料[6-9]。言文远等[10]利用分步水热的方法使氧化石墨烯与TiO2形成复合粉体,并在第一步水热过程中通过调节HF的浓度制备出具有高活性的(001)和(101)晶面的纳米TiO2。徐彬等[11]采用溶胶-凝胶法和逐层自组装技术制备了TiO2/γ-Al2O3复合粒子,以降解苯酚,解决了纯TiO2芳烃化合物降解的失活问题。韩易潼等[12]采用液相共沉淀法制备多孔TiO2/γ-Al2O3,证实γ-Al2O3的存在可以有效降低TiO2的晶体转变温度,提高TiO2的热稳定性。γ-AlO(OH)作为γ-Al2O3的前驱体,因其不需高温退火处理,开始被研究应用于催化剂载体领域。de Silva等[13]证明γ-AlO(OH)在TiO2光催化分解制氢方面具有积极影响。Gnanasekaran等[14]制备出具有包覆结构的γ-AlO(OH)-NiWO4复合粉体,对降解甲基蓝染剂具有较高的催化活性。目前广泛使用的二氧化钛系催化剂的制备方法包括水热法、溶胶-凝胶法、化学气相沉积法等[15-17]。这些方法存在实验过程复杂、多数需要高温退火、能源消耗较大等不足。
笔者采用低温溶液法制备TiO2/γ-AlO(OH)复合纳米粉体,对TiO2/γ-AlO(OH)纳米粉末的形貌、结构和组成进行了表征,探究了热处理条件、γ-AlO(OH)掺杂量、水热温度和时间、PVP表面活性剂用量等对TiO2/γ-AlO(OH)纳米材料光催化活性的影响。
1 实验部分
1.1 原料与试剂
硝酸铝 (Al(NO3)3·9H2O)、柠檬酸三铵(C6H5O7(NH4)3)、钛酸四丁酯(Ti(C4H9O)4、无水乙醇、聚乙烯吡咯烷(PVP),均为分析纯,国药集团化学试剂有限公司产品;蒸馏水为实验室自产;罗丹明B(10-5mol/L,RhB),天津市大茂化学试剂厂产品;P25(70%质量分数锐钛矿+30%质量分数金红石),麦克林公司产品。
1.2 TiO2/γ-AlO(OH)纳米复合粉体制备
取2 mmol硝酸铝加入20 mL蒸馏水中,形成均匀溶液,然后依次加入20 mL无水乙醇和 0.5 mmol 柠檬酸三铵并继续搅拌至柠檬酸三铵完全溶解。将所得溶液转置于水热釜中,装釜后放入干燥箱内,200 ℃水热反应24 h。自然冷却至室温,分别使用蒸馏水、无水乙醇在真空抽滤过程中对滤渣各洗涤3次,并在60 ℃下真空干燥12 h,研磨过筛,得到球形多孔纳米γ-AlO(OH)粉体[17]。
取20 mL钛酸四丁酯加入64 mL无水乙醇中,搅拌均匀后加入0或0.1 mmol PVP,再加入质量分数分别为0、5%、10%、20%和30%的球形多孔纳米γ-AlO(OH)粉体,继续搅拌,同时逐滴滴加 5 mL 蒸馏水,制得乳白色絮状反应液原料,将反应液原料转置于100 mL水热合成反应釜(上海旭日生物科技有限公司产品)内衬中,填充度80%,装釜后放入干燥箱内,180 ℃进行水热反应2 h,自然冷却至室温。将所得产物装入离心机在8000 r/min离心8 min,分别用蒸馏水和无水乙醇洗涤数次,将产物在90 ℃真空干燥10 h。研磨过筛后制得纳米TiO2/γ-AlO(OH)复合粉体,分别命名为TiO2/xγ-AlO(OH)或TiO2/xγ-AlO(OH)(0.1 mmol)(掺杂0.1 mmol PVP),其中x为γ-AlO(OH)的质量分数,x为5%、10%、20%或30%。当γ-AlO(OH)添加质量分数为0时,制得纯锐钛矿型的TiO2。将制备好的纳米TiO2/γ-AlO(OH)复合粉体进行性能检测后,对性能最佳的粉体样品进行退火实验,分别在500 ℃和700 ℃下退火2 h,观察其形貌及性能变化。
1.3 TiO2/γ-AlO(OH)纳米复合粉体催化性能评价
用罗丹明B作为有机污染物的替代物测试制得催化剂的光催化性质,并将P25作为对照组实验。将50 mg TiO2/γ-AlO(OH)纳米复合粉体加入到 100 mL 10-5mol/L 的罗丹明B溶液中,在暗光搅拌1 h达到吸附平衡,排除吸附和自降解对实验的影响。之后移入光照系统,300 W氙灯作为光源,每15 min对实验溶液进行一次吸光度检测,从而计算出溶液的质量浓度。
一定质量浓度范围内,罗丹明B溶液质量浓度和其吸光度之间遵循朗伯-比尔定律,见式(1)。
C=A/EL
(1)
式中,C是溶质的质量浓度,g/L;A是吸光度;E是吸收系数,L/(g·cm);L是光透过液体层的厚度,cm。在实验过程中吸收系数E和光穿过液层厚度L不变化,因此吸光度A可以按比例表征罗丹明B溶液的质量浓度C。
实验中罗丹明B的降解率(η,%)计算公式见式(2)。
η=(1-C/C0)×100%
(2)
式中,C0为罗丹明B溶液的初始质量浓度,g/L;C为暗光处理后的罗丹明B浓度以及每光照15 min后罗丹明B的质量浓度,g/L。
1.4 TiO2/γ-AlO(OH)纳米复合粉体的表征
采用FESEM电镜JSM-7800F(日本电子株式会社产品)和FEI F300高分辨透射电子显微镜(美国FEI公司产品)拍摄得到样品的FESEM、HRTEM照片和EDS谱图。使用X射线衍射仪D8 Advance E型(德国布鲁克公司产品)分析样品的XRD。使用紫外可见分光光度计UV-2600(岛津仪器(苏州)有限公司产品)测得样品的紫外-可见漫反射光谱(UV-Vis DRS),进一步研究样品光学特征。使用Gemini II 2370表面积分析仪(美国麦克仪器公司产品)测定TiO2/γ-AlO(OH)复合粉末的BET比表面积、孔径、孔体积。
2 结果与讨论
2.1 TiO2/γ-AlO(OH)复合粉体物性表征
2.1.1 微观组织结构分析
图1为TiO2/γ-AlO(OH)复合纳米粉体的形貌和TiO2/10%γ-AlO(OH) (0.1 mmol PVP)的EDS谱图。从图1(a)可以看出,低温溶液法制备的γ-AlO(OH) 颗粒细小并含有介孔结构,介孔结构可以提供比较良好的吸附能力和附着点;图1(b)为纯TiO2粉体,球形度较好,但颗粒较大,颗粒尺寸均大于500 nm,比表面积较低;TiO2为表面催化剂,颗粒尺寸过大则催化活性位点会相应降低。由图1(c)~(f)可以较明显地看出,γ-AlO(OH)的质量分数越大,样品颗粒团聚越明显,γ-AlO(OH)的质量分数在30%左右时有明显硬团聚产生,不利于催化反应的进行;在γ-AlO(OH)掺杂质量分数在5%和10%时可以观察到γ-AlO(OH)表面附着有很多细小的TiO2颗粒。由图1(g)和(h)可以观察到,TiO2/10%γ-AlO(OH)(0.1 mmol PVP)表面被PVP活化后,TiO2与γ-Al2O3形成对齐结构,但表面较为蓬松。通过晶格条纹分析可知γ-AlO(OH)被TiO2包覆。通过图1(j)的EDS图谱可知,图1(i)中较大颗粒为γ-AlO(OH),有较高的Al、O的峰值;外层较小的球形颗粒为TiO2,具有较为明显的Ti、O峰,同时Al峰值明显下降。
2.1.2 XRD分析
图2为TiO2、纯P25、γ-AlO(OH)和掺杂PVP的TiO2/γ-AlO(OH)复合纳米粉体的XRD谱图。由图2可知,实验制备的γ-AlO(OH)晶型为勃姆体,与图1(h)中晶格条纹宽度对应。相比于P25(锐钛矿,金红石结构混合晶相)催化剂,经过PVP表面活化的TiO2/γ-AlO(OH)系列催化剂均具有较为明显的锐钛矿结构,同时半峰宽相对较大,说明复合粉体的颗粒更加细小;同时除了比较明显的TiO2衍射峰外,没有其他较为明显的峰,说明样品的纯度较高[18]。其中γ-AlO(OH)掺杂质量分数为10%的复合粉体的谱峰尖端较为平缓,半高宽较大,说明此时复合粉体中锐钛矿型的TiO2颗粒细小。这是因为此掺杂量下的γ-AlO(OH)在制备过程中提

图1 TiO2/γ-AlO(OH)复合纳米粉体的形貌和TiO2/10%γ-AlO(OH) (0.1 mmol PVP)的EDS谱图Fig.1 Morphology of TiO2/γ-AlO(OH) composite nano-powder and EDS spectra of TiO2/10%γ-AlO(OH) (0.1 mmol PVP)HRTEM images: (a) γ-AlO(OH); (g), (h) TiO2/10%γ-AlO(OH)(0.1 mmol PVP)The corresponding SEM micrographs of (b)-(f) and (i): (b)TiO2; (c) TiO2/5%γ-AlO(OH); (d) TiO2/10%γ-AlO(OH);(e) TiO2/20%γ-AlO(OH); (f) TiO2/30%γ-AlO(OH); (i) TiO2/10%γ-AlO(OH) (0.1 mmol PVP)Fig.1(j) is the EDS spectra of Fig.1(i).
供介孔,吸附较多的Ti(OH)4胶体在空腔中,水热反应时空腔的应力限制了TiO2颗粒的长大[19];当γ-AlO(OH)掺杂质量分数小于10%时,γ-AlO(OH)无法提供足够的空腔,掺杂质量分数大于20%时,γ-AlO(OH)的表面电荷又会吸附过多的TiO2颗粒,导致复合粉体发生硬团聚。众所周知,TiO2具有锐钛矿、板钛矿、金红石3种晶型,其中锐钛矿结构TiO2具有最佳的催化活性,然而纯锐钛矿结构的TiO2催化性能并不理想[20]。P25催化剂利用2种不同晶相的结构混杂可以增大晶格内部缺陷,增加载流子浓度,使电子、空穴数量增大,具有更强的捕获颗粒外表面溶剂的能力[21]。因此,采用纯锐钛矿晶型的TiO2,同时利用γ-AlO(OH)的多孔结构作为载体形成复合粉体,可使TiO2的催化性能增加成为可能。
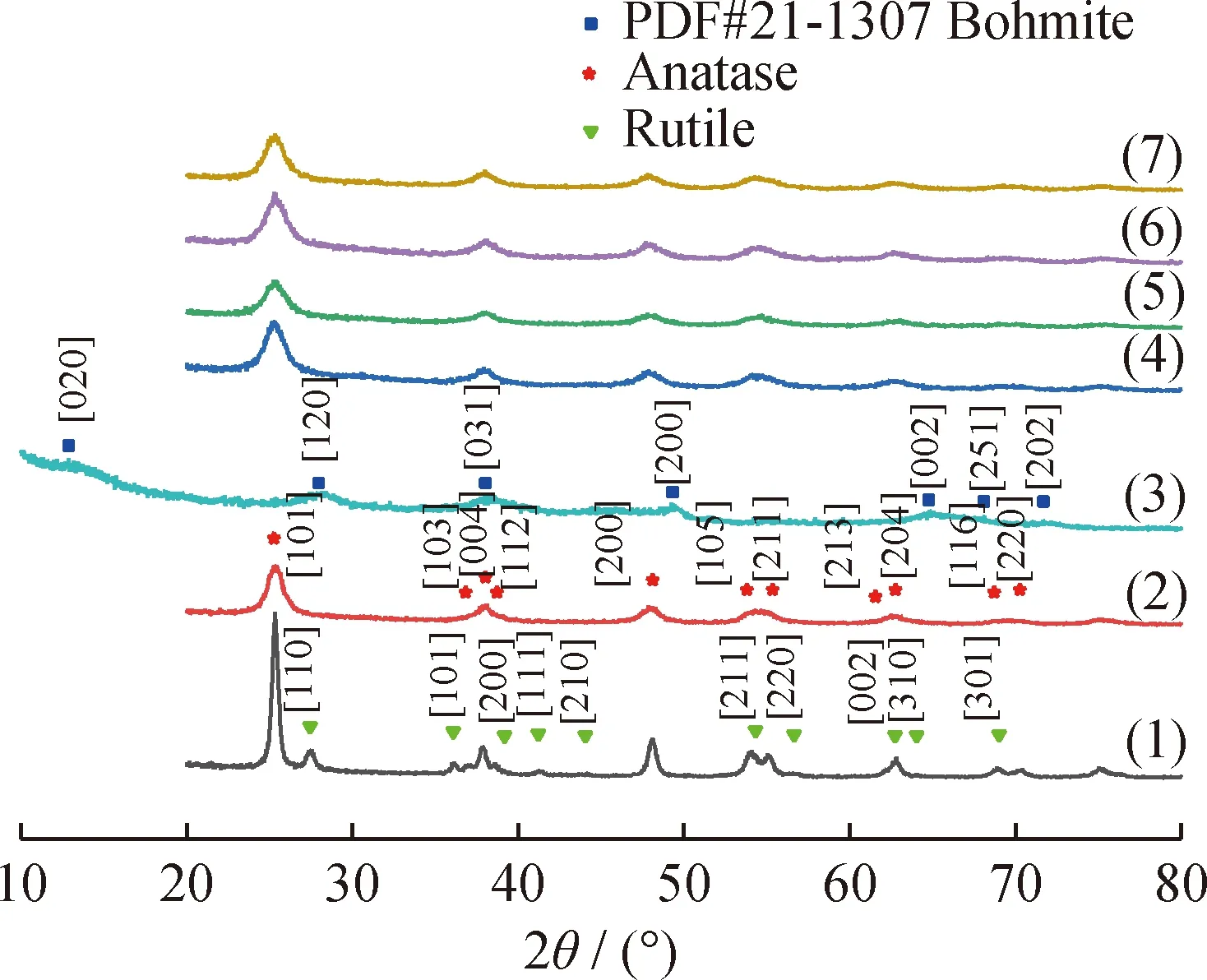
图2 TiO2、纯P25、γ-AlO(OH)和掺杂聚乙烯吡咯烷酮(PVP)的TiO2/γ-AlO(OH)复合纳米粉体的XRD谱图Fig.2 XRD patterns of TiO2, pure P25, γ-AlO(OH) andTiO2/γ -AlO(OH) composite nano-powder with adding PVP(1) P25; (2) TiO2; (3) γ-AlO(OH);(4) TiO2/5%γ-AlO(OH) (0.1 mmol PVP);(5) TiO2/10%γ-AlO(OH) (0.1 mmol PVP);(6) TiO2/20%γ-AlO(OH) (0.1 mmol PVP);(7) TiO2/30%γ-AlO(OH) (0.1 mmol PVP)
2.1.3 退火实验数据分析
图3为在不同温度下退火后,样品TiO2/10%γ-AlO(OH) (0.1 mmol PVP)的XRD谱图和相应的SEM显微图片。一般情况下,金属氧化物的制备温度越高,氧化物的结晶度越高[19]。由图3(a)可以看出,退火后的复合粉体结晶度明显升高,但其半峰宽也随之减小,并且在700 ℃退火后开始出现了金红石结构的[110]峰。通过对比图3(b)和(c)可以看出,500 ℃退火后复合粉体颗粒为亚微米级,700 ℃退火后的复合粉体颗粒已经达到2~3 μm,复合粉体的颗粒明显变大,不利于催化反应的进行。
2.1.4 UV-Vis DRS分析
图4为P25和TiO2/γ-AlO(OH)复合粉体的UV-Vis DRS谱图。根据αhv=F(hv-Eg)n/2(其中α为吸收系数,F是比例常数,hv是光子能量,Eg为禁带宽度,直接半导体n取1,间接半导体n取4)可计算出复合材料的禁带宽度,商用P25的禁带宽度约为3.2 eV(385 nm)[22-23]。由图4可得,制备的TiO2/10%γ-AlO(OH)(0.1 mmol PVP)样品的禁带宽度为3.45 eV(359 nm)。这是因为TiO2/γ-AlO(OH)复合粉末的颗粒尺寸接近激子波尔半径,产生了量子尺寸效应。纳米尺寸半导体的电子带性能主要取决于颗粒的尺寸。随着复合粒子尺寸的减小,带隙能增加,表现为吸收波长的蓝移[24-25]。复合材料的禁带宽度增加,使其对太阳光辐射的吸收范围增大,更有利于电子跃迁的产生,同时更宽的禁带宽度可以有效地减少光生电子-空穴的复合,从而提高光催化剂的量子效率。
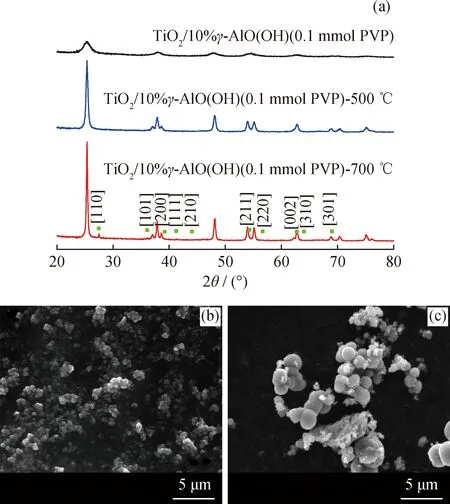
图3 在不同温度下退火后样品TiO2/10%γ-AlO(OH)(0.1 mmol PVP)的XRD谱图及相应的SEM显微照片Fig.3 XRD patterns of sample TiO2/10%γ-AlO(OH)(0.1 mmol PVP) after calcination at different temperaturesand their corresponding SEM micrographs(a) XRD patterns;SEM micrographs: (b) TiO2/10%γ -AlO(OH) (0.1 mmol PVP)-500 ℃;(c) TiO2/10%γ-AlO(OH) (0.1 mmol PVP)-700 ℃
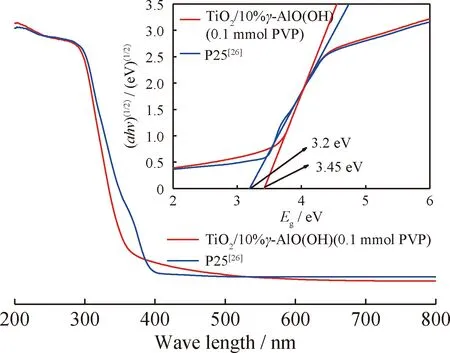
图4 P25和TiO2/γ-AlO(OH)复合粉体的UV-Vis DRS谱图(内附图为禁带宽度切线图)Fig.4 UV-Vis DRS profiles of P25 and TiO2/γ-AlO(OH)composite nano-powder (Inside drawing is tangentdiagram of the forbidden band width)
2.1.5 N2吸附-脱附分析
图5为TiO2/10%γ-AlO(OH)和TiO2/10%γ-AlO(OH) (0.1 mmol PVP)复合材料的N2吸附-脱附曲线和孔径分布曲线。由图5(a)看到,TiO2/10%γ-AlO(OH)的等温吸附-脱附曲线具有明显的滞后环,符合恒温吸附曲线的IV型,发生空心毛细管凝结,磁滞回线的形状符合H2b型,证明该材料是具有中孔(孔径大于2 nm、小于50 nm)的介孔材料。此时,N2从单层吸附到多层吸附在介孔材料内表面[26]。通过BET吸附等温方程计算[27]TiO2/10%γ-AlO(OH)的比表面积为143.92 m2/g。从图5(b)可知,TiO2/10%γ-AlO(OH)复合粉末具有较大的孔径分布,孔径尺寸不均匀,大部分为中孔,BJH平均孔径约为4.94 nm,与吸附曲线对孔径大小的初步判断一致。
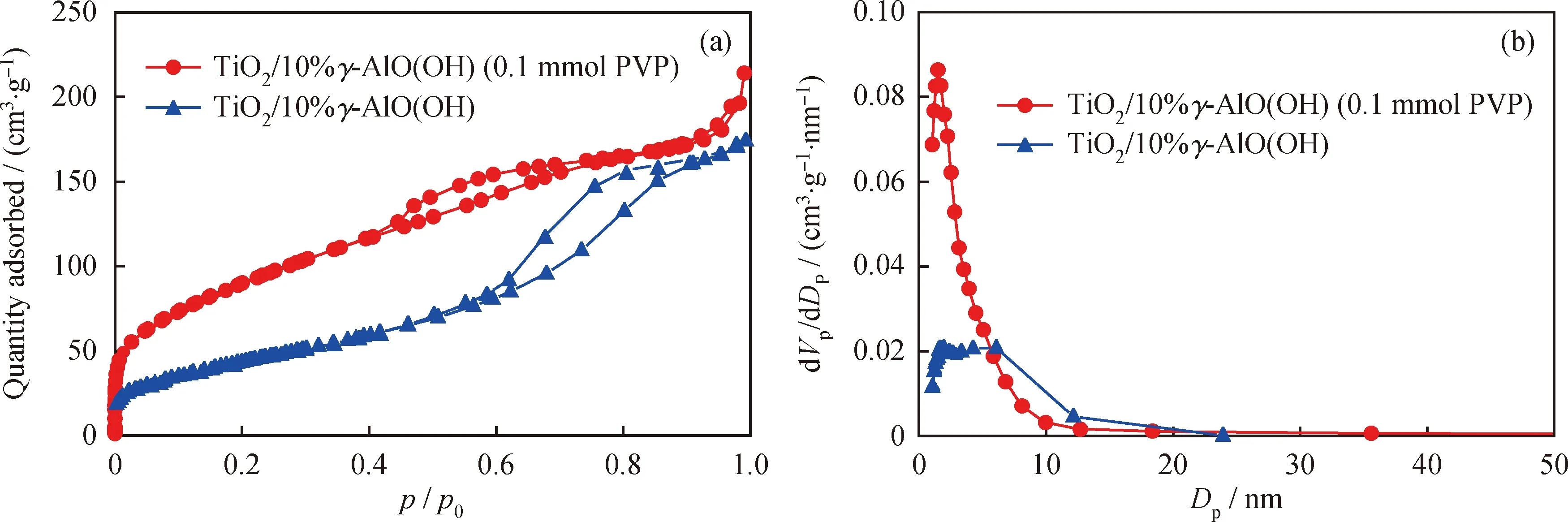
图5 TiO2/10%γ-AlO(OH)和TiO2/10%γ-AlO(OH) (0.1 mmol PVP)复合材料的N2吸附-脱附曲线和孔径分布曲线Fig.5 N2 adsorption-desorption isotherms and pore diameter distribution of TiO2/10%γ-AlO(OH) andTiO2/10%γ-AlO(OH) (0.1 mmol PVP) composite powder(a) N2 adsorption-desorption isotherms; (b) Pore diameter distribution
由图5(a)还看到,添加0.1 mmol PVP后的复合粉体的吸附曲线符合IV型等温曲线。等温曲线具有明显的磁滞回线,磁滞回线属于H4型磁滞回线。由于添加PVP后,复合材料在表面活性剂的作用下产生了絮状形貌(见图1(g)),复合材料的平均孔径减小为3.07 nm,并且孔径大小更加均匀,BET比表面积为334.27 m2/g。与未添加PVP的复合材料相比,添加PVP后的复合材料具有更大的比表面积,载体能够从溶液中吸附和保留大量的有机分子,为TiO2提供了高浓度的反应环境,增加光生空穴和自由基与有机分子的反应概率,从而可提高光催化效率。
2.2 TiO2/γ-AlO(OH)复合粉体的光催化性能
笔者使用罗丹明B溶液替代有机污染物进行光催化降解,结果如图6所示,每张图片虚线左侧Dark部分为催化剂在暗光搅拌条件下催化剂吸附作用导致的罗丹明B溶液浓度下降曲线,右侧Light部分为暗光处理后转移至模拟光源下进行催化降解实验的罗丹明B溶液的浓度变化曲线。暗光处理可以使催化剂吸附饱和,排除吸附作用对催化降解的干扰。图6(a)为γ-AlO(OH)添加质量分数对复合粉体催化效率的影响。可以看到,利用低温溶液法制备的TiO2和TiO2/γ-AlO(OH)复合粉体都具有优于商用P25的催化性能。在γ-AlO(OH)质量分数低于20%时,随着γ-AlO(OH)含量增大,罗丹明B的降解率逐渐增大,复合材料的催化性能逐渐增加;但超过20%时,罗丹明B降解率急剧下降。γ-AlO(OH)质量分数为5%和10%的复合粉体在降解后期(45 min左右)催化性能优于γ-AlO(OH)质量分数为20%的复合粉体,说明有机物低浓度时,具有孔隙结构的复合粉体仍具有较高的催化效率。
图6(b)为TiO2/10%γ-AlO(OH)添加PVP前后对复合粉体的催化效率的影响。可以看出,添加PVP后罗丹明B的降解率有较大的提高。这是因为PVP作为较好的表面活性剂和成型剂增大了复合粉体的比表面积,提高了其催化性能,与BET检测结果和HRTEM分析结果吻合。
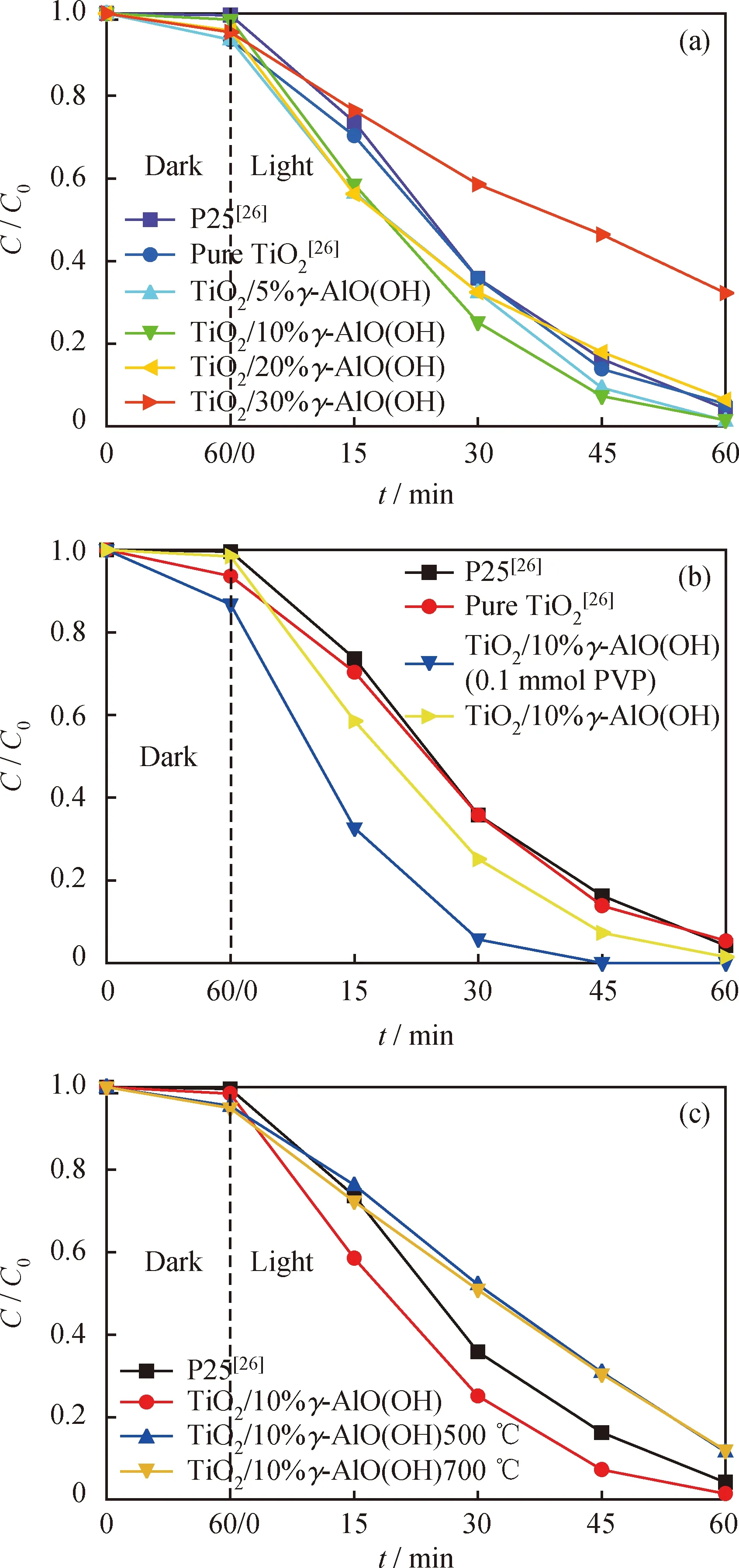
图6 TiO2/γ-AlO(OH)复合粉末光催化降解罗丹明B的动力学曲线Fig.6 Kinetic plots of photocatalytic degradation ofRhodamine B by TiO2/γ-AlO(OH) composite powdersm(Catalyst)=50 mg; V(RhB)=100 mL; C0(RhB)=10-5 mol/L;300 W xenon lamp as a light source(a) Effect of mass fractions of TiO2/γ-AlO(OH) compositepowders on catalytic activity;(b) Effect of adding PVP of TiO2/10%γ -AlO(OH) compositepowders on catalytic activity;(c) Effect of calcination temperatures of TiO2/10%γ-AlO(OH)composite powders on catalytic activity
图6(c)为TiO2/10%γ-AlO(OH)在不同温度下退火后的催化性能。可以看出,TiO2/10%γ-AlO(OH)在经过高温退火后,罗丹明B的降解率大幅度下降。这是因为γ-AlO(OH)在高温下失水形成γ-Al2O3,与TiO2颗粒形成新的复合结构,从而导致原有结构坍塌。众所周知TiO2催化性能与其颗粒尺寸密切相关[28],TiO2颗粒在高温下迅速长大导致催化性能迅速下降,从而导致退火后复合粉体催化性能下降。
综合对比后可以看出,TiO2/10%γ-AlO(OH)(0.1 mmol PVP)复合粉体的催化活性最佳,30 min时降解率就可达到94.26%。
3 结 论
(1)在乙醇溶液中低温水热合成TiO2/γ-AlO(OH)复合粉体。介孔γ-AlO(OH)在水热过程中既可以充当载体与生长平台,又可以增加材料的吸附性。加入表面活性剂聚乙烯吡咯烷酮(PVP)后可以使催化剂表面更加蓬松,有效增加复合粉体的比表面积。
(2)考察了介孔γ-AlO(OH)的掺杂量对复合粉体形成的影响,最佳γ-AlO(OH)质量分数为复合粉体的10%,此时形成的复合粉体颗粒尺寸细小,形貌均匀,比表面积最大。制备过程不使用高温退火,可有效减少能源消耗。
(3)在光降解过程中,TiO2/10%γ-AlO(OH)(0.1 mmol PVP)复合粉体具有均匀的介孔结构和高达334.27 m2/g的比表面积,更易产生光敏化效应,加速催化反应进行;在光照30 min时降解率就可达到94.26%,远高于商用P25和纯锐钛矿型的TiO2,具有较高的催化效率。
