以急性全自主神经功能障碍发病的自身免疫性自主神经病临床特点分析
2021-01-05李凡孟令超白静孙云闯李茹洁石昕郝洪军高枫贾志荣黄一宁袁云王朝霞
李凡 孟令超 白静 孙云闯 李茹洁 石昕 郝洪军 高枫 贾志荣 黄一宁 袁云 王朝霞
全自主神经功能障碍又称泛自主神经病,系指交感神经系统、副交感神经系统和自主神经系统广泛受累的一类疾病。导致全自主神经功能障碍的原因复杂多样,例如遗传性疾病、代谢性疾病、自身免疫性疾病、神经变性病等均为其诱发因素[1],尤以自身免疫性自主神经病最为常见,包括自身免疫性自主神经节病(AAG)、副肿瘤性自主神经病、急性自主感觉神经病(AASN)、吉兰⁃巴雷综合征(GBS)变异型、干燥综合征(SS)继发自主神经病等[2]。表现为全自主神经功能障碍的自身免疫性自主神经病发病率较低,常以晕厥、胃肠动力障碍、大小便障碍、排汗障碍等非感觉和运动症状首发,易误诊为心血管系统、消化系统或泌尿系统疾病而延误治疗,因此早期诊断、及时治疗具有重要临床意义。北京大学第一医院2016 年2 月至2019 年2 月共诊断与治疗3 例以急性全自主神经功能障碍发病的自身免疫性自主神经病患者,本文拟对其临床表现、实验室检查、电生理学检查、病理学检查、治疗和随访过程进行回顾分析,以为临床早期诊断与治疗积累经验。
临床资料
例1女性,34 岁。因呕吐伴腹泻3 周、发作性意识丧失伴感觉异常2 周,于2016 年2 月29 日入院。患者入院前3 周(2 月6 日)患“感冒”,体温约38℃,伴间断性呕吐和腹泻,1 周后(2 月14 日)症状自行缓解,“感冒”期间曾间断出现坐位起立时发作性黑蒙,以及双足麻木感;4 天后(2 月18 日)出现双眼闭合差,漱口时口角漏水,症状呈进行性加重,直立位频繁晕厥发作,外院急诊诊断为直立性低血压,经补液治疗(具体方案不详)后晕厥发作次数稍有减少。自诉发病以来出汗明显减少,伴口干、眼干、小便次数增加,但无排尿困难及尿失禁。既往史、个人史及家族史无特殊。入院后体格检查:卧位血压为124/80 mm Hg(1 mm Hg=0.133 kPa)、心率为70 次/min,直立位血压为69/44 mm Hg、心率为102 次/min。全身皮肤干燥,毛发分布正常,皮肤划痕试验阴性。神经系统查体:双眼闭合力弱,双侧鼓腮无力,味觉减退;双上肢对称性感觉过敏,尤以末端显著,双下肢膝关节以下可疑“袜套”样对称性浅感觉和痛温觉消失、音叉振动觉轻微减退,Romberg 征阳性,四肢肌力5 级、肌张力正常,四肢腱反射对称引出,双侧Kernig 征可疑阳性,Lasseque 征阳性。实验室检查:血常规、血液生化、抗核抗体(ANA)谱于正常水平;腰椎穿刺脑脊液压力正常,细胞总数1×106/L[正常参考值:(0 ~8)×106/L],白细胞计数为零[正常参考值:(0 ~5)×106/L],蛋白定量420 mg/L(正常参考值:150 ~450 mg/L);血清和脑脊液抗神经节苷脂抗体(AGA)谱(GM1、GM2、GM3、GD1a、GD1b、GQ1b)呈阴性。神经传导检测:左侧腓浅神经感觉神经传导速度(SNCV)为39 m/s(正常参考值:50 m/s)、波幅为4.80 mV(正常参考值:3 mV),右侧腓浅神经感觉神经传导速度为27.40 m/s,左侧和右侧胫后神经感觉神经传导均未引出;左侧腓总神经膝盖⁃腓骨小头下运动神经传导速度(MNCV)为67.50 m/s(正常参考值:40 m/s)、复合肌肉动作电位(CMAP)波幅为1.17 mV(正常参考值:4 mV),腓骨小头下⁃中踝运动神经传导速度为25.40 m/s、复合肌肉动作电位波幅1.26 mV,右侧腓总神经运动神经传导速度为28.90 m/s、复合肌肉动作电位波幅2.20 mV;左侧尺神经F 波传导速度正常;右侧胫神经H 反射潜伏期3.20 ms(正常参考值:1.80 ms)。自 主 神 经 功 能 试 验,Valsalva 率(即Valsalva 动作时最长R⁃R 间期/最短R⁃R 间期比值)1.18,深呼吸心率变异3 次/min,直立位/卧位心率比值1.33。直立倾斜试验提示直立性低血压伴心率代偿性增快。腓肠神经活检显示,神经束衣内有髓纤维轻度减少,较多有髓纤维Wallerian 变性,无髓纤维密度重度下降(图1)。临床诊断:吉兰⁃巴雷综合征变异型;急性全自主神经功能障碍。予甲泼尼龙1000 mg/d 静脉滴注冲击治疗3 天和静脉注射免疫球蛋白(IVIg)0.40 g/(kg·d)连续5 天,同时肌肉注射营养神经、止泻药物维生素B1100 mg/d 和甲钴胺0.50 mg/d 2 周,1 周后直立不耐受症状明显好转。患者共住院20 天,出院时偶有肢体发作性疼痛。出院后每年门诊随访,最近一次为出院后4 年(2020 年1 月)电话随访,随访期间未再发生晕厥、排尿困难、腹胀和腹泻,肢体感觉异常完全缓解。
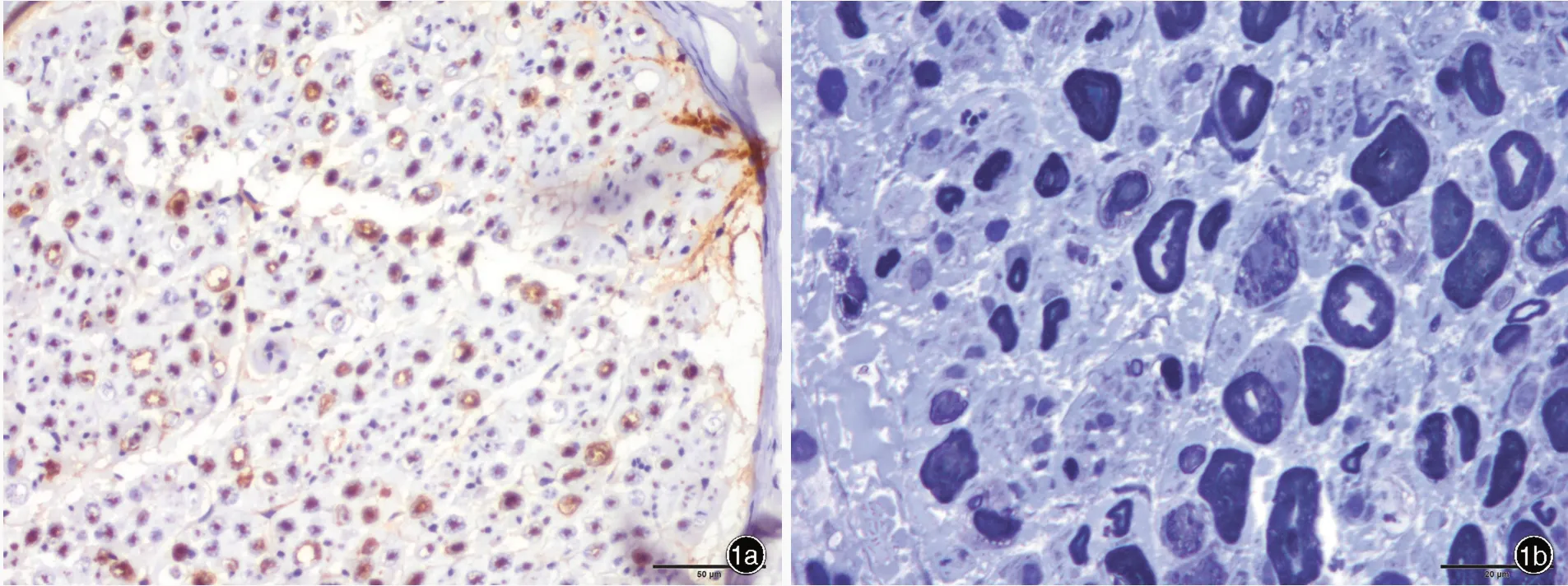

图1 例1 腓肠神经病理学检查所见 1a 光学显微镜下可见NF 染色阳性的大直径有髓纤维轻度减少、小直径有髓纤维密度重度下降 免疫组化染色(EnVision 二步法) ×200 1b 光学显微镜下可见大直径有髓纤维轻度减少,轴索变性,无髓纤维密度重度下降 半薄切片甲苯胺蓝染色 ×500 1c 透射电子显微镜下可见轴索变性 枸橼酸铅和醋酸铀双重染色 ×2000Figure 1 Neuropathological findings of sural nerve biopsy in Case 1 Optical microscopy showed the NF positive large myelinated fibers decreased slightly, while the NF positive small myelinated fibers decreased markedly (Panel 1a).Immunohistochemical staining (EnVision) × 200 Optical microscopy showed the large myelinated fibers decreased slightly,axonal degeneration, and the density of unmyelinated fibers decreased remarkably (Panel 1b). Toluidine blue staining ×500 Transmission electron microscopy showed axonal degeneration (Panel 1c). Uranyl acetate and lead citrate staining ×2000
例2女性,19 岁。因恶心、呕吐伴直立性头晕4 个月,于2018 年3 月28 日入院。患者入院前4 个月(2017 年12 月)无明显诱因出现频繁恶心、呕吐,多发生于进食后,伴腹胀,无明显腹痛、腹泻,外院急诊诊断为“酮症酸中毒,1 型糖尿病”,收入内分泌科,经降糖、纠正酮症、补液治疗(具体方案不详)后血糖降至<10 mmol/L,尿酮体转为阴性,但恶心、呕吐症状无明显缓解,并频繁发生直立位头晕、黑蒙,排尿性晕厥3 次。曾于外院行腰椎穿刺脑脊液检查,压力、常规、生化等项指标均于正常值范围。头部MRI 显示胼胝体压部异常信号影。肌电图提示周围感觉和运动神经传导速度中度减慢。腹部B 超显示,双肾积水,膀胱残留尿量约271 ml。自发病以来,始终有尿频、尿急和尿不尽感,皮肤干燥,出汗明显减少。入院后体格检查:神志清楚,体型消瘦,全身皮肤干燥;高级皮质功能未见明显异常,双侧瞳孔等大等圆,直径2 mm,对光反射欠灵敏;双侧深浅感觉正常,共济运动稳准,双上肢肌力5 级,双下肢近端肌力4 级、远端5 级,肌张力均正常,双侧腱反射未引出,双侧病理征阴性,脑膜刺激征阴性。实验室检查:血清抗核抗体谱均于正常值范围;血液和尿液免疫固定电泳呈阴性;腰椎穿刺脑脊液压力正常,白细胞计数为零,蛋白定量800 mg/L,可见蛋白⁃细胞分离现象;血清和脑脊液AGA 谱均于正常值范围。自主神经功能试验Valsalva 率1.01,深呼吸心率变异3 次/min,直立位/卧位心率比值1.08。直立倾斜试验提示直立性低血压伴心率失代偿。泌尿系统B 超显示,左肾增大,双肾积水,双侧输尿管扩张,慢性膀胱炎。腓肠神经活检可见大直径有髓纤维相对保留,个别再生簇,小直径有髓纤维和无髓纤维密度重度下降(图2)。临床诊断:吉兰⁃巴雷综合征变异型;急性全自主神经功能障碍。入院后即留置胃管、导尿管,肠外营养联合肠内营养,补液支持,纠正水电解质紊乱,抗真菌药物和抗生素治疗泌尿系统感染,以及静脉注射免疫球蛋白0.40 g/(kg·d)连续5 天,昂丹司琼8 mg/d 静脉注射止吐,盐酸米多君5 mg/次(3 次/d)口服治疗直立性低血压,1 周后头晕、呕吐和排尿困难等症状有所好转,但进食后腹胀仍较明显,共住院42 天,要求转回当地医院继续治疗。出院后1 年余(2020 年6 月)电话随访,获知患者已于2019 年9 月死于继发性肾功能衰竭和吸入性肺炎,家属诉其出院后2 个月恶心、呕吐症状加重,无法经口进食。

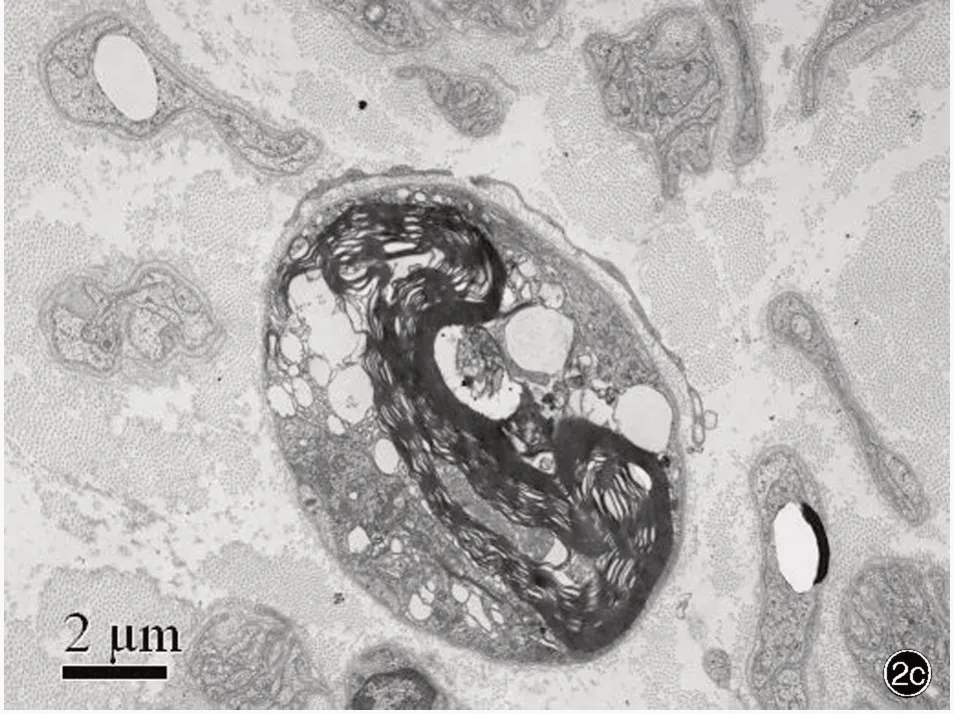
图2 例2 腓肠神经病理学检查所见 2a 光学显微镜下可见NF 染色阳性的大直径有髓纤维相对保留,小直径有髓纤维密度重度下降 免疫组化染色(EnVision 二步法) ×200 2b 光学显微镜下可见大直径有髓纤维相对保留,个别再生簇,小直径有髓纤维和无髓纤维密度重度下降 半薄切片甲苯胺蓝染色 ×500 2c 透射电子显微镜下可见轴索变性 枸橼酸铅和醋酸铀双重染色 ×5000Figure 2 Neuropathological findings of sural nerve biopsy in Case 2 Optical microscopy showed the NF positive large myelinated fibers were relatively spared, while the NF positive small myelinated fibers decreased markedly (Panel 2a).Immunohistochemical staining (EnVision) × 200 Optical microscopy showed the large myelinated fibers were relatively spared, while the axonal degeneration, and the density of small myelinated fibers and unmyelinated fibers decreased remarkably(Panel 2b). Toluidine blue staining × 500 Transmission electron microscopy showed axonal degeneration (Panel 2c).Uranyl acetate and lead citrate staining ×5000
例3女性,36 岁。因体位性头晕伴发作性意识障碍1 年余,于2019 年2 月11 日入院。患者入院前1 年因上呼吸道感染而诱发坐位⁃直立位头晕伴双眼视物不清,约1 个月后出现坐位⁃直立位短暂性意识丧失,伴恶心、呕吐、腹胀、食欲不振,以及间断性便秘和尿频、尿急。外院诊断为直立性低血压,予盐酸米多君5 mg/d 口服,辅助针灸治疗,2 个月后症状逐渐减轻,6 个月后仅遗留快速坐位⁃直立位头晕、长时间直立后黑蒙;病程中始终存在全身出汗减少。既往史、个人史及家族史无特殊。入院后体格检查:神志清楚,全身皮肤干燥,高级皮质功能未见明显异常;双侧瞳孔等大等圆,直径2 mm,对光反射迟钝;四肢深浅感觉正常,共济运动稳准,四肢肌力5 级、肌张力正常,双侧腱反射对称引出,双侧病理征阴性,脑膜刺激征阴性。实验室检查:血常规、血液生化、抗核抗体谱、血液和尿液免疫固定电泳均于正常值范围。神经传导检测:感觉神经和运动神经传导速度正常。自主神经功能试验Valsalva 率1.27,深呼吸心率变异14 次/min,直立位/卧位心率比值1.09。直立倾斜试验提示直立性低血压伴心率代偿性增快。腓肠神经活检可见大直径有髓纤维相对保留,小直径有髓纤维密度轻度下降,无髓纤维密度中度下降(图3)。临床诊断:急性全自主神经功能障碍恢复期;自身免疫性自主神经节病。继续口服盐酸米多君5 mg/d,住院10 天出院。出院后1 年余(2020 年6 月)电话随访,已停用盐酸米多君,体位改变时偶有头晕发作,未再发生晕厥。
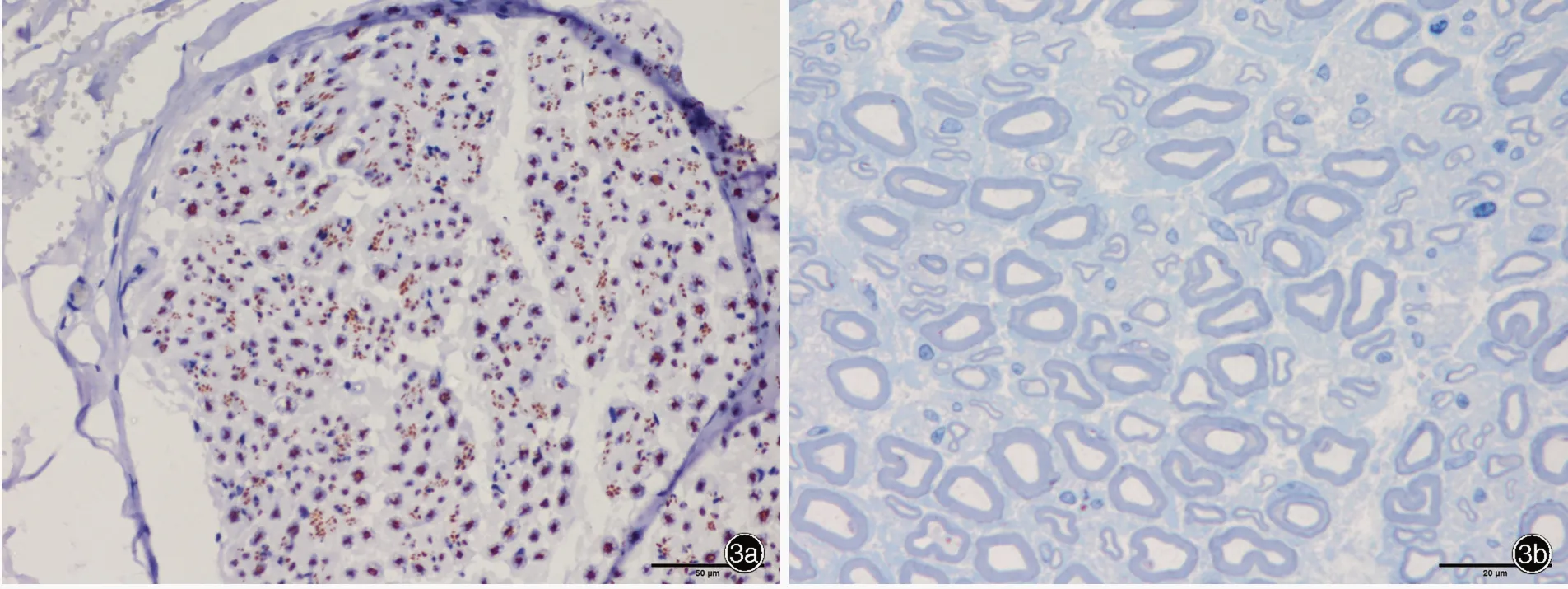

图3 例3 腓肠神经病理学检查所见 3a 光学显微镜下可见NF染色阳性的大直径有髓纤维相对保留,小直径有髓纤维密度轻至中度下降 免疫组化染色(EnVision 二步法) ×200 3b 光学显微镜下可见大直径有髓纤维相对保留,小直径有髓纤维密度轻度下降,无髓纤维密度中度下降 半薄切片甲苯胺蓝染色 ×500 3c 透射电子显微镜下可见胶原袋结构 枸橼酸铅和醋酸铀双重染色 ×10 000Figure 3 Neuropathological findings of sural nerve biopsy in Case 3 Optical microscopy showed the NF positive large myelinated fibers were relatively spared, the NF positive small myelinated fibers decreased mildly to moderately (Panel 3a).Immunohistochemical staining (EnVision) × 200 Optical microscopy showed the large myelinated fibers were relatively spared, while the density of small myelinated fibers decreased mildly and unmyelinated fibers decreased remarkably (Panel 3b).Toluidine blue staining × 500 Transmission electron microscopy showed collagen bag (Panel 3c). Uranyl acetate and lead citrate staining ×10 000
讨 论
本文报告3 例急性全自主神经功能障碍病例,其中2 例(例1、例2)诊断为吉兰⁃巴雷综合征变异型、急性全自主神经功能障碍,1 例(例3)为急性全自主神经功能障碍恢复期。结合笔者2018 年报告的1 例急性全自主神经功能障碍病例[3],总结4 例患者的临床表现、实验室检查、电生理学检查、病理学检查、治疗和随访(表1)。
上述4 例患者尽管临床表现不尽相同,但其共同特点均为急性全自主神经功能障碍,同时广泛累及交感神经系统和副交感神经系统,前者表现为直立性低血压和全身排汗障碍,后者则为瞳孔扩大、胃肠动力障碍、排尿障碍、腺体分泌障碍如口干、眼干等。患者大多有前驱感染史,病程呈急性或亚急性自限性,神经系统查体提示感觉和运动神经受累体征相对较轻,而直立性低血压、皮肤干燥、全身排汗障等自主神经受累体征相对较重。神经传导检测,2 例(例1、例2)存在感觉和运动神经传导速度异常,3 例(例1、例2、例4)存在F 波和H 反射异常,2 例(例3、例4)大直径有髓纤维传导速度正常。自主神经 功 能 试 验,3 例 急 性 期 患 者(例1、例2、例4)Valsalva 率和深呼吸心率变异下降,提示副交感神经受累,其中例2 和例4 做Valsalva 动作和深呼吸运动时心率变异最小,提示副交感神经损害程度严重。直立倾斜试验,3 例急性期患者(例1、例2、例4)卧位与直立位血压差异>30/15 mm Hg,提示交感神经节后纤维大量丢失,其中例2 出现心率失代偿,提示自主神经功能障碍较为严重。其中,3 例行腰椎穿刺脑脊液检查,2 例(例2、例4)存在蛋白⁃细胞分离现象,提示可能存在神经根炎症反应。腓肠神经活检,4 例均存在广泛的小直径有髓纤维和无髓纤维丢失,其中例1、例2 同时存在大直径有髓纤维丢失。上述临床表现、实验室检查和病理检查结果均支持急性自主神经功能障碍的诊断,完善相关检查排除糖尿病周围神经病变(DPN)、副肿瘤性自主神经病、淀粉样变性周围神经病、卟啉病等导致自主神经病的其他病因后,3 例急性期患者(例1、例2、例4)经免疫调节治疗(糖皮质激素联合静脉注射免疫球蛋白)症状不同程度好转,1 例恢复期患者(例3)临床病程呈自愈性趋势,未予免疫调节治疗,其病程符合自身免疫性自主神经病的临床特点,故临床诊断为以急性全自主神经功能障碍发病的自身免疫性自主神经病。

表1 4 例以急性全自主神经功能障碍发病的自身免疫性自主神经病患者的临床资料Table 1. Clinical data of 4 cases of autoimmune autonomic neuropathy with onset of acute autonomic nerve dysfunction
合并自主神经病变的免疫性周围神经病的诊断,主要根据临床症状、血清免疫学指标、电生理学检查和病理学检查结果进行综合判断[4]。此类疾病临床表现多样,既可表现为交感神经系统、副交感神经系统、肠自主神经系统广泛受累的全自主神经功能障碍,也可以表现为局限性自主神经功能障碍,如仅累及心血管自主神经系统的神经源性直立性低血压或仅累及肠自主神经系统的消化道症状等[5]。上述4 例患者均表现为全自主神经功能障碍,交感神经系统、副交感神经系统和肠自主神经系统同时受累,广泛累及心血管系统、消化道、泌尿系统以及汗腺、泪腺、唾液腺等主要由自主神经支配的器官,其中例1、例2 除有自主神经系统受累症状外,还有感觉和运动系统大纤维受累表现,因此考虑为全自主神经功能障碍并感觉运动神经病;例3、例4 则考虑为单纯全自主神经功能障碍。值得注意的是,例1 的感觉运动神经病仅表现为轻度面瘫和感觉异常,例2 仅为四肢肌力下降,故造成诊断延迟;4 例患者均突出表现为晕厥、呕吐,故未在神经内科首诊,而是急诊科、消化科、心内科或内分泌科,此亦是造成治疗延误的重要原因,除例1 接受神经内科专科治疗时间为发病后2 周,其余3 例患者均于发病后2 月余方才明确诊断,其中例2、例3 发病后4 个月和1 年才被确诊。
1969 年,Young 等[6]报告首例 急性全自主神经功能障碍患者,但此后相当长一段时间,由于其发病形式类似吉兰⁃巴雷综合征,常被归为吉兰⁃巴雷综合征变异型[7]。直至2019 年,国际吉兰⁃巴雷综合征/慢性炎性脱髓鞘性多发性神经根神经病(CIDP)基金会发布吉兰⁃巴雷综合征诊断与治疗指南,不再将急性全自主神经功能障碍作为吉兰⁃巴雷综合征变异型中的一种独立诊断[8⁃9]。这是由于随着神经免疫学技术的进步,自身免疫性自主神经节病、急性自主感觉神经病等急性全自主神经功能障碍的独立病因逐渐被认识。但是,《中国吉兰⁃巴雷综合征诊治指南2019》(以下简称“中国指南”)仍将急性全自主神经功能障碍作为吉兰⁃巴雷综合征的独立亚型[10]。“中国指南”特别提出,急性全自主神经功能障碍可伴有轻微肢体无力和感觉异常,与国外文献报道的仅累及自主神经系统的急性全自主神经功能障碍在概念的内涵和外延上均有区别。“中国指南”中的急性全自主神经功能障碍涵盖了轻度感觉运动神经受累,是相对广义的概念。
本文例1 患者虽有脑神经和感觉运动神经受累表现,但临床表现、电生理学检查和自主神经系统受累特点均不符合急性炎性脱髓鞘性多发性神经根神经病(AIDP)和急性运动轴索性神经病(AMAN)的诊断标准,参照“中国指南”诊断考虑吉兰⁃巴雷综合征变异型、急性全自主神经功能障碍。例2 患者病程中也出现运动症状,神经传导检测提示感觉和运动神经传导速度减慢,虽病程超过2 个月,但其自主神经系统症状达峰值时间仍2 ~4 周,故参照“中国指南”临床拟诊为吉兰⁃巴雷综合征变异型、急性全自主神经功能障碍。例3 和例4 患者根据广泛的交感神经和副交感神经功能障碍、电生理检查提示无感觉运动神经受累,腓肠神经活检提示大直径有髓纤维保留、无髓纤维大量丢失,临床诊断为自身免疫性自主神经节病。自身免疫性自主神经节病最早由Vernino 等[11]于2000 年提出,背根神经节损害严重,仅残留少量正常神经元,是由自主神经节内烟碱型乙酰胆碱受体α 3 亚单位(gAChRs)抗体介导的自身免疫性周围神经病。由于交感神经和副交感神经的自主神经节均以乙酰胆碱作为神经递质,故该病最突出的临床表现是广泛性全自主神经功能障碍,包括直立性低血压,消化道症状如腹胀、呕吐、便秘等,排汗障碍,泌尿系统症状如尿频、尿急,口干、眼干、瞳孔改变等[12]。血清gAChRs 抗体阳性是强有力的诊断证据,但遗憾的是,目前国内尚无检测该抗体的条件。Nakane等[13]回顾分析80 例自身免疫性自主神经节病患者的临床资料,发现存在感觉异常主诉和体征的比例高达46.25%(37/80),但是这些患者神经传导速度均正常,提示可以通过神经传导检测鉴别自身免疫性自主神经节病与急性自主感觉神经病、吉兰⁃巴雷综合征和慢性炎性脱髓鞘性多发性神经病。腓肠神经活检提示无髓纤维大量丢失,有髓纤维相对保留[14]。因此,在目前无法进行抗体检测的情况下,可综合临床表现、电生理和病理检查结果进行临床诊断。例4 患者临床可诊断为干燥综合征,故需鉴别其自身免疫性自主神经病的病因是干燥综合征继发自主神经病还是自身免疫性自主神经节病。干燥综合征最常见的周围神经损害表现为周围神经病,可累及感觉神经和自主神经,仅少数患者表现为孤立的自主神经病[15],其发生机制主要是T 淋巴细胞直接攻击自主神经或小血管炎继发神经纤维缺血,故通常有长度依赖性特点[16]。自身免疫性自主神经节病常合并自身免疫性疾病,尤以干燥综合征最为常见[17],亦常见全身排汗障碍[18]。例4 发汗试验提示全身排汗障碍,并非长度依赖性肢体远端排汗障碍,因此病因诊断考虑干燥综合征合并自身免疫性自主神经节病,而非干燥综合征继发自主神经病。
治疗及预后方面,例3 为急性全自主神经功能障碍恢复期,未行免疫调节治疗,临床病程呈现自愈性趋势;其余3 例均予以糖皮质激素联合静脉注射免疫球蛋白,治疗后自主神经系统症状均不同程度改善,其中,例2 预后相对较差,除治疗时间较晚,还与其自主神经病变程度严重有关。为进一步追踪例4 病情进展,要求患者出院后每年至我科门诊复查,出院后1 年6 个月(2019 年初)可经口进食流食,无明显呃逆、呕吐;出院后2 年(2019 年6 月)可正常经口进食,拔除胃空肠营养管;出院后3 年(2020 年6 月)可正常经口进食,无明显腹胀、呕吐,偶有久立后头晕,未再发生晕厥,但全身排汗障碍仍较明显,不耐热。目前,关于免疫性自主神经病的治疗仅有个案或小样本病例报道,均推荐甲泼尼龙冲击治疗、静脉注射免疫球蛋白或血浆置换疗法为一线治疗方案[19];治疗效果欠佳者,可联合应用上述方案并加用泼尼松、硫唑嘌呤、吗替麦考酚酯、利妥昔单抗等药物[20]。此外,针对直立性低血压,可予以盐酸米多君、屈昔多巴等药物对症治疗;针对胃肠动力障碍,可予以甲氧氯普胺、溴吡啶斯的明等药物对症治疗[21⁃22]。
综上所述,自身免疫性自主神经病临床异质性较大,早期诊断与治疗具有重要临床意义。对于急性发病的直立性低血压、频繁呕吐、大小便障碍、全身排汗障碍,应考虑以急性全自主神经功能障碍发病的自身免疫性自主神经病,通过完善自主神经功能试验、电生理学检查和腓肠神经活检,以及在条件允许的情况下行抗体检测,尽早明确诊断、及时进行免疫调节治疗,可使患者神经功能恢复并获得良好预后。
利益冲突无
