杂环胺与牛血清白蛋白的相互作用研究
2021-01-05李琳婺鸣李冰张霞徐丹
李琳 婺鸣 李冰,3,4† 张霞,3,4 徐丹
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.东莞理工学院,广东 东莞 523000;3.华南理工大学 广东省天然产物绿色加工与产品安全重点实验室,广东 广州 510640;4.华南理工大学 淀粉与植物蛋白深加工教育部工程研究中心,广东 广州 510640)
杂环胺(HAAs)是肉制品热加工过程中氨基酸、糖与肌酐反应产生的化学危害产物,目前在日常饮食中已发现有30多种杂环胺[1]。根据杂环胺的结构,可分为极性与非极性杂环胺两类[2]。研究发现,杂环胺具有很强的致癌、致畸、致突变能力[3],其中,2-氨基-3-甲基咪唑[4,5-f]-喹啉(IQ)被国际癌症研究机构(IRAC)定义为可能致癌物(2A级),2-氨基-1-甲基-6-苯基-咪唑[4,5-b]吡啶(PhIP)和2-氨基-9H-吡啶并[2,3-b]吲哚(AαC)被定义为潜在致癌物(2B级)[4]。研究表明,杂环胺经过体内代谢活化后,其环外氨基能与DNA发生反应并结合形成具有高度亲电子活性的代谢终产物,从而对人体产生危害[5]。虽然杂环胺9H-吡啶并[3,4-b]吲哚(Norharman)结构中不含有环外氨基,不会对DNA产生直接毒害,但Norharman的存在会显著增强其他具有环外氨基的杂环胺的毒害性[6]。因此对于Norharman的研究也很有必要。
人血清白蛋白(HSA)是血浆中的一种重要载体蛋白,其与有害物的结合能力会影响到有害物在体内的吸收、转运和分布。鉴于此,对有害物与白蛋白之间的相互作用的研究将有助于了解有害物在人体内的运输与分布[7]。牛血清白蛋白(BSA)是从牛血清中提取出的一种球蛋白,含有583个氨基酸残基。BSA分子可被分为Ⅰ、Ⅱ、Ⅲ3个结构域,每个结构域又可分为A、B两个亚域。由于BSA与HSA结构相似,具有76%的同源性,且价格更为低廉,因此,常被用作模型蛋白来研究小分子化合物与白蛋白的相互作用[8]。
本文选择了两种常见的杂环胺2-氨基-3-甲基咪唑[4,5-f]-喹啉(IQ)和9H-吡啶并[3,4-b]吲哚(Norharman)(结构如图1所示)作为研究对象,通过荧光光谱、同步荧光光谱、圆二色谱等多光谱方法研究它们在生理条件(pH=7.4)下与BSA的相互作用规律,以期通过Stern-Volmer方程和双对数方程计算获得淬灭机制、结合常数、结合位点数和作用力类型等重要信息,并借助分子对接手段模拟相应的结合位点。本研究有助于了解杂环胺在体内的运输、分布,为减少杂环胺对人体的危害提供一定参考。
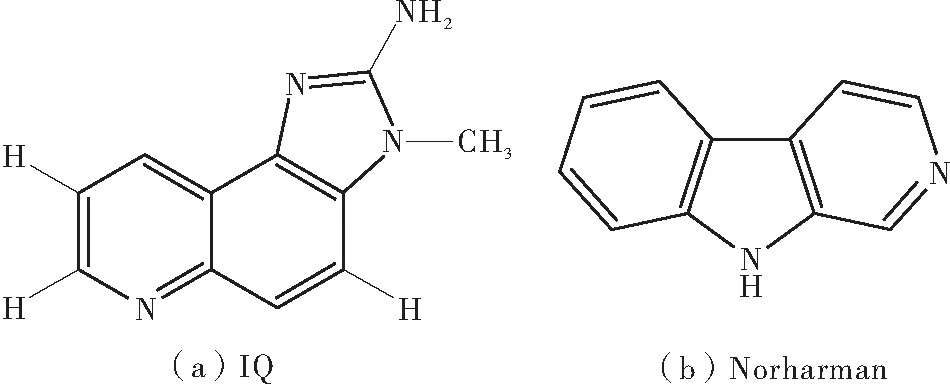
图1 杂环胺IQ与Norharman的化学结构式
1 材料与方法
1.1 主要材料与试剂
2-氨基-3-甲基咪唑[4,5-f]-喹啉(IQ)和9H-吡啶并[3,4-b]吲哚(Norharman)杂环胺标准品:加拿大Toronto Research Chemicals公司;牛血清白蛋白(BSA):98%,美国Sigma-Aldrich公司;二甲基亚砜:色谱纯,国药集团化学试剂有限公司;其他试剂:国产分析纯。
1.2 主要仪器与设备
F- 7000 FL荧光光谱仪:日本Hitachi公司;Chirascan圆二色谱仪:英国Applied Photophysics公司;FiveEasy pH计:美国Mettler Toledo公司;BS 224S天平:德国Sartorius公司;HH- 4水浴锅:常州澳华仪器有限公司。
1.3 试验条件
1.3.1 溶液的配制
称取一定量BSA,溶于0.1 mol/L Tris-HCl溶液(pH=7.4),配置浓度为1.5×10-3mol/L的储备液;分别准确称取IQ和Norharman两种杂环胺,溶于二甲基亚砜,配置浓度为5×10-3mol/L的储备液;全部储备液于4 ℃避光环境中存放。
1.3.2 荧光光谱测定与数据分析
将BSA储备液用0.1 mol/L Tris-HCl溶液(pH=7.4)稀释100倍,配置成浓度为1.5×10-5mol/L的BSA溶液;各杂环胺储备液用二甲基亚砜稀释,配置成浓度为5×10-5mol/L的工作溶液。准确移取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL杂环胺工作溶液于10 mL离心管中,加入1 mL BSA溶液,以Tris-HCl缓冲液(0.1 mol/L,pH=7.4)补足至5 mL,最后分别在298、308与310 K反应5 min后进行荧光光谱扫描和同步荧光光谱测定。在荧光光谱扫描模式下,激发波长λex=280 nm,λem=300~400 nm;在同步荧光光谱测定中,测定Δλ=15 nm下270~310 nm的荧光强度与Δλ=60 nm下250~310 nm的荧光强度。
根据某一温度下不同杂环胺添加量处理后的蛋白荧光峰值,使用Stern-Volmer方程(1)来计算此温度下的淬灭常数。使用双对数曲线方程(2)来计算结合常数与结合位点。

(1)
log[(F0-F)/F]=logKA+nlog[Q]
(2)

1.3.3 圆二色光谱的测定
使用0.01 mol/L Tris-HCl溶液(pH=7.4)配置浓度为5×10-6mol/L的杂环胺溶液。向10 mL离心管中加入1 mL 1.5×10-5mol/L的BSA溶液,分别加入0.1、0.3、0.5和1.0 mL的杂环胺溶液,用Tris-HCl溶液(0.01 mol/L,pH=7.4)补足至 5 mL,置于310 K水浴加热5 min,加入1 mm石英比色皿测量190~260 nm范围内的圆二色光谱。
1.3.4 分子对接模拟
使用Autodock 4.6软件研究两种杂环胺与BSA的模拟结合[10]。BSA的晶体结构从蛋白质数据库RCSB中获得(编号3V03),IQ和Norharman的结构从网站(http:∥zinc.docking.org/)中下载。对各结构进行预处理,包括去水、去配体、加氢和点电荷计算。选择结合能最低的一个结果,使用Ligplot软件绘制2D分子对接图。
2 结果与分析
2.1 两种杂环胺与BSA的相互作用
2.1.1 杂环胺与BSA相互作用的荧光光谱图
BSA中由于色氨酸、酪氨酸及苯丙氨酸的存在,使其具有内源荧光[11]。当蛋白质与小分子发生相互作用时,色氨酸和酪氨酸残基对于微环境变化十分敏感,进而使得蛋白质的内源荧光发生变化。值得注意的是,许多杂环胺在260~275 nm处具有荧光吸收[12],与BSA的激发波长280 nm十分接近,对荧光光谱结果有影响,因此,需以不含蛋白质的等浓度杂环胺溶液作为空白对照。图2是在生理环境(310 K,pH=7.4)下,BSA与不同浓度IQ和Norharman相互作用后的荧光光谱图。当激发波长为280 nm时,BSA在340 nm下具有荧光发射峰,并随着两种杂环胺的加入,发射峰强度均有所减小,发射峰的位置均发生了蓝移。这表明,杂环胺能够与BSA发生相互作用,导致了BSA的内源荧光淬灭,并且荧光基团的微环境发生了变化,疏水性增加,极性变小。此外,310 K下杂环胺IQ造成的内源性荧光淬灭的强度要高于Norharman造成的荧光淬灭,这表明在生理条件下,IQ对BSA中的荧光基团影响要高于Norharman,这种差异可能是分子极性的不同导致的。

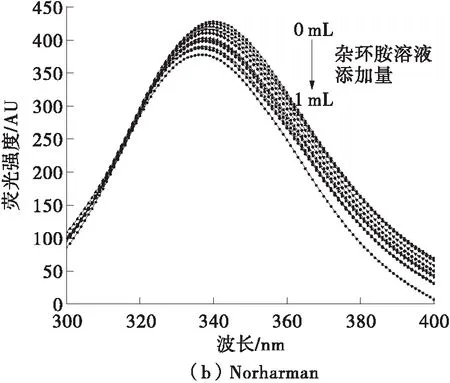
图2 杂环胺IQ、Norharman与BSA在310 K下相互作用的荧光光谱图
2.1.2 杂环胺对BSA荧光淬灭的机理
荧光淬灭是内源性荧光分子与淬灭分子发生相互作用而导致荧光强度降低的过程,可主要分为动态淬灭、静态淬灭以及动态和静态的联合淬灭[13]。动态淬灭是由于荧光分子与淬灭分子发生碰撞,造成了能量转移或电荷转移,降低了荧光强度;静态淬灭则是荧光分子与淬灭分子结合形成不发光的基态络合物。温度越高,分子碰撞越剧烈,而基态络合物越不稳定,因此动态淬灭的淬灭常数随温度的升高而增大,静态淬灭的淬灭常数随温度的升高而减小[14]。
假设两种杂环胺与BSA的淬灭机理都是动态淬灭,将各体系在各温度下的荧光光谱结果分别代入方程(1)处理。以F0/F为纵坐标,[Q]为横坐标绘图,并拟合曲线,结果如图3所示,不同温度下杂环胺与BSA的Stern-Volmer常数则列于表1中。
从图3可知,杂环胺IQ的Stern-Volmer曲线斜率随着温度的升高而增大;但由表1知,荧光淬灭常数Kq达到1012数量级,远大于生物大分子的最大扩散碰撞淬灭常数2.0×1010L·mol-1·s-1,这表明IQ对BSA的荧光淬灭机理是动态和静态的联合淬灭,且主要是动态淬灭。杂环胺Norharman的Stern-Volmer曲线斜率随着温度的升高而减小,且表1中所求得的Kq远大于2.0×1010L·mol-1·s-1,因此Norharman对BSA的荧光淬灭机理为静态淬灭。虽然Stern-Volmer模型也可用于单一静态淬灭体系,但是此时动态淬灭常数KSV没有实际意义,因此更多考察荧光淬灭常数Kq的大小来评价淬灭效果[15]。两种杂环胺淬灭机理不同应该是由于IQ的分子极性大于Norharman,难以进入被包埋在折叠后的BSA内部的含有荧光基团的疏水区域;且较大的分子体积进一步削弱了IQ与BSA的结合亲和力[16]。因此相较于Norharman,IQ与BSA更难以形成稳定的基态络合物。
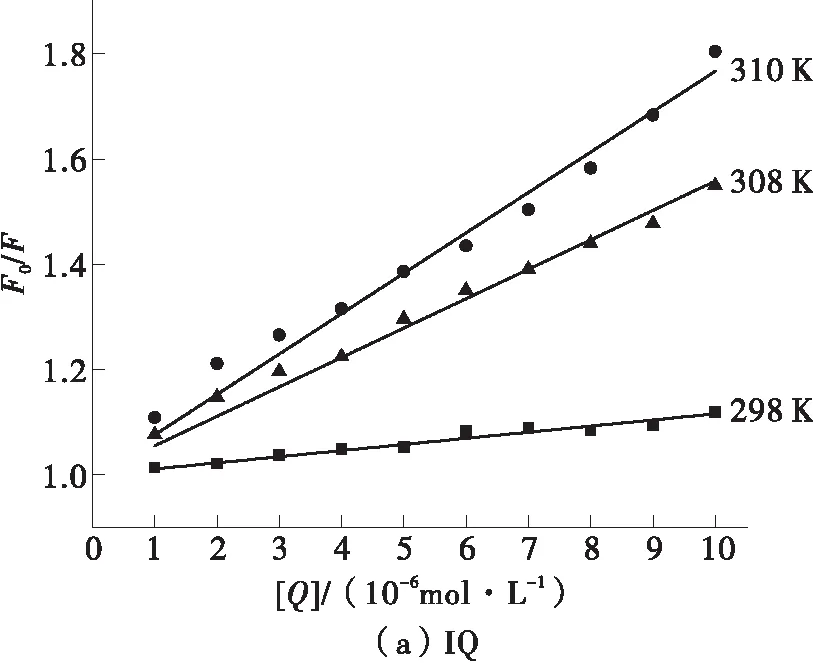
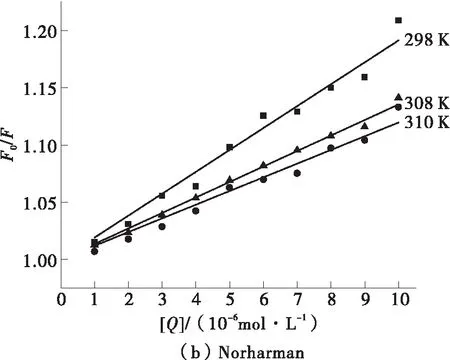
图3 杂环胺IQ、Norharman与BSA作用的Stern-Volmer曲线图
2.1.3 杂环胺与BSA的结合常数和结合位点
使用双对数方程(2)来处理荧光光谱结果,以计算相互作用的结合常数(KA)与结合位点(n)[17]。
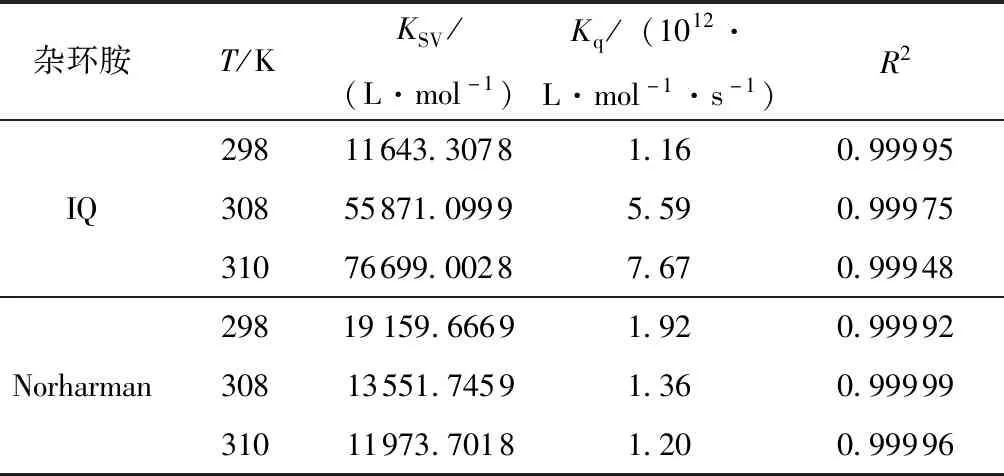
表1 杂环胺与BSA作用的Stern-Volmer常数
以log [(F0-F)/F]为纵坐标,log [Q]为横坐标作图并拟合曲线。得到的结果如图4及表2所示。
由图4及表2可知,两种杂环胺与BSA的结合位点数n均在1左右,故认为杂环胺与BSA有1个结合位点。IQ的结合常数随着温度的升高而增大,Norharman的结合常数随着温度的升高而减小。这也进一步证实了IQ与BSA的荧光淬灭中主要是动态淬灭,而Norharman与BSA的淬灭机理是静态淬灭。
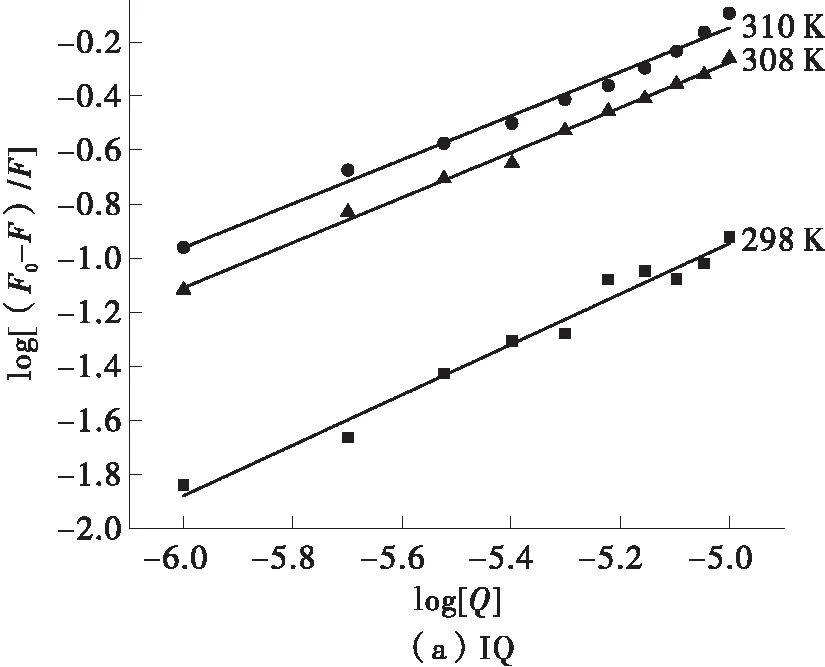
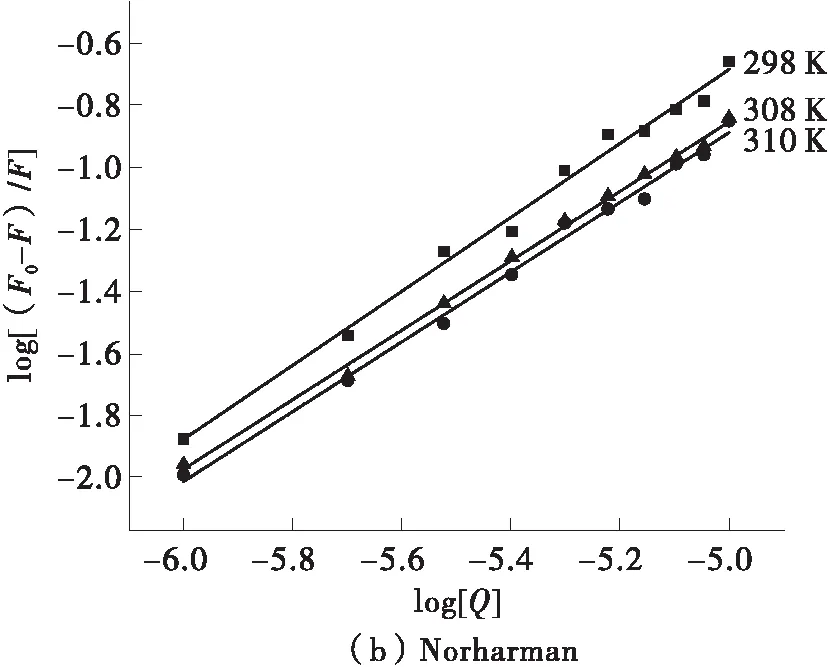
图4 杂环胺IQ、Norharman和BSA作用的双对数曲线图
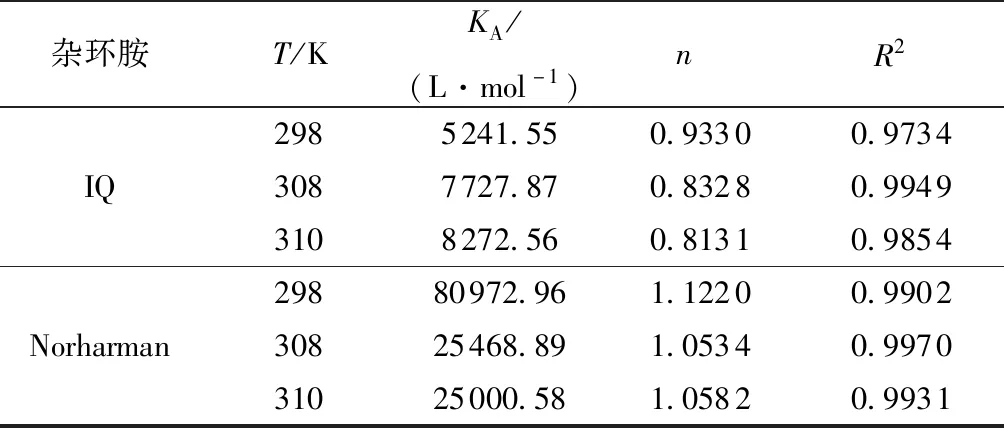
表2 杂环胺与BSA的结合常数与结合位点
2.1.4 杂环胺与BSA结合的热力学参数与作用力类型
小分子与蛋白质相互作用,作用力类型一般包括疏水作用力、氢键、范德华力、静电引力等。通过相互作用的热力学参数可以判断作用力类型:ΔH<0,ΔS<0时作用力为氢键和范德华力;ΔH>0,ΔS>0时作用力为疏水作用力;ΔH<0,ΔS>0时作用力为静电引力[18]。当温度变化不明显时,可以认为反应焓变ΔH是一常数。热力学参数ΔH、ΔS和ΔG可由以下方程计算得到:
ln(K2/K1)=(1/T1-1/T2)ΔH/R
(3)
ΔG=ΔH-TΔS=-RTlnK
(4)
计算得到的热力学参数如表3所示。
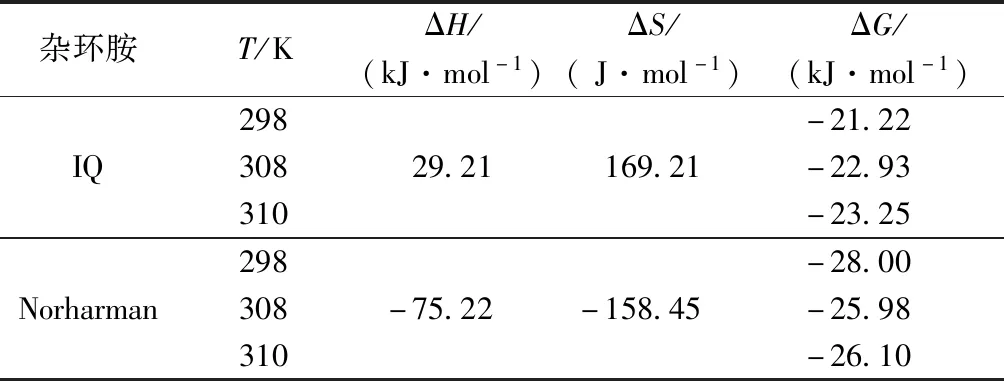
表3 杂环胺与BSA结合的热力学参数
由表3可知,两种杂环胺与BSA的结合都是自发过程(ΔG<0),IQ与BSA结合的ΔH>0,ΔS>0,可以认为,IQ与BSA的分子间相互作用力是疏水作用力;而Norharman与BSA结合的ΔH<0,ΔS<0,可以认为,该相互作用的作用力是氢键和范德华力。
2.2 杂环胺对BSA构象变化的影响
2.2.1 同步荧光光谱
荧光基团的最大发射波长与它所在的微环境极性有关,因此通过同步荧光光谱分析可以判断氨基酸残基所处环境的极性变化。在同步荧光光谱中,Δλ=15 nm的结果对应了蛋白质中酪氨酸残基的光谱性质,Δλ=60 nm的结果对应了蛋白质中色氨酸残基的光谱性质[19]。同步荧光光谱结果如图5所示。
从图5可以看出,两种杂环胺的加入均使酪氨酸和色氨酸残基的荧光强度有所降低。随着IQ浓度的增加,酪氨酸和色氨酸残基的最大发射波长均发生了轻微红移。其中酪氨酸残基最大发射波长红移3 nm,色氨酸残基最大发射波长仅红移1 nm。这说明IQ的加入使得色氨酸和酪氨酸残基的微环境极性增大,疏水性减小;且色氨酸残基的微环境受到影响更小。添加Norharman的结果与IQ有所不同,Norharman浓度的增加使得酪氨酸残基最大发射波长发生红移,色氨酸残基最大发射波长发生蓝移。这表明Norharman的加入使得BSA中酪氨酸残基微环境极性增大,疏水性减小;色氨酸残基微环境极性减小,疏水性增大。
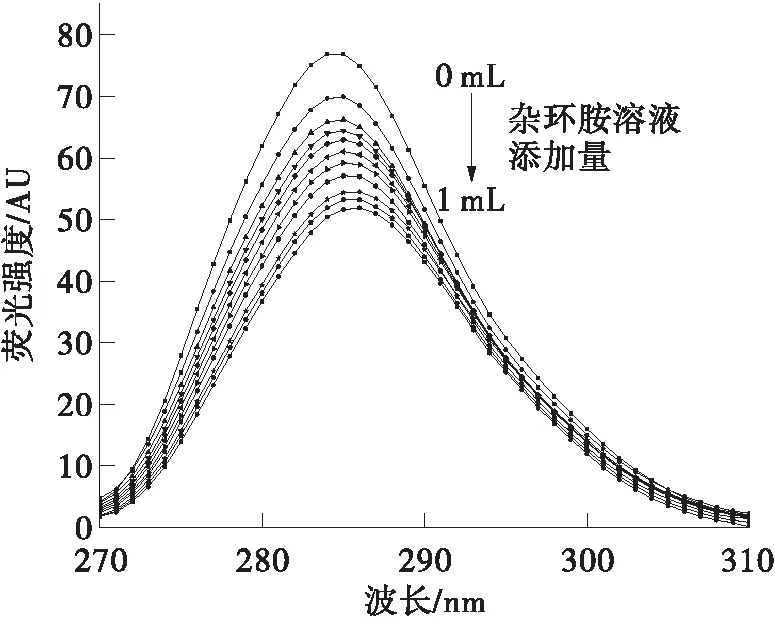
(a)IQ,Δλ=15 nm
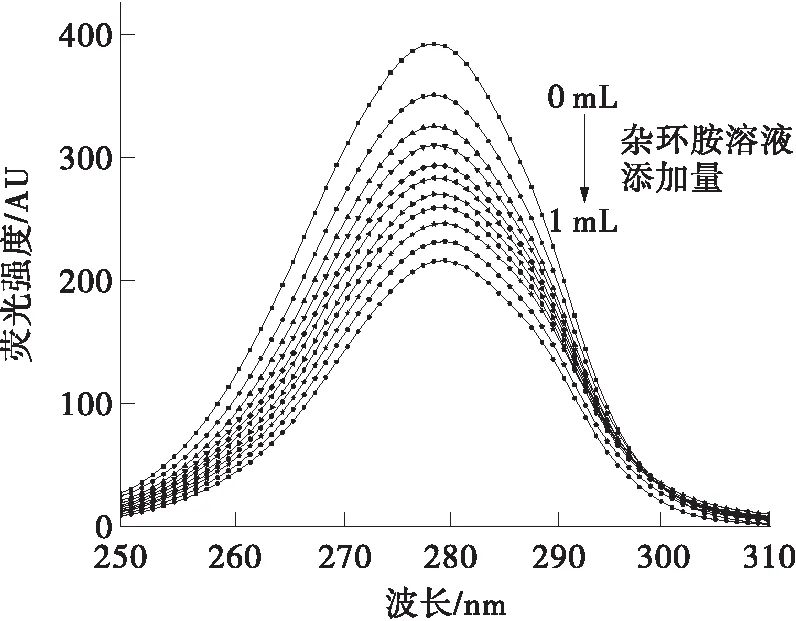
(b)IQ,Δλ=60 nm
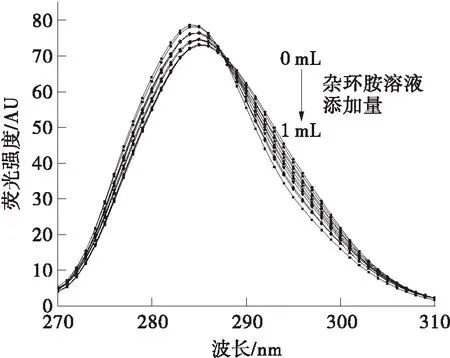
(c)Norharman,Δλ=15 nm
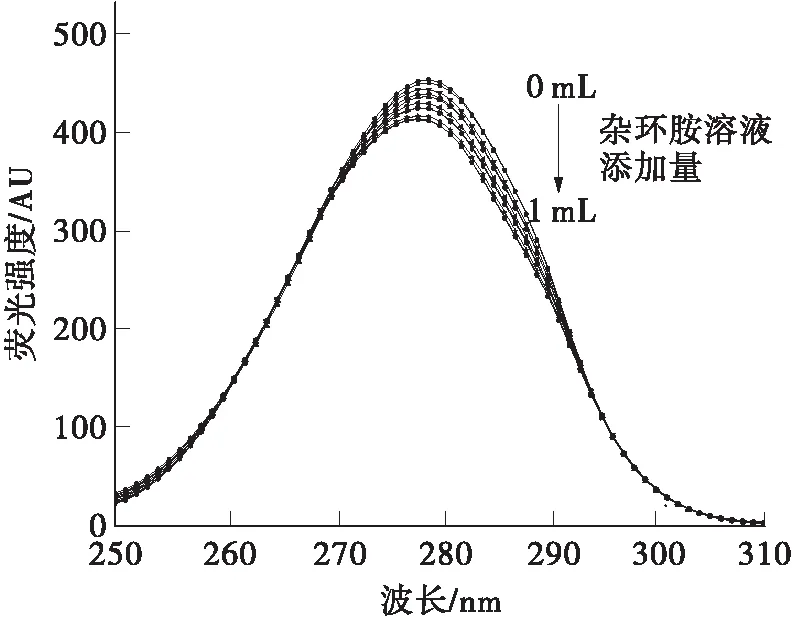
(d)Norharman,Δλ=60 nm
2.2.2 圆二色光谱
圆二色光谱技术可以用来检测蛋白质构象的变化。为了将杂环胺与BSA相互作用后蛋白质的二级结构变化清楚的体现在圆二色光谱上,此处选择了较高浓度的杂环胺以确保绝大部分的BSA都参与了相互作用。根据前文计算得到,杂环胺与BSA的结合位点数均为1,故选择杂环胺浓度为蛋白质浓度([BSA]=3×10-6mol/L)的0.00、0.33、1.00、1.67与3.33倍。图6显示的是在生理环境下(310 K,pH=7.4),BSA与不同添加量的IQ或Norharman相互作用后在190~260 nm范围内的圆二色光谱。BSA分子的圆二色光谱分别在208 nm和222 nm处具有双负峰形,这是典型的α-螺旋结构[20]。随着两种杂环胺加入到BSA中的比例增大,BSA分子在208 nm和222 nm 两处的负峰明显降低,且IQ实验组的降低量要大于Norharman实验组的结果。这说明极性杂环胺IQ在此条件下对BSA的二级结构影响要大于非极性杂环胺Norharman。
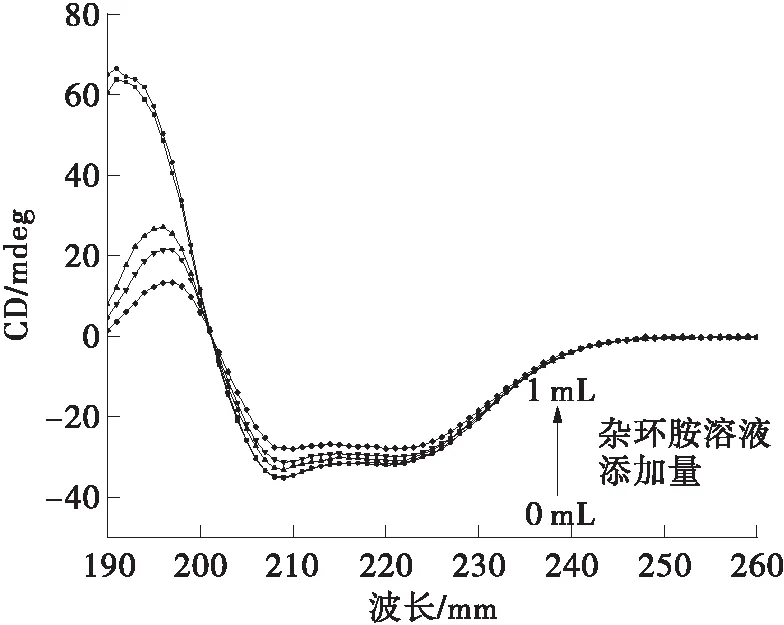
(a)IQ
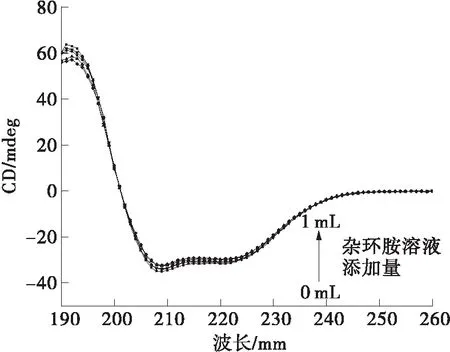
(b)Norharman
对空白组及杂环胺添加量最高的一组使用CDNN 2.1软件计算BSA中的各二级结构含量,结果如表4所示。极性杂环胺IQ的添加能显著减少BSA中α-螺旋的含量,非极性杂环胺Norharman也能减少α-螺旋的含量,但影响较小。结果说明杂环胺与BSA的结合破坏了原有蛋白质的氢键结构,导致疏水性降低,肽链伸展,使α-螺旋结构含量降低[21]。
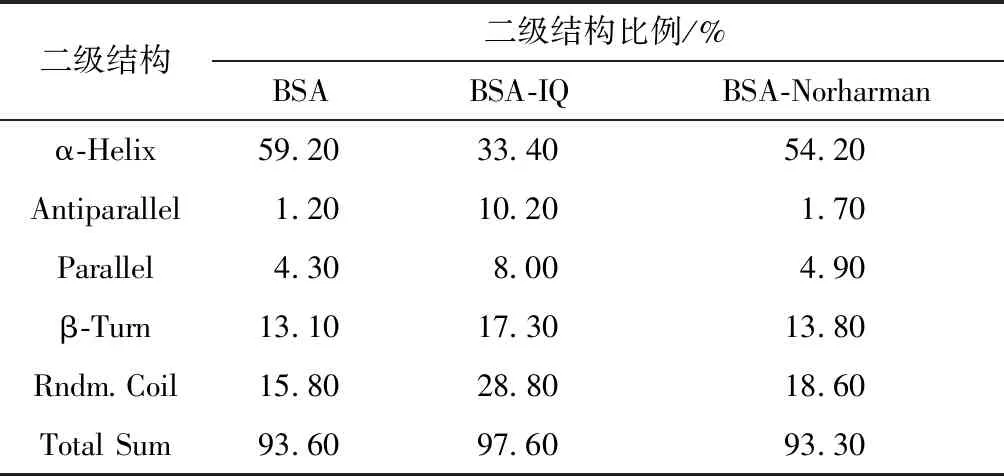
表4 杂环胺添加对BSA二级结构比例的影响
2.3 分子对接模拟杂环胺与BSA的结合
分子对接技术可用于预测小分子与蛋白大分子之间的相互作用位点和结合自由能[10]。本研究中设置Grid Box范围覆盖整个BSA分子,通过结合能最低原则来判断可能的结合位置。使用Ligplot软件处理结合能最低的构象并绘制2D图。
由图7可知,在结合能最低的构象中,IQ与BSA上的Leu- 42、Glu- 45、Lys- 76、Ala- 78 4个氨基酸残基存在疏水相互作用,并与Glu- 73存在氢键作用,另由Autodock的对接结果表明此时结合能为-5.44 kcal/mol;Norharman与Pro- 338存在氢键作用,并与Gln- 220、Tyr- 340、Val- 342、Glu- 443、Pro- 446、Asp- 450 共5个氨基酸残基存在疏水相互作用,另由Autodock的对接结果表明此时结合能为-4.36 kcal/mol。在BSA分子的ⅡA和ⅢA亚域中存在两个常见的小分子结合位点Site Ⅰ和Site Ⅱ。IQ的对接结果表明,结合能最低的作用位点位于结构域Ⅰ中,与两个小分子结合位点距离较远;而Norharman分子的结合能最低的作用位点接近Site Ⅱ。这也从侧面解释了两种杂环胺对BSA淬灭机理的差异:IQ与BSA分子的结合位点与Site Ⅰ和Site Ⅱ不在一个结构域中,且受到的疏水作用力也较少,而由2.1.4可知IQ与BSA相互作用的主要作用力为疏水作用力,因此两者难以形成稳定的基态络合物,对BSA主要是动态荧光淬灭;Norharman的结合位点则与Site Ⅱ在一个结构域中,受到的疏水作用也更多,且由2.1.4可知主要相互作用力来自于氢键和范德华力,因此能与BSA生成稳定的基态络合物,对BSA产生了静态荧光淬灭。
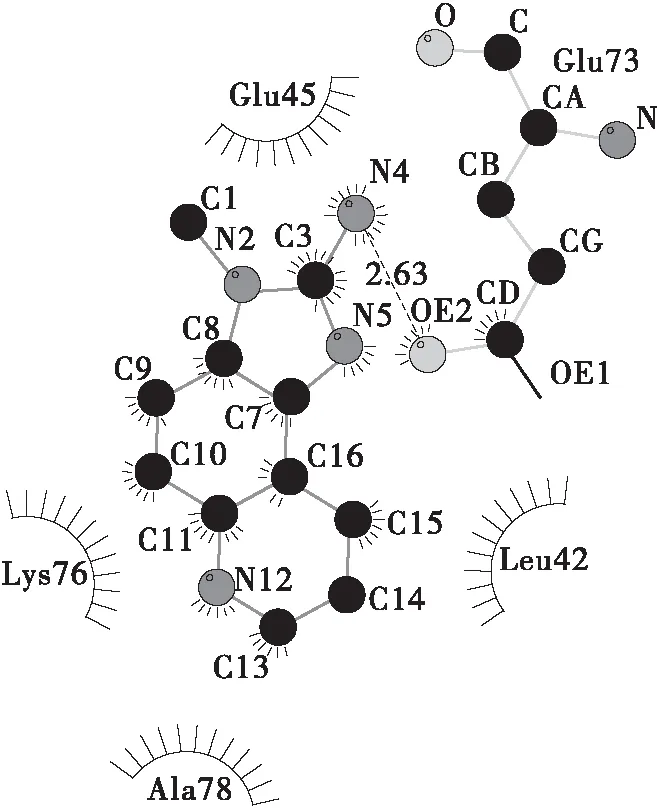
(a)IQ
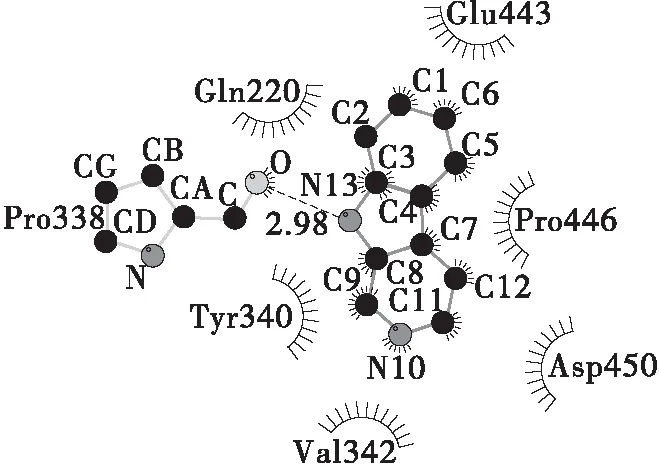
(b)Norharman
3 结论
文中运用荧光光谱、圆二色光谱方法考察了肉制品加工中两种危害物杂环胺IQ及Norharman与BSA的相互作用。荧光光谱法的研究发现两种杂环胺都能与BSA发生相互作用,淬灭内源性荧光。其中,IQ的荧光淬灭机理为动态和静态的联合淬灭,且主要是动态淬灭,IQ与BSA的分子间相互作用主要是疏水作用力;Norharman对BSA的淬灭属于静态淬灭,结合力类型主要是氢键和范德华力。而同步荧光和圆二色光谱的研究结果则表明,两种杂环胺与BSA之间的结合均导致了BSA构象的改变,IQ引起的构象改变程度要高于Norharman。此外,还用分子对接分别模拟了两种杂环胺与BSA的结合。两种杂环胺与BSA的结合机理有着很大不同,引起这一现象的原因应该是两种杂环胺的分子极性差异,但仍有待进一步探索。这项研究将为以后杂环胺与人血清白蛋白结合的研究提供了理论基础,有助于了解杂环胺在体内的运输分布情况,为抑制杂环胺体内的吸收提供一定参考。
