微生物强化对石油污染土壤的修复特性研究
2021-01-05王娣马闯高欢刘恒徐会宁吴蔓莉
王娣,马闯,高欢,刘恒,徐会宁,吴蔓莉
(西安建筑科技大学环境与市政工程学院,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,西安 710055)
生物强化(Bioaugmentation)是指向污染环境中接种外源微生物以对污染物进行去除的方法[1-2]。由于接种的降解菌可对目标污染物进行直接降解,因此具有针对性强、对污染物去除速度快等优点,已成为广为采用的石油污染土壤修复技术[3-6]。已有大量文献研究对石油烃降解菌的筛选和鉴定进行了详细报道。筛选出的可降解石油烃的菌属包括假单胞菌属(Pseudomonas)、节杆菌属(Arthrobacter)、产碱菌属(Alcaligenes)、棒状杆菌属(Corynebacterium)、红球菌属(Rhodococcus)和黄杆菌属(Flavobacterium)等多种菌属[7-12]。此外,对降解菌群的构建和外源菌群接种对石油烃去除效果的影响也有较为详细的研究报道[13-15]。
生物强化中接种的降解菌生长和代谢活性受土壤湿度、土壤养分和pH等土壤环境条件的影响较大[16-17]。Pacwa-Płociniczak等[18]向初始含油量为11 980 mg·kg-1的土壤中接种红球菌属进行生物强化修复,接种量为108cfu·g-1、保持土壤湿度为50%的田间持水量修复182 d时,石油烃去除率达到38.4%。Wu等[19]向黄土壤中接种由Pseudomonas stutzeri GQ-4 strain KF453954、Pseudomonas SZ-2 strain KF453956和Bacillus SQ-2 strain KF453961构成的降解菌群,接种量为108cfu·g-1、土壤湿度为20%修复8周,石油烃去除率达到58%。目前的研究工作多是对最佳湿度和接种量条件下的石油烃去除效果进行研究,但对于不同接种量的降解菌群在土壤自然湿度条件下的生长存活状况研究相对较少。
本文利用富集培养法从石油污染土壤中筛选出石油烃降解菌群,在两种不同土壤湿度条件下(5.4%和15.0%)向污染土壤中接种降解菌群进行生物强化修复处理,研究接种量和湿度对降解菌群生长和存活的影响以及对石油烃的去除效果,研究可为深入理解降解菌群接种生物强化修复提供一定的理论基础。
1 材料与方法
1.1 降解菌群的筛选
以采自陕北延长某油井周围的石油污染土壤为石油烃降解菌菌源。土壤的基本理化性质为:pH 7.68、总氮1 170 mg·kg-1、有效磷15.92 mg·kg-1、铵态氮14.70 mg·kg-1、硝态氮0.38 mg·kg-1,土壤含油量为15 233 mg·kg-1。
富集筛选培养基——L9培养基:Na2HPO4·12H2O 17.689 g·L-1,KH2PO43.0 g·L-1,NH4Cl 1.0 g·L-1,NaCl 0.5 g·L-1,1 mL·L-11 mol·L-1MgSO4,2.5 mL·L-1微量元素。微量元素组成:MnCl2·2H2O 23 mg·L-1,MnCl4·H2O 30 mg·L-1,H3BO331 mg·L-1,CoCl2·6H2O 36 mg·L-1,CuCl2·2H2O 10 mg·L-1,NiCl2·6H2O 20 mg·L-1,Na2MoO4·2H2O 30 mg·L-1,ZnCl250 mg·L-1。
富集筛选方法:称取5.0 g石油污染土壤,无菌条件下加入50.0 mL灭菌的L9培养基,30℃、150 r·min-1条件下振荡培养2 h以提取土壤中的总微生物。将提取物静置30 min后,移取5 mL提取液转接至含1%原油(取自长庆油田采油六厂)的100.0 mL L9培养基中,相同条件下连续培养7 d,如此转接5次后,将最后一次获得的培养液在10 000 r·min-1条件下离心分离获得混合菌,利用PBS无机盐缓冲液洗涤混合菌5次。将混菌悬液OD值调节为1.0,600 nm处测定,相当于1×108cfu·mL-1的菌量。获得的混菌悬液用MC表示。利用高通量测序分析降解菌群MC的组成,并将获得的菌群用于后续生物强化修复方案中。
1.2 生物强化修复方案
将石油污染土壤经碎散、除杂、过0.85 mm筛后混匀。称取36份100.0 g的石油污染土壤分装于36个烧杯中,具体修复方案见表1。表1中,CK、A、B、C、D、E为土壤自然湿度(5.4%)实验组;CK’、A’、B’、C’、D’、E’为15.0%湿度实验组(修复过程中定期向土壤中加灭菌纯水,使土壤湿度为15%)。将1.1中获得的降解菌悬液MC按表1设定的接种量分别接种于石油污染土壤中,CK和CK’为不进行接种处理的控制组。每个处理设置3个平行。

表1 石油污染土壤的修复方案设计Table 1 Experiment design for bioremediation of petroleum-polluted soil
所有样品均放置在实验室内,每隔3~4 d用灭菌玻棒翻动土壤以保证充氧量,在修复的第7、15、30、45、60 d时取样测定土壤中总石油烃含量。
1.3 石油烃测定方法
采用超声波萃取法提取土壤中的总石油烃并利用质量法进行测定[20]。详细步骤为:准确称取风干土样3.000 g置于离心管中,加入正己烷和二氯甲烷1∶1混合萃取剂15.0 mL,利用超声细胞破碎仪(SONICS,JY92-Ⅱ,美国)超声萃取10 min(萃取功率为170 W),4 ℃、8 000 r·min-1条件下离心15 min,利用定量滤纸过滤提取液于已称质量的称量瓶中,重复萃取3次。将称量瓶放于通风橱,使其中的提取剂挥发,待完全挥发至恒质量后称取质量。
1.4 高通量测序分析
在修复第7 d和第60 d时,从接种量为108cfu·g-1、自然湿度的土壤(标号为E7、E60)和接种量为107cfu·g-1、湿度为15.0%的土壤(编号为D’7、D’60),以及修复60 d时的控制组土壤(编号为CK60、CK’60)的各3个重复样品中,选择石油烃测定结果最接近的2个平行样品,送上海生工(https:∕∕www.sangon.com∕)进行高通量测序分析。
使用Prinseq软件对高通量测序结果进行质量控制,将所测序列与RDP数据库进行序列比对,使用Usearch软件去嵌合后归类为同种可操作分类单元(OTU),利用Mothur公式计算多样性指数,利用RDP classifier对测序结果进行物种分类[21]。细菌门水平和属水平的相对丰度计算方法见公式(1):

式中:λ为第i种细菌门水平(属水平)的相对丰度;Si为第i种细菌门水平(属水平)的有效序列数;S为该土样中微生物的总有效序列数。
1.5 数据处理
使用SPSS 19.0软件对总石油烃去除率进行One-way-ANOVA方差分析,显著性水平取0.05。采用Origin 9.0软件作图。
高通量测序结果显示,每个处理的2个平行样品测定结果的重复性较好,从中随机选取1个样品的测定结果进行后续分析。
2 结果与讨论
2.1 石油烃降解菌群组成
利用富集培养方法从陕北地区石油污染土壤中筛选出以石油烃为唯一碳源和能源生长的菌群MC。经高通量测序从MC中获得的有效序列数为94 919,OTUs数目为278个,归属于19个门。降解菌群主要由变形菌门(Proteobacteria,99.75%)组成,其余的几种菌门包括放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)的总丰度不高,为0.25%。降解菌群的优势菌属为不动杆菌属(Acinetobacter,87.32%)和假单胞菌属(Pseudomonas,12.00%)(图1)。
不动杆菌属和假单胞菌属是文献报道的常见石油烃降解菌[22-27]。本课题组在前期的研究中,利用Bush-hass培养基从陕北石油污染土壤中筛选出的降解菌组成均为假单胞菌属和不动杆菌属[28]。说明这两种菌属是陕北地区石油污染土壤中普遍存在的可降解石油烃的菌属。
2.2 接种降解菌对土壤中石油烃去除效果的影响
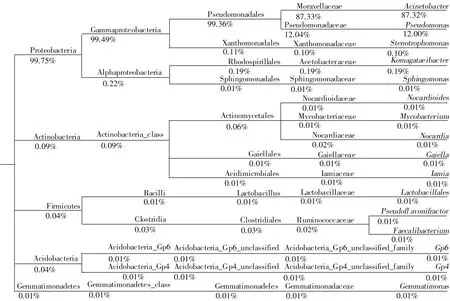
图1 石油烃降解菌群MC组成Figure 1 The compositions of petroleum-degrading flora MC
自然湿度(5.4%,图2)条件下修复60 d,A、B、C、D、E土壤样品中总石油烃含量分别从15 233 mg·kg-1降低至14 767、15 167、14 867、14 683 mg·kg-1及13 617 mg·kg-1,石油烃去除率分别为3.06%、0.44%、2.41%、3.61%、10.61%。不接菌的CK土壤中含油量降至14 422 mg·kg-1,总石油烃去除率为5.32%。自然湿度条件下,当降解菌群接种量为108cfu·g-1时,接入的降解菌群对土壤中石油烃起到一定的去除作用。接种量低于108cfu·g-1时的石油烃去除率低于CK组,可能是由于接种菌群数量少,没有生长为优势菌,接种后反而抑制了原有降解菌的生长和活性。
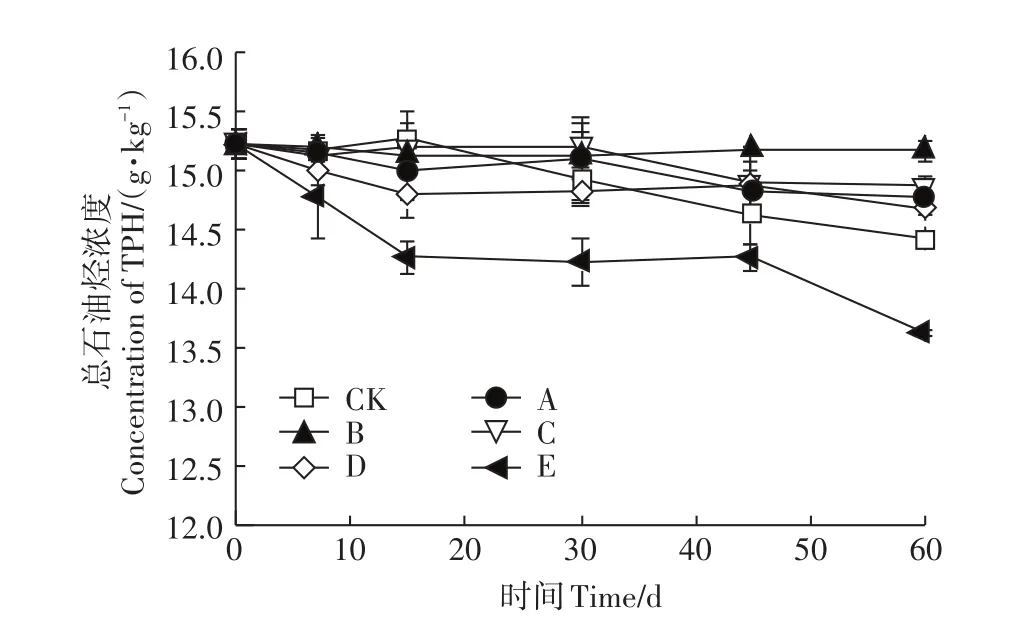
图2 自然湿度(5.4%)条件下接种量对石油烃去除的影响Figure 2 The effects of MC inoculation amount on petroleum hydrocarbon removal under 5.4%natural moisture
15.0 %湿度条件下,A′、B′、C′、D′、E′处理中,总石油烃含量由15 233 mg·kg-1分别降低至12 867、13 400、14 200、12 389、12 511 mg·kg-1,石油烃去除率分别为15.54%、12.04%、6.78%、18.67%、17.87%。未接菌的CK’土壤中总石油烃含量降低至13 833 mg·kg-1,石油烃去除率为9.19%(图3)。因此,当保持土壤湿度为15%时,除接种量为105cfu·g-1的土样外,经过60 d的生物强化,土壤中总石油烃残留量均低于CK’。接种量为105cfu·g-1时的石油烃去除率最低,可能是由于此时降解菌在土壤中虽然有一定的生长,但是没有生长为优势菌,而且此时的生长量抑制了土著降解菌的活性,因此使得石油烃去除率最低。
对不同湿度土壤中石油烃的去除效果进行比较分析,见图4。土壤湿度为15.0%时对石油烃的去除效果总体上好于自然湿度下的修复处理。
湿度是影响微生物生长和活性的重要条件。水分过高或过低均可使土壤微生物活性降低[29]。一些研究结果表明,土壤湿度为12%~20%时,微生物活性最强,有利于对石油烃的降解。湿度过高会使土壤透气性变差,影响降解菌对石油烃的代谢功能[30]。本文的研究结果表明,与自然湿度下接种相比,在保持土壤湿度15%条件下进行接种修复,对土壤微生物多样性的影响较小,石油烃的去除率相对较高。因此,在对石油污染土壤进行生物强化修复时,适当的土壤含水率有利于石油烃的降解。
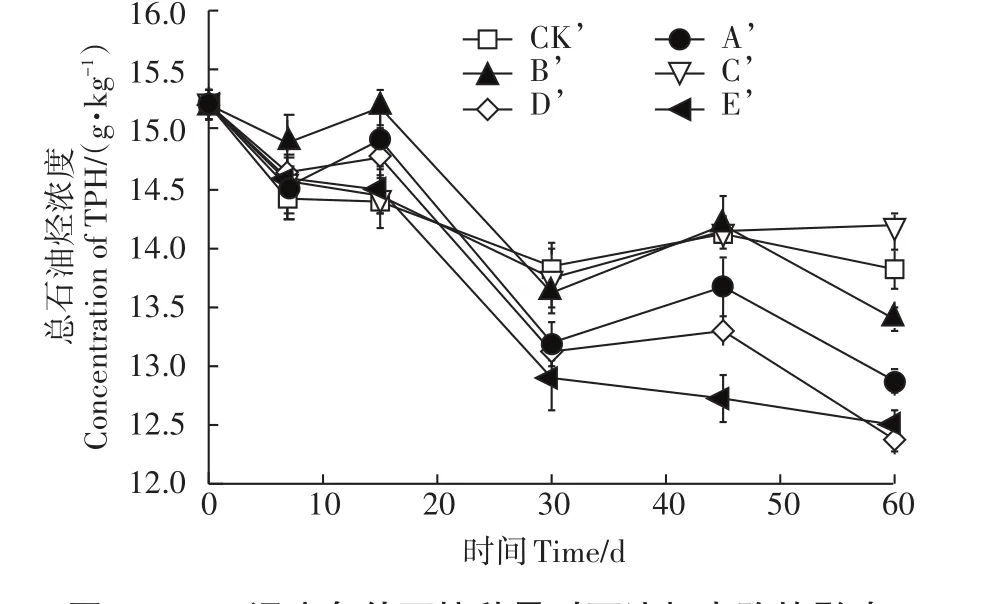
图3 15.0%湿度条件下接种量对石油烃去除的影响Figure 3 The effects of MC inoculation amount on petroleum hydrocarbon removal under 15.0%moisture

图4 不同湿度条件土壤修复60 d的总石油烃去除率Figure 4 TPH degradation efficiency under different humidity conditions at 60 d of bioremediation
本研究筛选出MC降解菌群在水相中对原油具有很好的降解性能,摇瓶实验中,经过30 d的生物降解,MC菌群对水相中石油烃去除率达到89.28%,该结果未在本文中显示。当向石油污染土壤中接种MC菌群进行强化修复处理时,土壤石油烃最高去除率仅为18.67%。
在以前的研究中,向黄土壤中接种其他降解菌群修复8周,石油烃去除率达到58%[19];接种单一石油烃降解菌AcinetobacterSZ-1 strain KF453955修复10周,对土壤中石油烃的去除率为34%[20]。这些结果说明生物强化修复的石油烃去除效果可能受到多种因素的影响,外源菌与土著功能降解菌之间可能存在某种特殊的平衡交互作用。
2.3 降解菌群在不同接种条件下的生长及对土著菌群的影响作用
在修复的第7 d和第60 d,采集两种湿度条件下对石油烃去除效果较好的土壤样品(E和D’)和对照组(CK和CK’组)土壤样品,进行高通量测序分析,研究降解菌群在不同湿度条件下的生长存活情况及其对土壤土著菌群的影响作用。
2.3.1 菌群的alpha多样性
Ace和Chao1指数表征土壤微生物的丰富度,其值越大,土壤微生物的丰富度越大。Shannon指数和Simpson指数表征土壤菌群的均匀度,Shannon指数值越大,Simpson指数越小,土壤微生物的均匀度越高[31-32]。
表2为不同处理土壤的微生物多样性测定结果。从土壤样品E7、E60、D′7、D′60、CK60及CK′60中测得的有效序列数分别为76 434、67 486、68 120、72 392、64 923、73 632。自然湿度条件下向土壤中接种降解菌群进行修复7 d(E7)和60 d(E60)时,土壤的Shannon指数为3.66和3.09,Simpson指数为0.13和0.19,ACE指数为9 653.19和7 842.22,Chao1指数为7 187.33和5 597.03。Shannon指数、Chao1指数和ACE指数在所测土壤样品中均最小,Simpson指数最大,说明在自然湿度条件下对污染土壤进行接种强化修复处理,可使土壤微生物群落多样性明显降低。
与CK′60相比,D′7和D′60土壤样品的Shannon指数和ACE指数有所降低,但降低程度小于自然湿度条件下的接种处理。
本研究中,接种降解菌群进行生物强化修复使土壤微生物的均匀度和丰富度降低,与我们前期研究所得结果基本一致[21,33]。本研究结果表明,在提高土壤湿度的条件下进行接种修复,可以使土壤微生物多样性保持较为稳定的状态。
2.3.2 土壤微生物群落组成变化
2.3.2.1 降解菌在土壤中的生长情况和土壤中门水平微生物群落组成
图5为MC菌群和土壤中12种主要菌门的相对丰度,其余菌门相对丰度合并为Others。土样CK60、E7、E60、CK’60、D’7、D’60中的细菌门数量分别为28、28、23、28、26、26。CK60土壤中主要优势菌门为变形菌门(Proteobacteria,28.22%)、放线菌门(Actinobacteria,21.97%)、酸杆菌门(Acidobacteria,14.88%)、浮霉菌门(Planctomycetes,10.09%)。E7和E60土壤中,变形菌门(Proteobacteria)相对丰度增加至66.35%和70.24%。放线菌门(Actinobacteria)相对丰度基本不变,酸杆菌门相对丰度降低为2.85%和2.94%。D’7和D’60土壤中变形菌门相对丰度增加为57.98%和50.22%,放线菌门相对丰度降低至17.96%和24.08%。
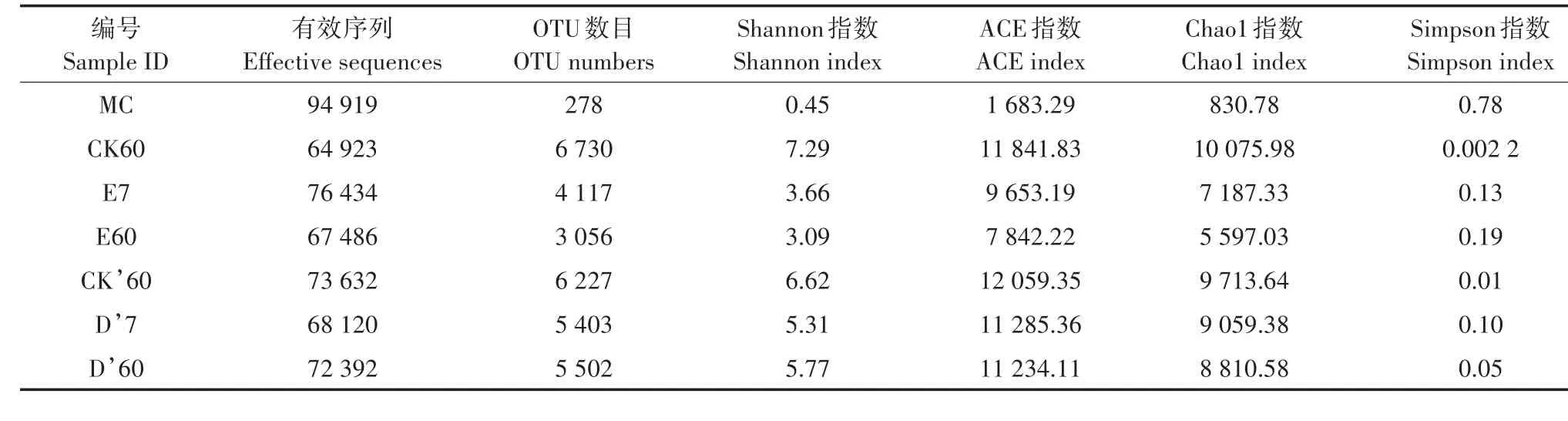
表2 石油烃降解菌群MC和不同修复处理的土壤微生物多样性指数Table 2 Biodiversity index of petroleum-degrading microbial flora(MC)and soils with different treatments
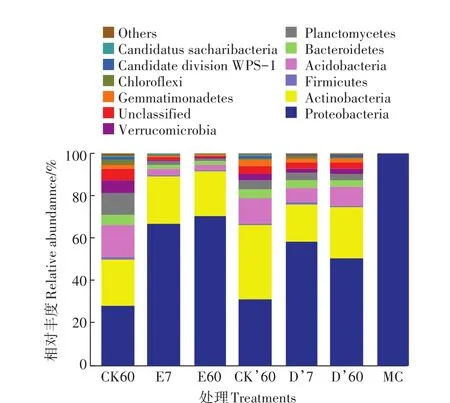
图5 MC菌群和不同处理土壤中优势细菌门水平的相对丰度Figure 5 Relative abundance of the dominant phyla in the MC flora and different treated soils
降解菌群MC中变形菌门(Proteobacteria)相对丰度为99.75%。在两种湿度条件下向土壤中接种MC 7 d时,土壤中变形菌门相对丰度明显增加(图5),说明在不同湿度下接种的降解菌群可在土壤中快速生长,并在较长时间内(60 d)仍然保持存活状态。
2.3.2.2 属水平微生物群落组成结构分析
图6为MC菌群和土壤中前20种优势菌属的相对丰度,其余菌属相对丰度合并为Others。降解菌群MC主要由不动杆菌属(Acinetobacter,87.32%)和假单胞菌属(Pseudomonas,12.00%)组成。CK60土壤中的优势菌属包括Gp6(5.49%)、鞘氨醇单胞菌属(Sphingomonas,4.18%)、Gaiella(3.44%)和芽单胞菌属(Gemmatimonas,2.32%)。
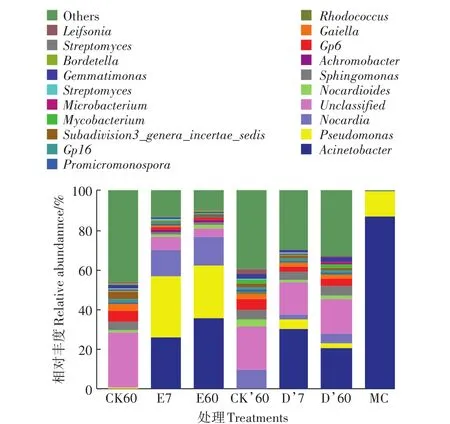
图6 MC菌群和不同处理土壤中优势细菌属水平的相对丰度Figure 6 Relative abundance of the most abundant genera in the MC flora and soils with different treatments
在自然湿度(5.4%)条件下接种MC菌群修复7 d时,假单胞菌属(Pseudomonas,30.87%)、不动杆菌属(Acinetobacter,25.86%)和诺卡氏菌属(Nocardia,13.27%)成为土壤中的优势菌属。修复60 d后,这3种菌属仍为优势菌。其中,不动杆菌属(Acinetobacter)相对丰度增加至35.74%,假单胞菌属(Pseudomonas)和诺卡氏菌属(Nocardia)相对丰度基本保持不变。
在土壤湿度为15.0%条件下接种MC菌群修复7 d时,不动杆菌属(Acinetobacter,30.25%)和假单胞菌属(Pseudomonas,5.03%)成为优势菌属。修复60 d时,不动杆菌属(Acinetobacter)和假单胞菌属(Pseudomonas)仍为土壤中的优势菌属,但与修复7 d时相比,相对丰度降低。
降解菌群MC主要由不动杆菌属(Acinetobacter,87.32%)和假单胞菌属(Pseudomonas,12.00%)组成。在自然湿度和15.0%湿度条件下接种石油烃降解菌群修复7 d,不动杆菌属和假单胞菌属成为土壤中的优势菌属。说明接种的降解菌可在土壤中迅速生长,且其生长不受土壤湿度的影响。假单胞菌属在自然湿度土壤中的相对丰度较大,说明假单胞菌属适宜在湿度较低的土壤中生长。
3 结论
(1)从陕北延长某地区石油污染黄土壤中筛选出的石油烃降解菌门主要为变形菌门(Proteobacteria,99.75%),主要菌属为不动杆菌属(Acinetobacter,87.32%)和假单胞菌属(Pseudomonas,12.00%)。
(2)自然湿度条件下(土壤湿度为5.4%)降解菌群接种量为108cfu·g-1,15.0%湿度条件下降解菌接种量为107cfu·g-1时,修复60 d的土壤中石油烃去除率分别为10.61%和18.67%,对总石油烃的去除率高于未接种降解菌的控制组(石油烃去除率为5.32%和9.19%),15.0%湿度条件下对石油烃的去除效果好于自然湿度条件下的生物强化修复处理。
(3)不同湿度条件下接种7 d时,降解菌在土壤中生长并成为优势菌。自然湿度条件有利于假单胞菌属(Pseudomonas)的生长。接种60 d时,降解菌在土壤中仍然大量存活。接种降解菌群使土壤微生物多样性降低,在15.0%湿度条件下接种有利于维持土壤微生物多样性不发生明显变化。
