纳米TiO2稳定乳液的制备及其在微胶囊制备中的应用
2021-01-04王森,陈英,2
王 森, 陈 英,2
(1. 东华大学 化学化工与生物工程学院, 上海 201620; 2. 东华大学 生态纺织教育部重点实验室, 上海 201620)
Pickering乳液是一种新型的乳液,与传统的表面活性剂乳化法不同,利用固体纳米颗粒来稳定液滴[1]。用Pickering乳液法制备稳定的乳液,可以减少乳化剂的用量,对人体和环境的影响小[2]。Pickering乳液法应用于微胶囊制备,有利于提高微胶囊壁材的抗渗性和机械强度等物理性质,还有利于微胶囊形成更均匀的球形外观[3-4]。
Pickering乳液的稳定性机制:固体纳米颗粒在油水界面上整齐排列形成薄膜来稳定乳液,形成的薄膜具有空间阻碍作用;经改性的固体纳米粒子吸附在液滴表面,可以增加液滴间的排斥力[5-6]。
纳米TiO2经水杨酸SA改性后,水杨酸中的—COOH与TiO2表面—OH反应形成改性TiO2(TiO2-SA),可改善TiO2粒子在油相和水相中的分散能力[7]。本文采用改性纳米TiO2作为乳化剂,制备Pickering乳液,应用于防蚊微胶囊的制备,采用界面聚合法制备防蚊微胶囊,以杀虫剂NH作为芯材,以聚氨酯为壁材,研究TiO2-SA用量、乳化速度、乳化时间等对微胶囊的影响。并通过对乳液粒径及微胶囊的包埋率、粒径的表征得出防蚊微胶囊的合成工艺。
1 实验部分
1.1 试剂和仪器
杀虫剂NH(95%,山东泰安天颐化工有限公司);聚乙烯醇(PVA)、聚乙二醇400(PEG-400)、二丁基二月桂酸锡、水杨酸,均为化学纯(国药集团化学试剂有限公司);二氯甲烷、乙二醇,均为分析纯(国药集团化学试剂有限公司);乙腈(色谱纯,国药集团化学试剂有限公司);纳米TiO2(25 nm, 99.8%,上海麦克林生化科技有限公司);2,4-二异氰酸甲苯酯(TDI,大于98.0%,梯希爱(上海)化成工业发展有限公司)。
LC2000型液相色谱仪(上海天美科学仪器有限公司);LS-13320型激光粒度仪(美国贝克曼库尔特公司);TM-1000型台式扫描电子显微镜(日立仪器有限公司);X射线光电子能谱仪(美国Thermo-Fisher公司);OLYMPUS CX21型生物显微镜(奥林巴斯株式会社);IKA T18 基本型分散机(艾卡(广州)仪器设备有限公司);Spectrum Two傅里叶转换红外光谱仪(美国铂金埃尔默公司);SHZ-DIII型循环水式真空泵(上海坦泽仪器设备有限公司)。
1.2 纳米TiO2表面改性
将1 g 纳米TiO2加入50 mL饱和水杨酸溶液中,在室温下磁力搅拌30 min,转速800 r/min,形成浅黄色分散液,然后过滤,洗涤,在105 ℃下处理30 min。最后将所得粉末研磨成细颗粒得TiO2-SA[8]。
1.3 微胶囊制备工艺
取一定量的纳米TiO2或TiO2-SA分散在PVA的水溶液中,然后加入一定量的二氯甲烷中,高速剪切搅拌一定时间,制得Pickering乳液。
将聚乙二醇400(总量的1/2)加入到二氯甲烷中,滴加TDI,30 ℃预聚反应15 min,生成预聚体;将芯材溶解在预聚体系中,再滴加溶有乳化剂和PEG-400的水溶液,高速剪切乳化,形成稳定的Pickering乳液。然后在反应体系(TDI与PEG-400的量比为2.5∶1,芯壁的量比为2∶1)中加入适量催化剂,在600 r/min,30 ℃反应2.5 h,加入乙二醇封端反应1 h,形成微胶囊,抽滤,冲洗,烘干。
1.4 测试方法
包埋率测试:将制备的微胶囊充分干燥后准确称取0.100 g 样品放置于试剂瓶中,加入20 mL乙腈(色谱纯)萃取剂。将样品于超声波振荡器中在室温条件振荡60 min,萃取液用0.22 μm大小的有机相过滤膜过滤,然后将其置于2 mL样品瓶中待检测,采用高效液相色谱法(HPLC)测试微胶囊中芯材的有效含量[9],计算微胶囊的包埋率。

粒径测试:称取0.5 g干燥的微胶囊放置于样品瓶中,加入50 mL蒸馏水,再向其中加入几滴乳化剂,超声分散一段时间,采用激光粒度仪对微胶囊粒径进行测试分析。
微胶囊表面形态测试:取一定量的微胶囊在60 ℃条件下干燥一段时间。用无水乙醇分散,超声振荡后滴在铝箔纸上,烘干后将微胶囊样品贴在样品台上,然后喷金,置于台式扫描电子显微镜的腔体中观察微胶囊的表面形态。取一定量的乳液,放置在载玻片上,用光学显微镜观察乳液中液滴的形状和分布。
微胶囊元素测试:准确称取一定量的干燥微胶囊样品,采用X射线光电子能谱仪(XPS)定量分析TiO2-SA及微胶囊表面中的各种元素或基团。
2 结果与讨论
2.1 纳米TiO2改性对乳液稳定性的影响
图1为改性前后纳米TiO2的C1s XPS总能谱图。可以看出,改性后纳米TiO2能谱图中在289 eV增加1个峰。对改性后纳米TiO2的C1s XPS能谱如图2所示可知,第1个峰值(A)在285 eV处,表明有羟基;第2个峰(B)在286.5 eV处,表明有羧基或酯基;第3个峰(C) 在289 eV处,表明有芳香环。说明纳米TiO2和水杨酸反应形成了TiO2-SA。

图1 改性前后纳米TiO2的C1s XPS总能谱图Fig.1 C1s XPS total energy spectrum of modified and unmodified nano-TiO2

图2 改性后纳米TiO2的C1s XPS能谱图Fig.2 C1s XPS spectra of modified nano-TiO2
纳米TiO2和TiO2-SA制备乳液如图3、4所示。

图3 纳米TiO2制备的乳液Fig.3 Emulsion prepared by nano-TiO2.(a)0 h; (b)After 4 h

图4 TiO2-SA制备的乳液Fig.4 Emulsion prepared by TiO2-SA. (a) 0 h; (b)After 4 h

图5 不同TiO2-SA质量分数制备的Pickering乳液显微镜照片(×400)Fig.5 Pickering emulsion microscopy with different TiO2-SA mass fraction
由图3可知,用纳米TiO2制备的乳液放置4 h后发生分层,稳定性差;而用TiO2-SA制备的乳液放置4 h不分层,说明改性可改善纳米TiO2的亲油亲水性能,提高乳液的稳定性。
2.2 TiO2-SA质量分数的影响
2.2.1 TiO2-SA质量分数对乳液性能的影响
用不同TiO2-SA质量分数制备的Pickering乳液的乳液粒径和显微镜照片如表1和图5所示。

表1 不同TiO2-SA质量分数时乳液粒径Tab.1 Emulsion particle size with different TiO2-SA mass fraction
由表1可知,随着TiO2-SA质量分数的增加,乳液的粒径逐渐减小,当TiO2-SA质量分数达到0.75%时,粒径为0.615 μm,高于0.75%后,乳液粒径变化较小。由图5可知,乳液的粒径随TiO2-SA质量分数增加而减小,0.75%时制备的乳液液滴较小,且均匀,高于0.75%,乳液的液滴变化不明显。

图6 不同TiO2-SA质量分数制备的Pickering乳液稳定性Fig.6 Pickering emulsion stability prepared with different TiO2-SA mass fraction. (a)0 h; (b) After 4 h
不同TiO2-SA质量分数制备的Pickering乳液稳定性如图6所示。可知,不同TiO2-SA质量分数制备的Pickering乳液放置4 h后,乳化剂质量分数低于0.75%所制备的乳液发生明显分层,质量分数为0.75%或以上的不发生分层现象,说明TiO2-SA质量分数为0.75%制备的乳液稳定性良好。

图8 不同乳化速度制备的Pickering乳液稳定性Fig.8 Pickering emulsion stability prepared at different emulsification rates. (a) 0 h; (b)After 4 h

图7 不同乳化速度制备的Pickering乳液的显微镜照片(×400)Fig.7 Microscope images of Pickering emulsion prepared at different emulsification rates(×400)
2.2.2 TiO2-SA质量分数对微胶囊制备的影响
TiO2-SA质量分数对制备微胶囊的影响如表2所示。可知,随着TiO2-SA质量分数的增加,微胶囊的平均粒径先减小后增大,在TiO2-SA质量分数为0.75%时,微胶囊的粒径最小为0.797 μm,此时的包埋率最大为 84.02%,TiO2-SA质量分数过少时,不能形成稳定的乳液,从而导致微胶囊的包埋率较低;TiO2-SA质量分数太多,TiO2-SA会在乳液中残留,粒径大小不均,还影响微胶囊的包埋率。

表2 TiO2-SA质量分数对微胶囊制备的影响Tab.2 Effect of TiO2-SA mass fraction on microcapsule preparation
2.3 乳化速度的影响
2.3.1 乳化速度对乳液性能的影响
不同乳化速度制备的乳液粒径如表3所示。可知,随着乳化速度的增加,乳液的粒径逐渐减小,当乳化速度达到8 000 r/min时,粒径为0.631 μm,高于8 000 r/min后,乳液粒径减小不明显。显微镜观察如图7所示。可知,乳化速度为8 000 r/min及以上时制备的乳液液滴较小且均匀。

表3 不同乳化速度时乳液粒径Tab.3 Emulsion particle size at different emulsification rates
不同乳化速度制备的Pickering乳液稳定性如图8所示。
由图8可见,制备的Pickering乳液放置4 h后,乳化速度低于8 000 r/min时,乳液产生明显分层,不稳定;8 000 r/min以上没有发生分层,说明乳液稳定性良好。初步选定乳化速度为8 000 r/min。
2.3.2 乳化速度对微胶囊制备的影响
乳化速度对制备微胶囊的影响如表4所示。可知:微胶囊的粒径随着乳化速度增加逐渐降低,在增加到8 000 r/min后降低不显著;微胶囊的包埋率随着乳化速度增加而增加,在8 000 r/min时包埋率达最高为80.75%,高于8 000 r/min,包埋率反而下降。当乳化速度较低时,形成的乳液不稳定,微胶囊的包埋率较低;乳化速度过高,单体分散过细,其表面自由能高,体系不够稳定,从而使包埋率降低。因此,乳化速度选择8 000 r/min。

表4 乳化速度对微胶囊制备的影响Tab.4 Influence of emulsification rate on preparation of microcapsules
2.4 乳化时间的影响
2.4.1 乳化时间对乳液性能的影响
不同乳化时间时乳液粒径和显微镜照片如表5和图9所示。由表5可知,随着乳化时间的增加,乳液的粒径逐渐减小,当乳化时间达到7 min时,粒径为0.701 μm,高于7 min后,乳液粒径变化不大。显微镜观察(见图9)可知,乳化时间为7 min及以上时制备的乳液的液滴较小且均匀。

表5 不同乳化时间时乳液粒径Tab.5 Particle size of emulsion with different emulsification time
不同乳化时间制备的Pickering乳液稳定性如图10所示。可见,乳化时间少于7 min时制备的Pickering乳液放置4 h后会发生分层,浮液不稳定;乳化时间超过7 min时Pickering则不会产生分层,说明乳液稳定性良好。初步选择乳化时间为7 min。

图9 不同乳化时间制备的Pickering乳液的显微镜照片(×400)Fig.9 Microscope images of Pickering emulsion prepared at different emulsification times(×400)

图10 不同乳化时间制备的Pickering乳液稳定性Fig.10 Pickering emulsion stability prepared at different emulsification times. (a) 0 h; (b) After 4 h
2.4.2 乳化时间对微胶囊制备的影响
乳化时间对制备微胶囊的影响如表6所示。由表可知,微胶囊的粒径随着乳化时间增加逐渐降低,在7 min以后,粒径降低不显著。在乳化时间为7 min时,微胶囊的包埋率最高为80.75%,高于7 min,包埋率略有降低。当乳化时间较短时,形成的乳液不稳定,微胶囊的包埋率较低;当乳化时间过高时,已经乳化的乳液在剪切力的长期作用下可能发生破乳现象,从而使包埋率下降,因此,乳化时间为7 min。

表6 乳化时间对微胶囊制备的影响Tab.6 Influence of emulsification time on preparation of microcapsules
2.5 PVA质量分数的影响
纳米粒子可单独作用稳定乳液体系,还可与表面活性物质复配形成稳定的乳液[10]。PVA是高分子表面活性剂,可降低油水界面的张力,所以研究PVA与TiO2-SA复配形成的Pickering乳液稳定性。
2.5.1 PVA质量分数对乳液性能的影响
不同PVA质量分数制备的Pickering乳液的乳液粒径和显微镜图如表7和图11所示。由表7可知,随着PVA质量分数的增加,乳液的粒径逐渐减小,当PVA质量分数达到1.0%时,粒径为0.624 μm,高于1.0%后,乳液粒径减小不明显。显微镜观察(见图11)可得到同样结果。

表7 不同PVA质量分数时乳液粒径Tab.7 Emulsion particle size at different PVA mass fraction

图11 不同PVA质量分数制备的Pickering乳液的显微镜照片(×400)Fig.11 Microscope images of Pickering emulsion prepared with different PVA mass fraction(×400)
不同PVA质量分数制备的Pickering乳液稳定性如图12所示。可见:不加PVA,乳液立即分层;加入PVA,乳化完成后不分层,放置4 h后PVA质量分数低于1.0%会发生分层,1.0%以上不会产生分层。初步选定PVA质量分数为1.0%。

图12 不同PVA质量分数制备的Pickering乳液稳定性Fig.12 Pickering emulsion stability prepared with different PVA mass fraction. (a) 0 h; (b)After 4 h
2.5.2 PVA质量分数对微胶囊制备的影响
PVA质量分数对制备微胶囊的影响如表8所示。
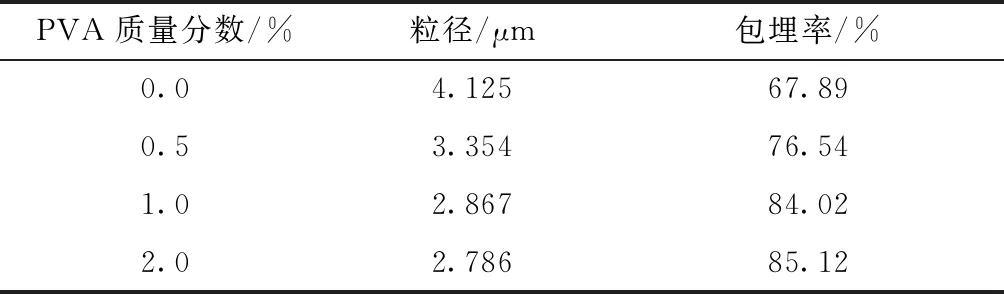
表8 PVA质量分数对微胶囊制备的影响Tab.8 Effect of PVA mass fraction on preparation of microcapsules
由表8可知,微胶囊的粒径随着PVA质量分数增加逐渐降低。微胶囊的包埋率随着PVA质量分数的增加逐渐增加。PVA质量分数较低时,油水相界面张力较高,乳液会发生聚集,从而导致制备的微胶囊粒径较大,包埋率降低,随着PVA质量分数增加,油水界面张力降低,提高了乳液的稳定性,因此制备的微胶囊粒径小,包埋率高。PVA质量分数以1.0%为宜。
综上所述,合成防蚊微胶囊时Pickering乳液制备条件为:TiO2-SA质量分数0.75%,PVA质量分数1.0%,乳化速度8 000 r/min;乳化时间7 min;温度室温。在此条件下制备的微胶囊球形规则,表面光滑,包埋率为84.02%,平均粒径为2.867 μm。
2.6 微胶囊形貌及表面能谱分析
微胶囊扫描电镜照片如图13所示。由图可见,Pickering乳液法制备的微胶囊表面光滑,呈规则球形,大小均匀。

图13 微胶囊扫描电镜照片(×5 000)Fig.13 SEM image of microcapsule(×5 000)
用X射线能谱仪EDS对微胶囊表面各元素含量进行分析得出,采用Pickering乳液法制备的微胶囊表面含C、O、N元素分别为45.39%、31.21%、2.81%,还含有Ti元素20.59%。这表明微胶囊表面含有改性的TiO2-SA。
3 结 论
本文采用改性纳米TiO2-水杨酸(SA)作为乳化剂成功制备出了Pickering乳液并应用于防蚊微胶囊的制备,通过对乳液粒径、微胶囊的包埋率、粒径的表征得出以下结论。
1)纳米TiO2和水杨酸反应形成TiO2-SA,改善了纳米TiO2的亲油亲水性能,可提高乳液的稳定性。
2)Pickering乳液制备条件为:TiO2-SA质量分数0.75%,PVA质量分数1.0%,室温,乳化速度8 000 r/min,乳化时间7 min。制备的乳液粒径小且均匀,稳定性好。
3)用Pickering乳液法制备微胶囊球形规则,表面光滑,包埋率为84.02%, 平均粒径为2.867 μm。微胶囊表面能谱分析表明含有C、O、N和Ti元素。
