石油烃降解菌Pseudomonas sp.及其生物表面活性剂对原油处理效果分析
2021-01-04王卫强吴尚书张海娟
王卫强, 崔 静, 吴尚书, 董 美, 张海娟
(辽宁石油化工大学 石油天然气工程学院,辽宁 抚顺 113001)
原油在管道输送过程中,蜡组分常常会因为环境温度降低而结晶析出[1],导致管道输送半径变小,情况严重会造成凝管停运;此外,若原油黏度过大,则流动性较差,输送成本大大提高。针对原油输送过程中所带来的问题,20世纪80年代,以美国为代表的西方国家将微生物技术应用到石油开采运输中[2]。微生物能够以原油中的蜡分子为碳源,其生长代谢过程就是对烷烃的降解过程,削弱蜡晶结构强度,从而降低原油的黏度及蜡含量,提高原油流动性;同时,有些菌株在生长代谢过程中产生生物表面活性物质,易吸附在微小蜡晶表面,防止蜡晶之间互相聚集、长大和沉积,从而起到防蜡作用[3-4]。因此,微生物清防蜡技术在原油开采及运输过程中具有重要意义。
综上所述,微生物技术作用于原油中有多方面效果,可以降解原油中的脂肪烃,降低原油凝点、黏度及蜡含量。笔者从受石油污染土壤中筛选出1株能够降解石油烃类的W12#菌株。对该菌株进行16S rRNA基因序列比对鉴定,测试其是否产生表面活性物质,鉴定细胞表面对烃类的黏附性以及对正十六烷烃的乳化性能;通过菌株与原油作用,测定原油中的蜡含量、黏度及粒径变化,进一步证明W12#菌株对原油的除蜡降黏作用,以期提高原油流动性。
1 实验部分
1.1 实验原料
1.1.1 菌株与原油
从辽河油田附近长期经受石油污染土壤中筛选出1株以液体石蜡为唯一碳源,产生表面活性物质的菌株,命名为W12#。菌株于4 ℃保存。
实验所用原油取自于辽河油田。
1.1.2 试剂与仪器
胰蛋白胨、MgSO4·7H2O、K2HPO4、KH2PO4、NaCl、NH4Cl、琼脂粉、三氯甲烷、甲醇、Urea、Tris硼酸(TEB),均为AR,国药集团化学试剂有限公司;液体石蜡,CP,国药集团化学试剂有限公司;酵母浸粉,生物试剂,北京奥博星生物技术有限责任公司;NaNO3,AR,天津市恒兴化学试剂制造有限公司;正十六烷烃,AR,北京百奥莱博科技有限公司;乙醇,CP,国药集团化学试剂有限公司;戊二醛,生化试剂BR,国药集团化学试剂有限公司;裂解液,生物试剂,日本TaKaRa公司;磷酸盐缓冲液(PBS),国药集团化学试剂有限公司;琼脂糖凝胶,国药集团化学试剂有限公司;Super DNA Marker(含有Buffer和Marker溶液),上海研谨生物科技有限公司。
CF-B-10H生化仪配套纯水机,四川德立世科技有限公司;SHZ-82水浴恒温振荡器,江苏金坛市环宇科学仪器厂;Z326K高速冷冻离心机,德国贺默公司;Vortex-5涡旋振荡器,Kylin-bell公司;梯度PCR仪,德国Eppendorf公司;UV-2550紫外分光光度计,上海科恒实业发展有限公司;Q2000 DSC差示热量扫描仪,美国TA公司;HAKKE流变仪,上海珩璟科技有限公司。
1.1.3 培养基
无机盐培养基:去离子水1000 mL,K2HPO41 g,KH2PO41 g,MgSO4·7H2O 0.5 g,NaCl 5 g,NH4Cl 1 g, NaNO31 g。
Luria-Bertani (LB)液体培养基:超纯水1000 mL,胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g。
LB固体培养基:由LB液体培养基中添加15%琼脂得到。
液体石蜡培养基:超纯水1000 mL,NaCl 5 g,NH4Cl 1 g,MgSO4·7H2O 0.25 g,KH2PO41.25 g,K2HPO41.25 g,NaNO32 g,液体石蜡1 mL。
PUM缓冲液:超纯水1000 mL,K2HPO422.2 g,KH2PO47.26 g,Urea 1.8 g,MgSO4·7H2O 0.2 g。
以上培养基的制备条件:压力,0.105 MPa;温度,121 ℃;时间,20 min。
1.2 W12#菌株代谢产物——表面活性物质的分析
1.2.1 排油圈实验
排油圈实验可以比较直观地反映样品的表面活性能力[11]。排油圈法中常使用油相有橄榄油、机用柴油和液体石蜡[12]。这些油相与水相颜色差别不大,效果图不明显。笔者对排油圈检测方法进行了改进,改进后以原油为油相。将W12#菌发酵液经离心机离心,取100 μL上清液备用;取30 mL的超纯水置于90 mm的培养皿中,滴入1 mL已预热到40 ℃的原油,当原油均匀地平铺在水面形成一层薄膜之后,滴加上清液,观察是否产生排油圈,若产生排油圈,则表明W12#菌株产生表面活性物质[13]。
1.2.2 W12#菌株对石油烃的黏附性(BATH)测试
BATH测定法用于测量菌株对正十六烷作为底物的细胞表面疏水性[14],表示细胞对疏水性的黏附百分比。借鉴Zhou等[15]和Bharali等[16]对细胞疏水性的测定方法,并根据实验需求进行改良。
将W12#菌株培养至对数期后,取其发酵液经离心机离心,去除上清液,得到已分离出的细胞;加入PUM缓冲液对细胞外物质进行清洗,摇匀,获得菌悬液,备用。以PUM缓冲液为空白,将菌悬液的光学密度(OD400 nm)调试至(0.3~0.6)。取 1 mL 的菌悬液于1.5 mL离心管中,加入0.2 mL的正十六烷烃至离心管中,于25 ℃下温育5 min,剧烈振荡60 s,室温静置1 h后进行相分离,用移液枪快速从离心管菌悬液层吸取200 μL于比色皿中,采用UV紫外分光光度计在400 nm的波长下测量菌液的光学密度OD。通过测量菌悬液初始的光密度值以及处理后菌悬液的光密度值,计算生物体的细胞表面疏水性y。
y=(1-a/b)×100%
(1)
式中:y为细胞疏水性,%;a为初始菌液的OD400 nm值;b为终末菌液的OD400 nm值。
1.2.3 W12 #菌株对烷烃的乳化实验
根据Parhamfar等[17]的实验经验对测量表面活性物质的乳化活性进行改进。取4 mL液体石蜡和等体积的菌发酵液上清液置于离心管中,涡旋振荡器充分振荡2 min,25 ℃条件下静置24 h。采用式(2)计算乳化指数(Emulsification index,E24)[18]。
(2)
式中:h为乳化层高度,cm;H为混合液体总高度,cm。
1.2.4 W12#菌株代谢产物的鉴定
将10 mL已培养的菌发酵液置于高速冷冻离心机,4000 r/min条件下离心20 min,取出上清液,溶于10 mL三氯甲烷与甲醇混合液(V(三氯甲烷)/V(甲醇)=2/1)中进行萃取。将萃取后的液体置入44 ℃的烘箱中烘干,称取烘干后样品的质量,即为W12#菌株代谢产物的质量。将1 mg代谢产物与100 mg KBr混合研磨,压片,通过THermo公司的iS10傅里叶红外光谱仪在400~4000 cm-1波数内检测。
1.3 W12#菌株形态结构观察及鉴定
1.3.1 W12#菌株形态结构观察
在LB固体培养基中进行平板划线,观察菌落形态。
将W12#菌发酵液经高速冷冻离心机离心分离出菌株,采用日本日立公司的S-4800扫描电镜观察菌株形态。扫描电镜样品制备前期工作[19]:取2 mL的菌发酵液在1000 r/min下离心分离,去除上清液,使用pH值7.2~7.4的0.1 mol PBS缓冲液清洗2次,每次15 min;菌株经清洗后立即加入戊二醛溶液(V(戊二醛)/V(水)=2.5/97.5)内固定4 h,用V(乙醇)/V(水)分别为30/70、50/50、70/30、80/20、90/10的乙醇溶液对样品进行脱水,不同体积比乙醇溶液脱水 15 min;在乙醇中脱水2次,每次15 min;第2次做真空冷冻干燥24 h。
1.3.2 W12#菌株鉴定
取50 μL裂解液置于离心管中,从LB平板上取W12#菌株加入离心管中,密封,离心,置于恒温水浴锅中,在80 ℃下加热15 min,取出,再微离心。以16S rDNA为目的基因,设计通用引物进行PCR扩增,扩增在Mastercycler上进行。
正向引物为27F,反向引物为1492R。聚合酶链反应(PCR)的反应体系如表1所示。反应条件如表2所示,其中变性(Denaturation)、退火(Annealing)、延伸(Extension)过程循环30次。
用质量分数为1%的琼脂糖凝胶置入25 mL TBE溶液,振荡均匀,置于微波炉中加热2 min,倒入已经插好梳子的配胶槽中,冷却30 min。将PCR 产物取出,准备Marker溶液;将胶板取出,置入电泳仪;用移液枪取6 μL Buffer溶液均匀滴成2个点,取5 μL Marker溶液加入第1个点,第2个点加入5 μL PCR产物,即3 μL Buffer+5 μL Marker/PCR 产物。取各点溶液吹打均匀后加入凝胶板孔中,打开电泳仪,电泳30 min。通过电泳检测确定目的片段长度,将PCR扩增产物交由上海美吉生物医药科技有限公司进行16SrDNA测序。通过Blast软件将获得的基因序列与GenBank中的核酸序列进行相似性比较,用MEGA 7.0构建系统发育树[20]。

表1 聚合酶链反应体系Table 1 PCR system
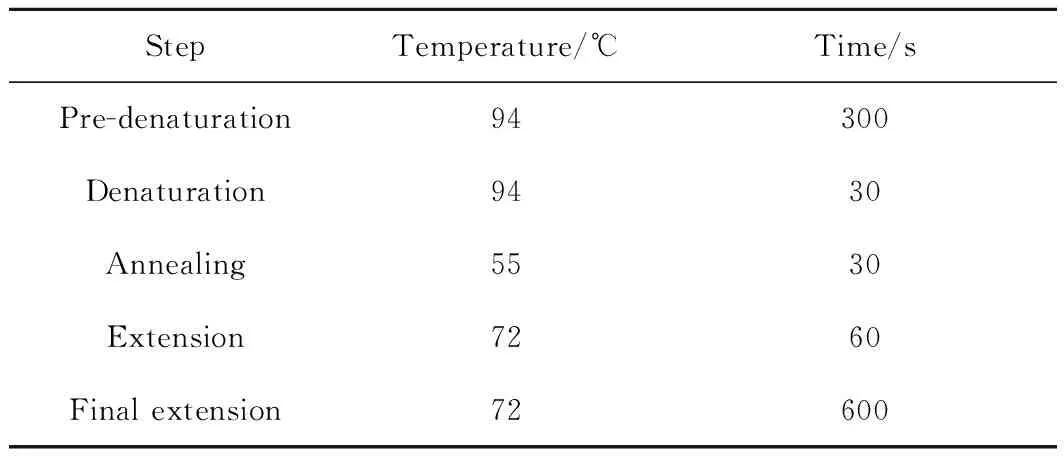
表2 聚合酶链反应条件Table 2 PCR reaction conditions
1.4 W12#菌株对原油处理效果检测
将W12#菌株以3%的接种量接种于100 mL的基础培养基中,加入50 mL的原油,置于水浴恒温振荡器中振荡培养7 d,测定原油蜡含量、黏度与分子粒径的变化。实验环境:40 ℃,150 r/min。
2 结果与讨论
2.1 W12#代谢产物——生物表面活性剂的分析结果
2.1.1 排油圈实验结果
将W12#菌株的上清液加入到油膜中,油膜向四周排开,结果如图1所示。通过Nano measure测量所得,排油圈直径为57.47 mm,证明W12#菌株代谢产生表面活性物质,可提高原油中不溶性化合物的溶解度,增加菌株与原油接触面积[21]。
2.1.2 W12#菌株对正十六烷烃的黏附性
细胞表面疏水性是决定碳氢化合物与细胞表面黏附性的主要因素。实验结果表明,W12#菌株的细胞表面疏水性为89.55%,说明该菌株具有非常高的表面疏水能力,对原油的亲和力高于对水亲和力,对烃的黏附性较强[22],易附着于疏水性物质表面。这有助于微生物在疏水性底物上生长并提高其生物利用度[23-25],从而有利于改善储层和地面设施的烃降解。与Mishra等[26]所研究铜绿假单胞菌在加入十六烷烃的无机盐培养基中的细胞疏水性的结果相一致。

图1 排油圈Fig.1 Oil-displacement activity(a) Untreated oil sample;(b) Oil spreading enclosure formed by W12 #
2.1.3 W12#菌株对烷烃的乳化作用
W12#菌株与液体石蜡混合,静止24 h后可观察到明显稳定的乳化层,结果如图2所示。

图2 W12#菌株乳化效果Fig.2 Emulsification effect of the strain W12#(a) Untreated sample; (b) After treatment by W12#
通过式(2)计算E24,W12#菌株的乳化层高度及E24如表3所示。由表3可知,W12#菌产生的表面活性物质具有良好的乳化性能,可将石油烃乳化到基质中,并形成稳定的乳状液,使菌发酵液与石蜡充分接触,加快石蜡降解[27]。
2.1.4 代谢产物鉴定
W12#菌株代谢产生的表面活性物质的红外吸收光谱如图3所示。由图3可知,W12#菌株代谢产生的表面活性物质中存在糖脂的典型峰。3144.16 cm-1为N—H键的伸缩振动峰;2923.73 cm-1和2858.57 cm-1为脂肪族的—CH2—的对称拉伸振动;1642.89 cm-1为酰胺的CO—N键拉伸振动,属于脂肽;1389.25 cm-1处为—CH3基团做不对称形变振动;1154.85 cm-1处为糖环缩醛结构C—O—C的振动;证实糖脂存在。971.75 cm-1为C—O键伸缩振动造成。与Sakthipriya等[28]实验结果相一致,证明W12#菌株代谢产生的表面活性物质为糖脂类。
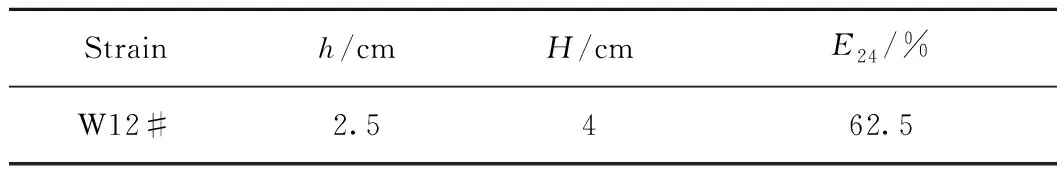
表3 W12#菌株的乳化能力测定Table 3 Determination of emulsification capability of W12#
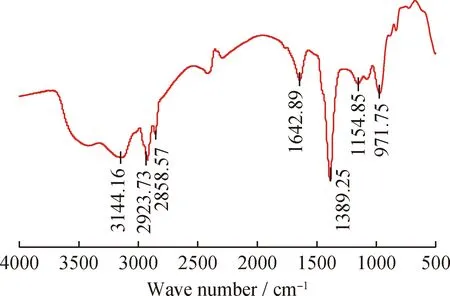
图3 W12#菌株代谢产物的红外吸收光谱图Fig.3 FT-IR spectrum of metabolites of the strain W12#
2.2 W12#菌株的形态观察及鉴定结果
2.2.1 W12#菌株的形态观察
W12#菌株的形态如图4所示。由图4(a)可见,W12#菌株在LB固体培养基中的生长情况,在LB固体平板上,菌株W12#呈油滴状,米黄色,表面光滑。由图4(b)可知,W12#菌株呈长杆状,无鞭毛,边缘光滑湿润,大小为(0.5~0.7) μm×(3~3.5) μm。
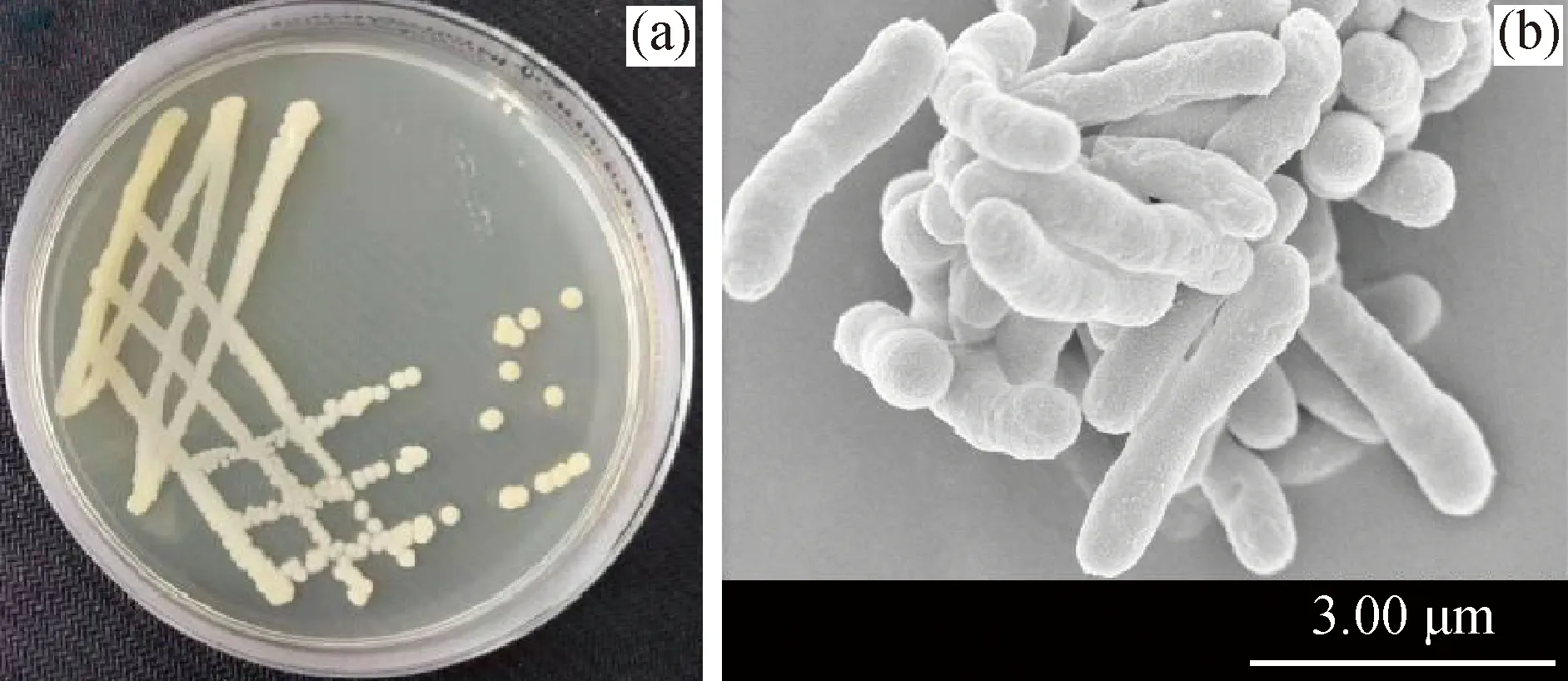
图4 W12#菌形态Fig.4 Morphology of W12# strain(a) Colony morphology on LB medium; (b) SEM image
2.2.2 W12#菌株16S rRNA鉴定结果
经过16S rRNA测定,W12#菌株的目的基因片段长度为1050 bp。经过与NCBI数据库进行BLAST对比可知,该菌株属于假单胞菌(Pseudomonassp.),其GenBank序列号为MF948933.1,同源性达到99.9%。W12#菌系统发育树如图5所示。

图5 菌株W12#的系统进化树Fig.5 Phylogenetic tree of W12#
2.3 W12#菌株对原油作用效果分析
2.3.1 W12#菌株对原油中蜡的影响
采用差示扫描量热仪测定经W12#菌株处理后原油的含蜡量、析蜡点[29],结果列于表4。由表4可知,经W12#菌株作用后,原油的析蜡点、析蜡峰点和析蜡潜热均下降,原油的蜡含量降低。W12# 菌株能够以原油中的长链烷烃为碳源进行生长代谢,长链烷烃的减少有助于削弱蜡析出后形成的蜡晶网状结构强度,从而使原油中的蜡含量降低;同时,W12#菌株在代谢过程中产生表面活性物质,吸附在蜡晶表面上,增加蜡晶表面的疏水性,不利于蜡晶积聚,使蜡晶保持细小状态,阻止或减弱微小蜡晶之间互相聚集、长大和沉积,从而起到防蜡作用[30]。

表4 原油经W12#菌株处理前后蜡的变化Table 4 Wax changes of the oil sample with W12# treatment
2.3.2 W12#菌株对原油黏度的影响
采用流变仪对W12#菌株处理前后原油黏度进行测量,原油黏度变化及降黏率如图6所示。由图6可见,在W12#菌株处理前,原油非牛顿流体温度段的黏度范围为7.49~78.98 mPa·s;处理后,该温度段黏度范围下降至4.9~50.47 mPa·s,原油降黏率随温度升高而提高,当温度达到40 ℃时,原油降黏率最高,为63.75%。而当温度高于40 ℃时,原油降黏率开始降低,黏度变化甚微。20~40 ℃温度范围内,原油属于非牛顿流体,此时,菌株随温度升高而生长能力增强,因此对原油处理效果增强;而当温度高于40 ℃时,超过菌株生长的最适温度范围,高温破坏菌株的细胞结构,使菌株失活,对原油处理效果降低。温度本身会对原油黏度产生影响,当温度升高时,原油黏度降低,但是下降幅度偏小。
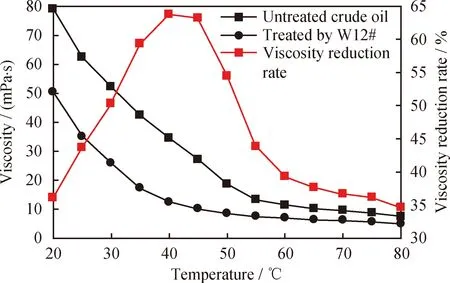
图6 原油经W12#菌株处理前后黏度变化及降黏率曲线Fig.6 Profiles of viscosity changes and viscosity reductionratio for the crude oil treated with W12#Shear rate: 27 s-1
微生物影响原油黏度,一方面是因为微生物在生长过程中利用石油中的长链烃作为碳源,将原油中的大分子烃转化为小分子烃,降低原油黏度[7,31];另一方面,菌株在代谢作用下产生的表面活性物质有润湿及乳化作用,乳化原油中烷烃分子,可以降低原油的黏度,增加其溶解度,改善原油的流动性[28,32]。
2.3.3 W12#菌株对原油组分粒径的影响
采用FBRM监测原油经W12#菌株处理后形成O/W乳状液分散相的粒径分布变化。为了排除温度因素对蜡晶的干扰,考虑到选用的温度应高于原油析蜡点,最终本次实验温度设定为50 ℃[33-34]。
原油经W12#菌株处理前后的分散相粒径分布变化如图7所示。由图7可见,经W12#菌株处理后,原油在40~60 μm区间的粒径所占的比率均低于2%;在60~100 μm区间的粒径所占比率最少,且均不超过1%;处于1~50 μm区间的粒径大幅度增加,最高比率达到8%,远远高于对照油样。而大于50 μm的粒径所占的比率由原来的3%降为1.5%,尤其是在60~100 μm区间的粒径,其长链烃几乎被完全降解。
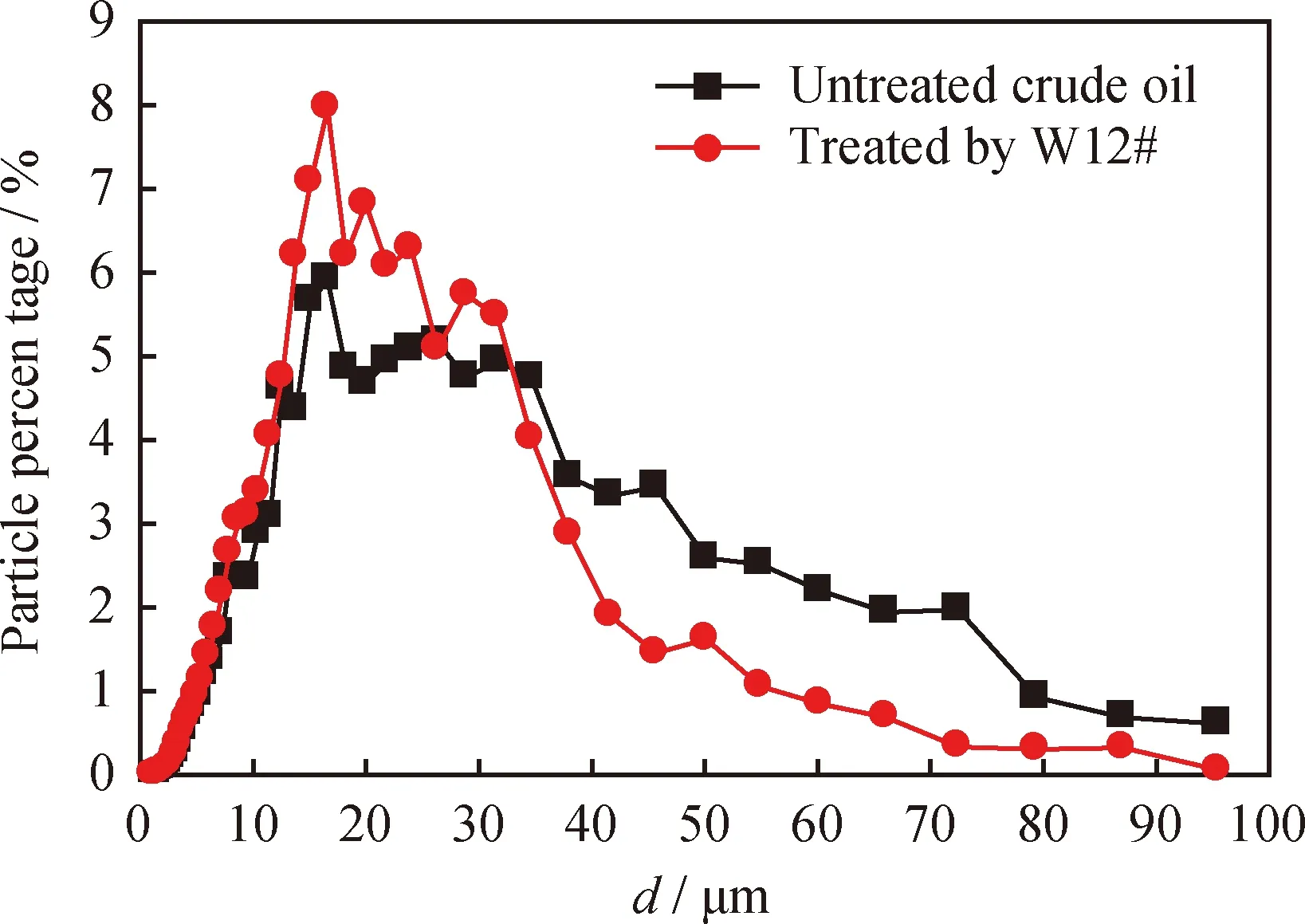
图7 原油经W12#菌株处理前后的粒径分布Fig.7 Chord length distribution of the crude oil before andafter W12# treatmentTemperature: 50 ℃; Rotation rate: 300 r/min
这一方面是由于微生物的直接降解,将原油中的大分子烃降解成小分子烃,使原油的粒径尺寸减小;另一方面,微生物代谢产生表面活性物质,对石油烃类物质起到增溶分散的作用[35-36],使得石油烃类物质乳化成更细小的颗粒,更利于微生物的附着降解。
3 结 论
(1)从辽河油田石油污染土壤中筛选出一株能够除蜡降黏的W12#菌株,经16S rRNA进行测定,该菌株为假单胞菌。
(2)W12#菌株在生长代谢时产生表面活性物质,能够形成排油圈;W12#菌株疏水性高达89.55%;W12#菌株和液体石蜡混合后,形成明显稳定的乳化层,乳化指数为62.5%。经傅里叶红外光谱测定,代谢产物为糖脂类物质。
(3)原油经W12#菌株处理后,析蜡点、析蜡峰点以及析蜡过程中释放的析蜡潜热均降低;同时,蜡含量明显降低,除蜡率为34.66%;原油在 20~40 ℃ 黏度由7.49~78.98 mPa·s降低至4.9~50.47 mPa·s,在40 ℃下,原油降黏率达到63.75%; W12#菌株可以起到除蜡降黏提高原油流动性的作用。
