长白山源头溪流底栖动物生活型及群落结构的时空特征
2021-01-04谭颖王璐宫雨薇陈鸽张振兴杨海军
谭颖, 王璐, 宫雨薇, 陈鸽, 张振兴, 杨海军,2,3,*
长白山源头溪流底栖动物生活型及群落结构的时空特征
谭颖1, 王璐1, 宫雨薇1, 陈鸽1, 张振兴1, 杨海军1,2,3,*
1. 东北师范大学草地科学研究所植被生态科学教育部重点实验室, 长春 130024 云南大学高原湖泊生态与治理研究院, 昆明 650500 3. 伊犁师范大学生物与地理科学学院, 伊宁 835000
底栖动物是山地溪流生态系统的关键生物类群, 其群落组成结构与时空分布在很大程度上依赖于组成物种的生活型以及生活型构成。为认识我国高纬度地区山区底栖动物群落结构与环境的关系, 以长白山龙湾自然保护区的典型源头溪流为对象, 在春、夏、秋三个季节对五个断面进行定量样品采集, 结合溪流生境信息初步分析了源头溪流中不同生活型底栖动物的分布以及时空动态。共采集到底栖动物4525头, 隶属于5纲11目35科82属, 其中水生昆虫以78属占有绝对优势, 优势种类包括属一种、直突摇蚊亚科一种(Orthocladiinae sp.)、属一种、纹石蛾一种(sp)、弓石蛾一种(sp.)和钩虾属一种(sp.); 底栖动物的生活型相对丰度表现为固着型最高, 其次为蔓生型和穴居型, 游泳型最少, 分别为50%、25%、17%和8%; 人为活动显著降低了底栖动物的密度、多样性和物种丰富度, 其中固着型和蔓生型底栖动物反应最为敏感。因此, 在源头溪流, 人为干扰对底栖动物群落结构影响显著, 生活型组成较物种组成对干扰的响应更为敏感。
山地溪流; 底栖动物; 群落结构; 生活型; 人为干扰
0 前言
底栖动物是指生活史的全部或大部分时间生活于水体底部的动物群, 是河流生态系统中最常见的水生生物类群。底栖动物取食底栖藻类、有机碎屑以及浮游生物等, 同时本身又被其他鱼类和鸟类等摄食, 对河流生态系统的物质循环、能量流动具有不可替代的作用[1-3]。
底栖动物群落分析, 通常基于物种的分类进行多样性的计算与评估[4]。Poff基于底栖动物的分类与生态属性的大规模调查, 认为摄食类群和生活型分类能更好的认识生物在生态系统中的位置, 比基于物种分类的群落分析更能揭示群落的构建、维持与功能, 更有利于了解底栖动物对河流环境的响应[5]。生活型是生态属性中最重要的类型之一, 指底栖动物长期适应不同环境或相同环境, 所表现出的外部特征与生活习性。一个群落中物种的不同生活型的组成和分布反映了底栖动物为适应生境所进行的物种组装或群落构建[6], 因此, 对群落中物种的生活型进行划分将提供底栖动物群落结构与功能和基础信息, 可以了解底栖动物对河流水质与生境的适应性[7]。林良羽等人的研究结果表明, 在几种底栖动物的不同分类方式中基于生活型的分类群落结构差异最显著[8]。国外关于底栖动物的生活型已有大量的研究, 如Poff等人对北美水生昆虫生活型的划分及调查[5], Maxted等人在运用底栖动物对大西洋中部沿岸平原河流进行评估时将生活型作为一项指标[9]。在我国, 也有一些学者对底栖动物生活型进行了研究[10-12], 但主要针对海滩、河口、红树林区域的研究, 而对淡水溪流的研究相对较少。高海拔源头溪流通常具有独特的地理地势条件和很高的生境异质性[13-14], 能够为多种类型的底栖动物提供更为复杂的生存环境, 从而维持较高的生物多样性[15-16]。
长白山源头溪流地处我国高海拔、寒冷区域, 是松花江水系的源头, 对维持整个流域的结构和功能健康起到关键的作用, 然而目前对该地区的溪流生态学研究仍很少, 缺少有关这些底栖动物生活型的基本数据。本研究首次对长白山典型的源头溪流底栖动物进行定量采样, 基于底栖动物的生活型对群落结构进行分析, 初步揭示该地底栖动物各生活型的组成、数量以及时空动态特征, 探讨不同程度人为干扰对底栖动物群落结构的影响, 为了解我国高海拔、寒冷地区底栖动物生活型特征及其主要影响因子提供相关数据及基础, 以期为长白山松花江及我国东北地区其它水系的生态评价及修复提供参考数据。
1 研究地概况及研究方法
1.1 研究地概况
调查的溪流位于吉林省通化市辉南县的龙湾自然保护区内, 地处长白山北麓龙岗山脉中段。保护区内分布榆树岔河、大坦平河、后河三条河流, 其中最大的一条河流是后河, 它的上游分为南北两支(下称南河和北河), 发源自保护区东南部的鸡冠山, 最终在吴家趟村汇合。南河为近自然河流, 两岸郁闭度高, 人为干扰较小, 能较好的反应源头溪流生境状况, 北河流经人口稠密地区, 两岸土地利用类型以农业和居民用地为主, 河流生境破坏严重。该地属于北温带大陆季风气候, 研究区内年平均气温4.1 ℃, 年平均光照2550 h, 年平均蒸发量1276.1 mm, 年平均降水量704.2 mm。冬季漫长而寒冷, 11月下旬至翌年4月上旬为结冰期, 冰下水体仍具有流动性, 平均水温约为0.5 ℃。
为了反映长白山源头溪流的生物状况, 采样点的设置包括了南河小流域河流的5个断面。断面N1—N3位于吊水壶风景区上游, 受人为干扰影响较小, 断面N4、N5位于吴家趟村内, 农业污染、挖掘河道等人为影响。断面之间间隔不少于1000 m, 详细样点布设图如图1。
1.2 底栖动物采集及鉴定
由于冬季11月下旬至3月下旬断面N2-N5冰层较厚, 无法凿穿取样, 于2017年10月25日(秋末)、2018年5月26日(春季)、2018年9月7日(夏末), 进行3次样品采集。采集时分别在每个断面中选取不同微生境的样点。每个断面中样点数在3-6个之间, 使用网径为40目的索伯网, 索伯网的采样面积0.09 m2。采样时将准备好的索伯网固定在采集点水流的下方, 用毛刷刷洗采样点中的石块, 使用采样铲将搅动底质, 使底栖动物顺着水流方向流入孔径40目的收集网中。采集的底栖动物由40目网筛过滤后装入封口袋中并用75%酒精固定, 带回实验室中将底栖动物挑拣出, 放入标本瓶中并用75%酒精保存。用体式显微镜对底栖动物进行鉴定、计数, 鉴定时参考相关书籍[17-18], 尽可能鉴定到属级水平[19]。

图1 样点布设图
Figure 1 Locations of five sampling sites
1.3 底栖动物生活型划分
根据Poff等(2006)的划分标准, 将底栖动物划分为5个类型: 固着型、穴居型、攀爬型、游泳型和蔓生型。固着型动物(clingers): 指附着于河床底质表面的动物; 穴居型动物(burrowers): 通常指那些生活在细颗粒河床底质中, 尤其生活在河流淤积区中的底栖动物, 或者有些穴居动物也在植物体内生存; 攀爬型动物(climbers): 泛指生活在缓流区或静水区中的底质表面、滨河植物活体(如茎、叶、根)、腐败的有机碎屑或木头碎屑上的底栖动物, 摄食沉水动物; 游泳型动物(swimmers)能够控制其自身运动的方向和速度的潜水性动物, 它们能够从水面游到水体底部; 蔓生型动物(sprawlers), 指生活在沉水植物叶面和细颗粒泥沙底质顶层的动物。
固着型底栖动物喜欢附着在砾石底质表面, 受底质的影响较大[20]; 穴居型底栖动物喜欢栖息在细沙和淤泥中或在其中筑巢, 河流中的淤泥底质可为穴居型底栖动物提供栖息空间; 蔓生型底栖动物一般匍匐在底质表面, 因游泳刚毛短, 移动范围小, 所以受氧气、光照和水深的影响较大[21], 游泳型底栖动物能在水中自由游动最终停靠在底质拦截的凋落叶上, 抗逆性较强, 受凋落叶、底质等因素影响较大。
1.4 水体理化指标测定
底栖动物样品采集的同时用水深探测棒测量水深, 用米尺测量河宽, 用便携式流速仪测量流速, 用便携式水质分析仪(哈纳H19829T)测定水温、溶解氧、pH等水质指标。同期估测底质类型, 河流底质类型采用Cummins的划分标准[22], 即漂砾(粒径256 mm以上)、圆石(粒径64—256 mm)、卵石(粒径16—64 mm)、砂砾(粒径4—16 mm)、沙(粒径2—4 mm)、淤泥(粒径小于2 mm)。
1.5 数据处理与分析
优势种的确定由优势度值决定, 计算公式为:
(n/)*f
其中,为优势度,n为第种出现的个体数,为出现的总个体数,f为第种在各个样点出现的频率, 本实验将优势度大于0.02的物种认为是优势种。
用相对丰度反应各生活型底栖动物的组成情况, 密度和物种丰富度来表征各生活型底栖动物的实际分布, 用Shannon-Wiener多样性指数来表征各断面底栖动物群落结构的差异。
用SPSS 25.0中的One-way ANOVA对5个断面的底栖动物数据进行差异显著性分析, 若不满足方差齐性, 采用非参数检验方法检验差异显著性, 显著性水平取0.05; 用R语言软件包(vegan)中的metaMDS()函数对hellinger转化后的多度数据和生活型数据分别进行非度量多维标度排序(NMDS)以对比两种划分方式对环境变化的反应能力; 用R语言包(status)中的hclust()函数对5个样点各生活型数据进行ward最小方差聚类, 依据Mantel统计相关选择最优分组数量, 并用reorder.hclust()函数重排聚类树。
2 结果分析
2.1 水体理化指标
表1给出了5个采样段面的流速、溶解氧、水深、河宽4项理化指标。断面N1—N3以砾石、圆石、泥沙为主, 断面N4位于农田附近, 受到一定程度的农业影响, 偶尔会有工人施工挖掘河床, 底质为细颗粒泥沙, 断面N5位于居民区附近, 除圆石、泥沙等常见底质外还有砖块、瓦砾以及生活垃圾。
2.2 底栖动物群落结构
5个断面共采集到底栖动物82种, 隶属5纲11目35科82属, 其中昆虫纲Insecta 78种, 软甲纲Malacostraca 1种, 寡毛纲Oligochaeta 1种, 蛛形纲Arachnida 1种, 内口纲Entognatha 1种。底栖动物丰度以水生昆虫为主, 占93.65%, 其次为软甲纲、寡毛纲, 蛛形纲, 分别占4.5%、1.69%、0.12%, 内口纲最少, 占0.05%。把优势度大于0.02的种群定义为优势种, 优势物种分别为属一种、直突摇蚊亚科一种(Orthocladiinae sp.)、属一种、纹石蛾一种(sp)、弓石蛾一种(sp.)、钩虾属一种(sp.), 优势度分别为0.067、0.056、0.054、0.05、0.034和0.031。
共采集到固着型、蔓生型、底埋型、游泳型4种生活型的底栖动物, 其中固着型底栖动物相对丰度最高, 达到50%, 其次是蔓生型和底埋型, 相对丰度分别为25%和17%, 游泳型底栖动物最少, 相对丰度仅占8%。其中固着型优势种为属一种、纹石蛾一种(sp.)、弓石蛾一种(sp.)、属一种、带肋蜉属一种(sp.)、小蜉属一种(Ephemerella sp.), 优势度分别为0.132、0.1、0.067、0.041、0.035和0.027; 蔓生型底栖动物优势种为属一种、属一种、倍叉属一种(sp.)、黑大蚊属一种(sp.), 优势度分别为0.218、0.052、0046和0.043; 穴居型优势物种为直突摇蚊亚科一种(Orthocladiinae sp.1)、摇蚊亚科一种(Chironominae sp.1)、颤蚓属一种(sp.), 优势度分别为0.326、0.035和0029; 游泳型优势物种为钩虾属一种(sp.)、亚美蜉属一种(sp.), 优势度分别为0.345和0.121。
2.3 底栖动物生活型
2.3.1 生活型的相对丰度
除春季的断面4、5仅采集到3种生活型的底栖动物外, 其它断面均采集到4种生活型的底栖动物(图2)。各生活型在断面之间分布较明显的特征为穴居型底栖动物相对丰度在N4、N5断面显著高于前三个断面(<0.05), 固着型和蔓生型底栖动物反之, N4、N5断面显著低于断面N1—N3(<0.05), 游泳型底栖动物除了春季N4、N5断面未采集到, 秋季表现为N4、N5断面显著高于断面N1—N3(<0.05), 夏季表现为断面N4显著高于其他断面(<0.05)。
2.3.2 生活型密度的时空分布
在季节上, 秋季底栖动物密度显著高于春季和夏季(<0.05), 蔓生型和固着型底栖动物密度在秋季、春季、夏季依次降低(<0.05)(图3); 穴居型底栖动物密度在季节间无显著差异(>0.05); 游泳型底栖动物在春季未采集到, 断面N1、N2、N3在季节间无显著差异(>0.05), N4断面夏季显著高于秋季(<0.05), 断面N5秋季高于夏季(<0.05)。在空间上, 断面N1、N2及N3密度显著大于断面N4及N5(<0.05), 穴居型和游泳型底栖动物在断面间差异不显著(>0.05), 蔓生型和固着型底栖动物表现为断面N1、N2、N3显著大于断面N4、N5(<0.05)。

表1 采样段面理化参数(平均值±标准差)

图2 不同断面各生活型底栖动物相对丰度
Figure 2 Relative densities of invertebrates at five sampling sites

图3 不同断面底栖动物各生活型密度
Figure 3 The density of life forms of invertebrates at five sampling sites
2.4 生活型生物多样性的时空分布
单因素方差分析表明, 各断面间Shannon- Wiener多样性指数及物种丰富度均差异显著(< 0.05)(图4)。表现为断面N1显著大于断面N4、N5 (<0.05), 蔓生型底栖动物Shannon-Wiener多样性指数及物种丰富度在断面间差异显著(<0.05), 表现为断面N1、N3分别显著大于断面N4、N5(<0.05), 断面N2显著大于断面N5(<0.05); 固着型底栖动物Shannon-Wiener多样性指数及物种丰富度在断面间也差异显著(<0.05), 表现为N1、N2断面显著大于N4、N5断面(<0.05)。

图4 4种生活型的底栖动物Shannon-Wiener多样性指数、物种丰富度
Figure 4 Shannon-Wiener index and species richness of macroinvertebrates for each life-form at five sampling sites
2.4 底栖动物群落结构
对3次采样的底栖动物数据分别以物种丰度(stress value=0.145)和生活型类群丰度(stress=0.029)为变量进行非度量多维标度排序(NMDS), 两次排序结果均表明N1、N2、N3断面相似性较大, 与N4、N5断面差异较大, 以生活型类群为变量的排序结果较为明显(图5)。对5个断面不同生活型的底栖动物进行聚类结果(图6)也表现出相似的规律, 总体上断面N1、N2、N3相似性较高, 与断面N4、N5相似性较低。
4 讨论
本研究有溪流位于我国高纬度寒冷区域, 位于松花江水系源头, 流速在断面N1至N5间依次增加,水深、河宽在N3断面远高于其他断面, 秋季采样时为枯水期, 水面较低, 春季和夏季采样前积雪融化和降雨导致流速、河宽、水深增加。该水系源头的溶解氧含量较高, 通常为饱和状态, 适合底栖动物生存, 采集到的底栖动物多为毛翅目、襀翅目等喜好冷水的清洁物种, 与松花江干流底栖动物群落结构(水生昆虫63.8%、软体动物21.6%、环节动物12.1%、甲壳动物2.6%)差异显著[23]。底质差异是造成河流底栖动物群落结构不同的关键因素[24-25], 底质异质性高的河流中物种较为丰富[26]。
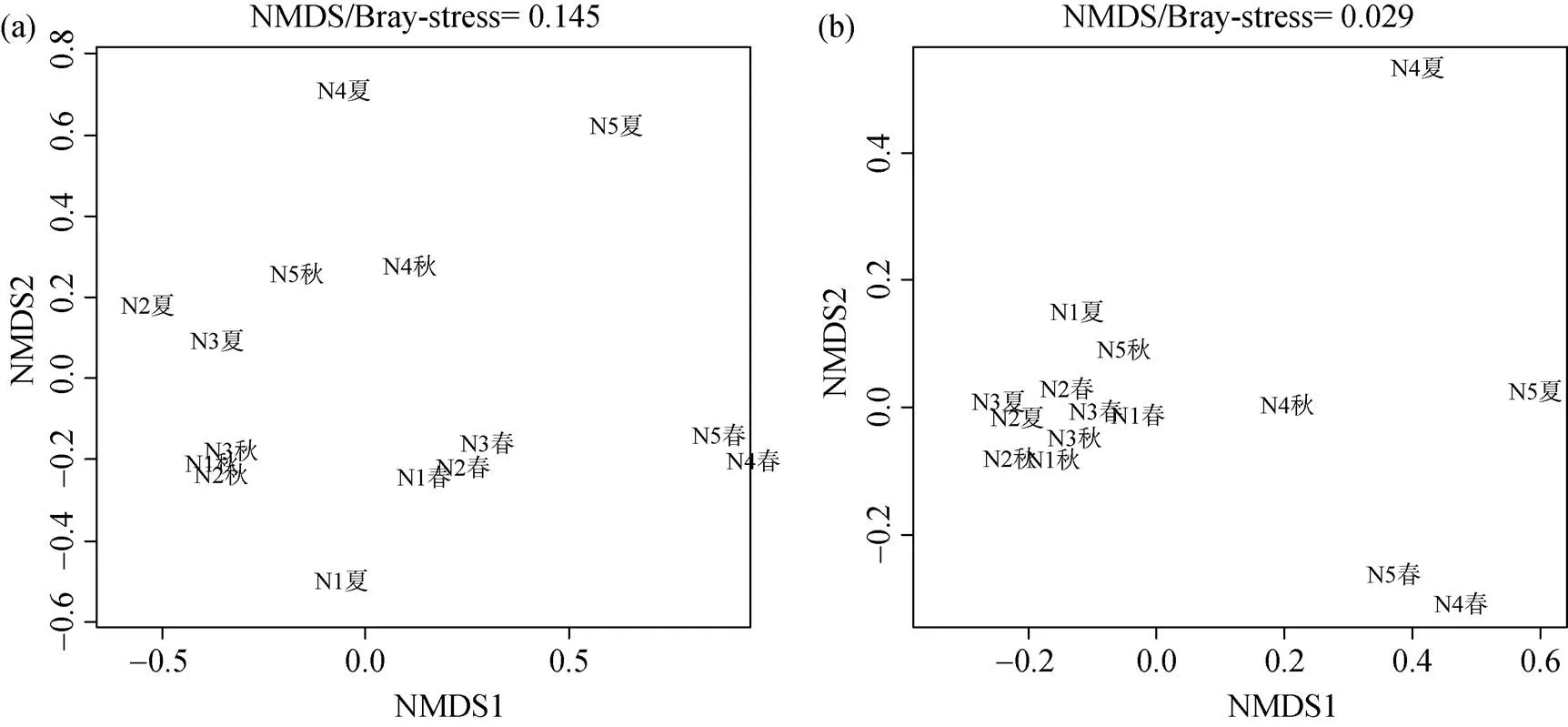
图5 底栖动物群落结构的非度量多维标度排序(a. 物种; b. 生活型)
Figure 5 The non-metric multidimensional scaling ordination of macroinvertebrate communities (a. species; b. life-form)

图6 底栖动物群落结构聚类
Figure 6 The hierarchical cluster dendrogram of the macroinvertebrates communities
相对丰度可以反映各采样段面生活型的组成情况。上游断面N1—N3底栖动物相对丰度以固着型(以纹石蛾科、溪泥甲科为主)和蔓生型(以叉襀科为主)为主, 是因为底质较为多样, 流速较缓, 水质较好, 反映了上游林区河流有利于固着型和蔓生型底栖动物生存。断面N4、N5则以穴居型底栖动物为主, 主要为摇蚊和寡毛类, 这两类底栖动物具有较强的耐受能力, 可以通过穴居、快速繁殖等方式躲避环境波动[27], 表明断面N4、N5环境压力较大。李法云等人对辽河不同土地类型中底栖动物进行调查, 也发现了耕地与居民区附近底栖动物的组成差异显著, 主要表现在摇蚊科成为优势类群, 而喜好洁净水体的石蝇科(Perlidae)相比上游林区比例减少或无分布[28]。
在季节上, 本调查溪流的各个断面固着型和蔓生型底栖动物普遍表现为春季和夏季密度降低。春季为融雪期, 夏季为雨季, 这两次采样时底栖动物生境皆受到洪水的影响, 水体流量增大, 水面升高, 流速、河宽均增加, 一定程度上影响了这两类底栖动物的栖息, 这与Imbert等的报道一致[29]。穴居型底栖动物三次采样密度变化不大, 是因为摇蚊在每年的春季和夏季进行两次繁殖[30], 且穴居型底栖动物在泥土中筑巢的生活习性使其较好的躲避灾难。在空间上, 固着型和蔓生型底栖动物在断面N1、N2、N3密度高于断面N4、N5, 是由于这两类底栖动物一般喜好洁净、透明度高的溪水, 断面N4、N5的农业污染、施工等人为扰动大大降低了其密度; 穴居型底栖动物在各断面间密度差异不显著, 反映了人为活动对穴居型底栖动物无显著影响, 与金鑫对东江流域底栖动物的研究结果相似[31]; 游泳型底栖动物在断面间无显著影响, 是因为在本实验中采集到的游泳型底栖动物主要为钩虾, 其直接以凋落叶及粗颗粒有机物或其他底栖动物为食[32], 并且能在水体中自由游动, 对底质适应性较好[31], 抗逆性较强, 在断面N4、N5中密度未受到明显抑制。春季断面N4、N5未采集到游泳型底栖动物, 可能原因是洪水的冲刷和上游施工搅动, 导致水体泥沙含量高, 底质均一且水体中缺乏粗颗粒有机物, 破坏了游泳型底栖动物的生存环境。
多样性指数指示了群落结构与组成的重要信息, 能够指示环境的变化[33]。长白山源头溪流物种丰富度高, 尤其是在上游地区[34-35]。本研究中物种丰富度从断面N1至N5依次降低, 反映了上游的溪流中底栖动物物种保存相对于下游完整。张晓可等对青弋江流域的调查结果也表明底栖动物物种丰富度随着水流方向呈现出减少趋势[36]。Shannon-Wiener多样性指数表现为断面N3、N5生物多样性较低, 其坡度大, 流速快, 水体深, 导致襀翅目、毛翅目、蜉蝣目等抗逆性较差的底栖动物大大减少。舒凤月等在黄山东河段海岸带的调查结果也得出类似结论, 即流速过快、受到严重人为干扰且有较多生活垃圾, 会降低物种丰富度[37]。
对本次调查群落进行的排序和聚类分析均表现为受到人为干扰的断面同其他断面差异显著, 说明人为干扰影响了底栖动物的群落结构。吴红斌等采用主成分分析和回归分析的分析方法分析了底栖动物群落与陆地景观因子之间的关系, 表明人为干扰会对底栖动物群落结构产生影负面影响[38]。本文以生活型为变量的排序中这种差异较为明显, 表明生活型类群对环境变化的敏感程度高于传统的物种分类, 以生活型作为底栖动物群落划分方式具有重要的指示和环境监控意义。
[1] LINDEGAARD C. The role of zoobenthos in energy flow in two shallow lakes [J]. Hydrobiologia, 1994, 275 (1): 313–322.
[2] WALLACE J B. Recovery of lotic macroinvertebrate communities from disturbance [J]. Environmental Management, 1990, 14 (5): 605–620.
[3] WALLACE J B, WEBSTER J R. The role of macroinvertebrates in stream ecosystem function[J]. Annual Review of Entomology, 1996, 41 (1): 115–139.
[4] 贾鹏, 杜国祯. 生态学的多样性指数:功能与系统发育[J]. 生命科学, 2014, 26(2): 153–157.
[5] POFF, N L, OLDEN J D, VIEIRA N K M, et al. Functional trait niches of North American lotic insects: traits-based ecological applications in light of phylogenetic relationships[J]. Journal of the North America benthological society, 2006, 25 (4): 730–755.
[6] 葛宝明, 鲍毅新, 郑祥. 灵昆岛围垦滩涂潮沟大型底栖动物群落生态学研究[J]. 生态学报, 2005, 25 (3): 446– 453.
[7] SONG Yantao, WANG Ping, LI Guangdi, et al. Relationships between functional diversity and ecosystem functioning: A review [J]. Acta Ecologica Sinica, 2014, 34 (2): 85–91.
[8] 林良羽, 童春富, 李秀珍. 崇明东滩藻类盐渍带大型底栖动物功能群的划分及其分布特征[J]. 生态学杂志, 2015, 34 (8): 2229–2237.
[9] MAXTED J R, BARBOUR M T, GERRITSEN J et al. Assessment framework for mid-Atlantic coastal plain streams using benthic macroinvertebrates [J]. Journal of the North American Benthological Society, 2000, 19 (1): 128–144.
[10] 张玉平. 九段沙底栖动物群落生态学研究[D]. 上海: 华东师范大学, 2005: 1–53.
[11] 罗章凤, 方展强. 珠海横琴岛芒洲湿地红树林人工恢复期大型底栖动物群落结构研究[J]. 热带海洋学报, 2017, 36 (3): 61–72.
[12] 蒋万祥, 蔡庆华, 唐涛, 等. 香溪河水系大型底栖动物功能摄食类群生态学[J]. 生态学报, 2009, 29 (10): 5207– 5218.
[13] BIGGS H B J F. Sediment texture mediates high-flow effects on lotic macroinvertebrates [J]. Journal of the North American Benthological Society, 2003, 22 (4): 542–553.
[14] 王强, 袁兴中, 刘红. 西南山地源头溪流附石性水生昆虫群落特征及多样性——以重庆鱼肚河为例[J]. 水生生物学报, 2011, 35 (5): 887–892.
[15] CRISP D T, ROBSON S. Some effects of discharge upon the transport of animals and peat in a north Pennine headstream [J]. Journal of Applied Ecology, 1979, 16 (3): 721–736.
[16] WRIGHT M S, COVICH A P. The Effect of Macroinvertebrate Exclusion on Leaf Breakdown Rates in a Tropical Headwater Stream [J]. Biotropica, 2005, 37 (3): 403–408.
[17] MORSE J C, YANG L F, TIAN L X. Aquatic insects of China useful for monitoring water quality[M]. Nanjing: Hohai University Press, 1994.
[18] HENRI T, PHILIPPE R, MICHEL B, et al. 淡水无脊椎动物系统分类、生物及生态学[M]. 刘威, 王旭涛, 黄少峰译. 北京: 中国水利水电出版社, 2015.
[19] DUAN Xuehua, WANG Zhaoxin, XU Mengzhen, Zhang K. Effect of streambed sediment on benthic ecology [J]. International Journal of Sediment Research, 2009, 24 (3): 325–338.
[20] 段学花, 王兆印, 徐梦珍. 底栖动物与河流生态评价[M]. 北京: 清华大学出版社, 2010: 24–64.
[21] YU Na, WEI Chaoqun, LI Depeng, et al. Ostracod assemblages and their ecological significance in a new mildly eutrophic lake (Yuandang Lake) in Eastern China [J]. Resources and Environment in the Yangtze Basin, 2018, 27 (5): 1092–1103.
[22] CUMMINS K W. An evaluation of some Techniques for the collection and analysis of benthic samples with special emphasis on lotic waters [J]. American Midland Naturalist, 1962, 67(2): 477–504.
[23] 霍堂斌, 刘曼红, 姜作发, 等. 松花江干流大型底栖动物群落结构与水质生物评价[J]. 应用生态学报, 2012, 23(1): 247–254.
[24] GURTZ M E, WALLACE J B. Substrate-mediated response of stream invertebrates to disturbance [J]. Ecology, 1984, 65 (5): 1556–1569.
[25]段学花, 王兆印, 程东升. 典型河床底质组成中底栖动物群落及多样性[J]. 生态学报, 2007, 27 (4): 1664– 1672.
[26] TOWNSEND C R. The Patch dynamics concept of stream community ecology [J]. Journal of the North American Benthological Society, 1989, 8 (1): 36–50.
[27] KASTER J L, JACOBI G Z. Benthic macroinvertebrates of a fluctuating reservoir [J]. Freshwater Biology, 1978, 8 (3): 283–290.
[28] 李法云, 郎红伟, 王艳杰, 等. 辽河流域典型支流土地利用方式对大型底栖动物群落时空分布特征的影响 [J]. 环境科学学报, 2016, 36 (3): 767–777.
[29] IMBERT J B, GONZALEZ J M, BAZAGUREN A, et al. Influence of inorganic substrata size, leaf litter and woody debris removal on benthic invertebrates resistance to floods in two contrasting headwater streams [J]. International Review of Hydrobiology, 2005, 90 (1): 51–70.
[30] 邵美玲, 谢志才, 叶麟, 等. 三峡水库蓄水后香溪河库湾底栖动物群落结构的变化[J]. 水生生物学报, 2006, 30 (1): 64–69.
[31] 金鑫. 东江流域底栖动物生态学研究[D]. 北京: 清华大学, 2011: 31–34.
[32] KELLY D W, DICH J T A, MONTGOMERY W I. The functional role of Gammarus (Crustacea, Amphipoda): Shredders, predators, or both? [J]. Hydrobiologia, 2002, 485 (1): 199–203.
[33] WANG Y K, STEVENSON R J, METZMEIER L. Development and evaluation of a diatom-based Index of Biotic Integrity for the Interior Plateau Ecoregion, USA [J]. Journal of the North American Benthological Society, 2005, 24 (4): 990–1008.
[34] 樊海娟. 长白山松花江水系两类特征河流大型底栖无脊椎动物群落结构特征的比较研究[D]. 长春: 东北师范大学, 2016: 16–47.
[35] 许晨. 长白山源头溪流大型底栖动物群落特征初步研究[D]. 长春: 东北师范大学, 2017: 21–33.
[36] 张晓可, 宣昊, 王慧丽, 等. 青弋江流域不同级别河流底栖动物群落结构研究[J]. 长江流域资源与环境, 2014, 23 (12): 1659–1664.
[37] 舒凤月, 吴俊燕, 孙晓倩, 等. 黄河山东段河岸带春季大型底栖动物群落结构与多样性[J]. 动物学杂志, 2017 (02): 98–109.
[38] 吴红斌, 田自强. 流域景观格局对大型底栖动物群落结构的影响研究——以太子河山区段为例[J]. 环境保护科学, 2017, 43 (4): 95–101.
Life-forms based tempo-spatial distribution of macroinvertebrates in headstreams of Changbai Mountain
TAN Ying1, Wang Lu1, GONG Yuwei1, CHEN Ge1, ZHANG Zhenxing1,YANG Haijun1,2,3,*
1. Ministry of Education Key Laboratory of Vegetation Ecology, Institute of Grassland Science, Northeast Normal University, Changchun 130024, China 2. Institute of plateau lake ecology and management, Yunnan University, Kunming650500, China 3. School of Biology and Geography Science, Yili Normal University, Yining 835000, China
Macroinvertebrates are the key biological groups in the mountain stream ecosystem. Their community structure and seasonal dynamics are largely determined by the life forms of species. To understand the community structure of macroinvertebrates and their environments in the cold water headstreams, we conducted a quantitative survey of a typical headstream in a natural reserve of Changbai Mountain to explore the temporal and spatial dynamics of life forms of headstream macroinvertebrates in Changbai Mountain. In total, 4525 macroinvertebrates belonging to 5 classes, 11 orders, 35 families and 82 genera were collected, of which 78 taxa aquatic insects were observed, andsp., Orthocladiinae sp.,sp.,sp.,sp., andsp. were found to be dominant group. Clinger was the main life-form group, contributed about 50% to the total abundance, followed by sprawler (25%), burrower (17%) and swimmer (8%). Human activities significantly reduced the abundance, and species richness of macroinvertebrates, and the clinger and sprawler were the most sensitive. Human interference significantly influenced the species and life-form composition, and the life-form composition was the most sensitive to the interference.
mountain stream; macroinvertebrates; community structure; life form; human interference
10.14108/j.cnki.1008-8873.2020.06.007
Q14
A
1008-8873(2020)06-045-09
2019-09-25;
2019-11-03基金项目:国家自然科学基金项目(31770508)
谭颖(1995—), 女, 辽宁丹东人, 硕士,主要从事淡水生态学研究, E-mail: tany881@nenu.edu.cn
杨海军, 男, 教授, 主要从事淡水生态学研究, E-mail: yanghaijun@ynu.edu.cn
谭颖, 王璐, 宫雨薇, 等. 长白山源头溪流底栖动物生活型及群落结构的时空特征[J]. 生态科学, 2020, 39(6): 45–53.
TAN Ying, Wang Lu, GONG Yuwei, et al. Life-forms based tempo-spatial distribution of macroinvertebrates in headstreams of Changbai Mountain[J]. Ecological Science, 2020, 39(6): 45–53.
