调控Runx2 的重力敏感miRNA 的筛选研究
2021-01-04张丽君王艺璇胡泽兵李高志曹新生
张丽君,王 可,王艺璇,胡泽兵,李高志,石 菲,曹新生,张 舒
空军军医大学 航空航天生物动力学教研室,航空航天医学教育部重点实验室,陕西西安 710032
人类在长期进化过程中,逐渐形成了与地球重力相适应的生理结构和功能,但在航天活动中,长期的失重状态和航天飞行使航天员骨骼的骨钙代谢水平发生进行性、累积性的变化[1-2],进而导致骨密度下降和骨矿盐含量的再分布。正常状态下,成骨细胞介导的骨生成与破骨细胞介导的骨吸收之间维持平衡[3-4],但在失重条件下这种平衡状态被打破,表现为骨生成减少和骨吸收增多,其中成骨细胞的功能障碍成为失重性骨丢失的重要原因[5]。
miRNA 是一组长度为20 ~ 24 个核苷酸的非编码RNA,可调节基因转录后的沉默,对细胞的分化、凋亡等功能至关重要。Runx2(Runt-related transcription factors 2) 是成骨谱系的关键调节因子,其表观遗传功能可调节骨相关基因的表达,研究已证实失重或模拟失重条件下Runx2 的表达明显受抑制[6-7],但其详细机制仍未完全阐明。虽然已有研究报道模拟失重条件下多个miRNA 通过作用于不同的靶基因可调控成骨分化[8-11],部分miRNA 也已通过小鼠在体成骨细胞靶向干预技术被证实可部分对抗失重性骨丢失,但以Runx2 为直接靶基因的miRNA 在模拟失重条件下的作用仍未见报道。利用生物信息学技术,在MC3T3-E1细胞中预测可能靶向调控Runx2 的miRNA 中筛选出重力敏感的miRNA,并以此miRNA 为干预靶点,有助于更直接地干预和缓解失重性骨丢失的发生。本实验通过RAID 等数据库预测出以Runx2 为靶向 的 4 条 miRNA, 即 miR-135a-5p、miR-137-3p、miR-205-5p 和miR-217-5p,并检测了其在模拟失重条件下的变化。结果表明模拟失重条件下,在前成骨细胞MC3T3-E1 中miR-135a-5p 的表达明显升高,且在失重72 h 之内与Runx2 的表达呈负相关,发现miR-135a-5p 可抑制Runx2 的表达,进一步证实了抑制miR-135a-5p 表达可部分缓解模拟失重对Runx2 的抑制作用,这为确定miR-135a-5p 为失重性骨丢失的小鼠在体靶向干预靶点提供了实验依据。
材料与方法
1 材料 前成骨细胞系MC3T3-E1(ATCC 细胞库),α-mem 培养基(Gibco 公司),胎牛血清( 四季青公司),双抗(Hyclone 公司),胰蛋白酶(Millipore公司 ),miR-135a-5p mimic、inhibitor 和对照 ( 上海吉玛制药技术有限公司),RNAiso 细胞裂解液,SYBR®Premix Ex TaqTM(TaKaRa 公 司 ),Mir-X miRNA First-Strand Synthesis Kit、Prime Script®RT reagent Kit,PCR 引物( 上海生工生物工程股份有限公司),RIPA 细胞裂解液,PSMF,预制胶( 美国Invitrogen 公司),电泳缓冲液( 美国Invitrogen公司 ), 转膜缓冲液 ( 美国 Invitrogen 公司 ), 一抗稀释液 ( 碧云天 ),PVDF 膜 ( 美国 Invitrogen 公司 ),BCA 蛋白定量试剂盒 ( 美国 Sigma 公司 ),碱性磷酸酶测试盒( 南京建成生物工程研究所),2D-RWVs 回转器( 中国航天员科研训练中心),超净工作台( 天津泰斯特仪器有限公司),qRT-PCR仪 ( 美国 Bio-Rad 公司 )。
2 细胞培养 将前成骨细胞系MC3T3-E1 在含有10% 血清和1% 双抗的α-mem 培养基中培养,并置于37℃,5% CO2的孵箱中,2 d 换1 次液,待细胞汇合度到达90% 时,使用胰蛋白酶进行传代培养。选取3 ~ 6 代呈对数生长期的细胞进行实验。
3 模拟失重 在超净台中将细胞汇合度达90% 的细胞传代至回转瓶中,并置于37℃孵箱中培养。待6 ~ 8 h 细胞贴壁后,用含有10% 血清和1% 双抗的α-mem 培养基灌满回转瓶,直立放入37℃孵箱过夜。然后将回转瓶中的气泡完全排尽,放回转器上进行回转,回转半径为1.5 cm,转速为24 r/min,获得的细胞为失重组(MG)。对照组(CON)置入37℃孵箱中普通培养。
4 细胞转染 采用Lipofectamine 2000 脂质体进行转染。在超净台中将miR-135a-5p 的mimic 或inhibitor 的冻干粉加双蒸水进行稀释,并分装备用。在超净台中将细胞汇合度达90% 的细胞传代至六孔板中,并使用含10% 血清,无双抗的α-mem培养基培养,待细胞汇合度达60% ~ 70% 时进行转染。吸取250 μl Opti-MEM 培养基,在其中加入4 μl Lipofectamine 2000 脂质体,再次吸取250 μl Opti-MEM 培养基,分别加入各4 μl mimic、mimic-NC 稀释存储液及 10 μl inhibitor、inhibitor-NC 稀释存储液,静置5 min,将两者混合均匀并静置20 min。然后将混合后的溶液随机加入六孔板中,并在每个孔中加入2 ml 无血清无双抗的α-mem培养基,于37℃孵箱中培养。6 h 后,换含10%血清,无双抗的α-mem 普通培养基,待细胞汇合度达90% 时换诱导培养基,48 h 后提取所需材料。
5 实时荧光定量PCR 使用RNAiso 裂解细胞提取细胞总RNA,采用SYBR Green 荧光染料法进行PCR 扩增。miRNA 检测:采用Mir-X miRNA First-Strand Synthesis Kit 逆转录合成cDNA,以U6 为内参扩增 miRNA。mRNA 检测 :采用 PrimeScript®RT Master Mix reagent Kit 逆转录合成 cDNA, 以GAPDH 为内参扩增mRNA。数据采用2-△△Ct法进行相对定量分析。PCR 引物序列见表1。

表 1 引物序列Tab. 1 Primer sequences
6 Western blot检测 提取MC3T3-E1细胞总蛋白,加入RIPA 细胞裂解液和蛋白酶抑制剂,超声粉碎细胞,通过BCA 法测定蛋白质浓度,并加入上样缓冲液95℃加热10 min。电泳时使用预制胶,每孔上样量为30 μl,先恒压90 V 电泳30 min,后恒压120 V 电泳90 min,常规转膜,5% 的脱脂牛奶封闭 4 h,分别加入 Runx2 和 GAPDH 抗体 (1 :1 000)4℃孵育过夜。第2 天用TBST 在摇床上洗膜3 次,每次10 min。然后将膜放入羊抗兔二抗(1 :5 000)中孵育60 min,使用TBST 在摇床上洗膜3 次,每次10 min。通过使用ECL 发光液进行发光并拍摄照片,用Image J 软件分析所拍摄条带灰度值并计算蛋白相对含量。
7 生物信息学方法 通过RNAinter 网站预测出与Runx2 相关的miRNA,并根据分数的大小从高到低排序,选取分数大于0.95 且文献中未被报道过的miRNA 进行下一步研究。
8 统计学方法 全部数据采用SPSS 19.0 软件进行分析,两样本间的比较采用独立样本t检验,多样本比较采用单因素方差分析(One-way ANOVA)。P<0.05 为差异有统计学意义。
结 果
1 生物信息学预测与Runx2 具有结合位点的4 条miRNA 为筛选可直接调控Runx2 的miRNA,以便以此miRNA 作为失重性骨丢失的小鼠在体靶向干预靶点,我们使用RNAinter 网站预测出与Runx2 相关分数大于 0.95 的 miRNA, 通过阅读文献和PCR 检测,筛选出目前无明确报道且在MC3T3-E1 细胞中表达量较高的4 条miRNA,即miR-135a-5p、miR-137-3p、miR-205-5p 和 miR-217-5p( 表 2)。
2 模拟失重条件下MC3T3-E1 细胞miRNA 的表达变化 为了检测这4 条miRNA 是否对重力变化敏感,我们将前成骨细胞MC3T3-E1 放入2D 回转器中模拟失重培养48 h,采用PCR 方法检测miR-135a-5p、miR-137-3p、miR-205-5p 和 miR-217-5p 的表达情况。结果显示,与对照组相比,模拟失重组miR-135a-5p 表达显著上调(P<0.05),而miR-137-3p、miR-205-5p 和 miR-217-5p 的表达无显著变化( 图1)。
3 模拟失重72 h 内MC3T3-E1 细胞miR-135a-5p 表达变化 为了进一步了解对重力变化敏感的miR-135a-5p 在模拟失重条件下的变化特点,我们分别检测了模拟失重24 h、48 h 和72 h 后miR-135a-5p 的表达变化。结果显示,与对照组相比,miR-135a-5p 在模拟失重24 h 即出现上调,且显著上调可持续到72 h(P<0.05 或P<0.01)( 图2)。

表 2 miRNA 序列Tab. 2 miRNA sequences

图 1 模拟失重48 h后MC3T3-E1细胞miRNA的表达Fig.1 Expression levels of miRNAs in MC3T3-E1 cells cultured in simulated microgravity for 48 h (aP <0.05, vs CON group)
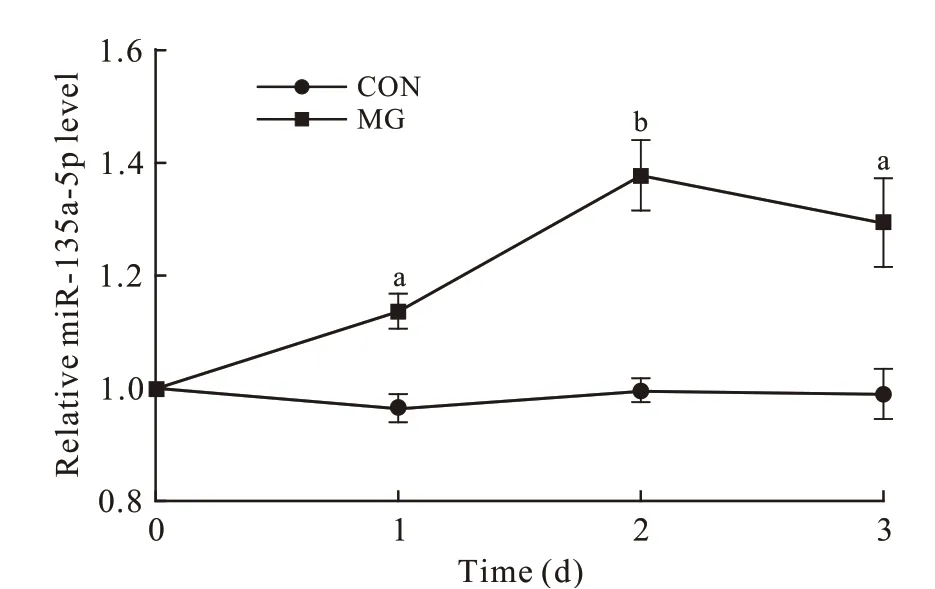
图 2 模拟失重72 h MC3T3-E1细胞miR-135a-5p的表达变化Fig.2 Expression levels of miR-135a-5p in MC3T3-E1 cells cultured in simulated microgravity for 72 h (aP < 0.05, bP < 0.01, vs CON group)
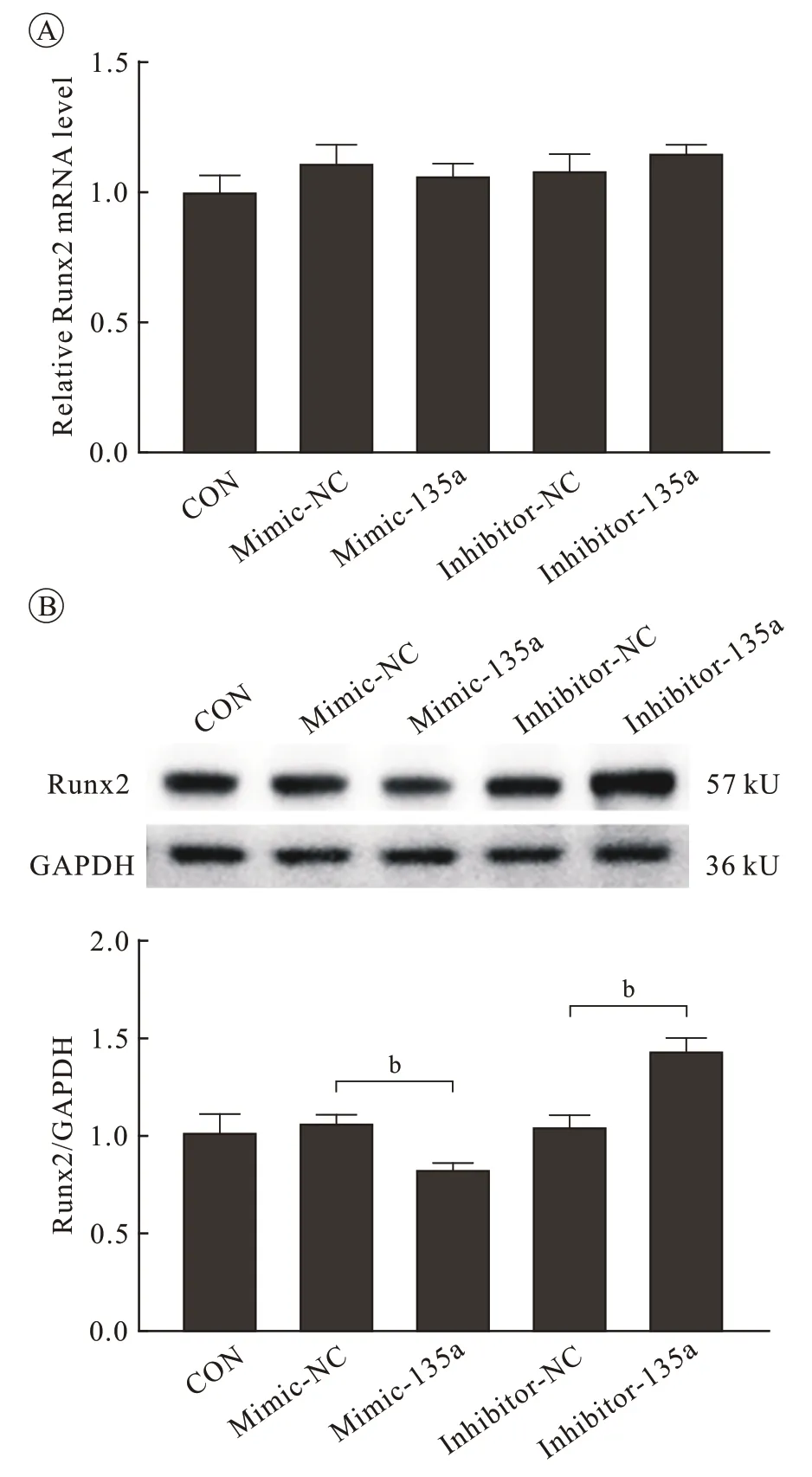
图 3 模拟失重72 h MC3T3-E1细胞中Runx2的表达变化A:qRT-PCR检测模拟失重后 Runx2 mRNA水平的表达;B:Western blot检测模拟失重后Runx2蛋白水平的表达Fig.3 Expression levels of Runx2 in MC3T3-E1 cells cultured under microgravity for 72 h A: mRNA expression of Runx2 by qRT-PCR under microgravity; B: Protein levels of Runx2 by Western blotting under microgravity (bP <0.01, vs CON group)
4 模拟失重 72 h 内 miR-135a-5p 与 Runx2 的表达呈负相关 为了进一步探讨模拟失重条件下重力敏感的miR-135a-5p 是否与Runx2 的表达呈相关性。我们检测了模拟失重72 h 内Runx2 的mRNA表达及蛋白水平。结果显示,与对照组相比,Runx2 在模拟失重24 h 即出现mRNA 和蛋白水平的明显下调,且显著下调可持续到72 h(P<0.05或P<0.01)。提示模拟失重72 h 内miR-135a-5p与Runx2 的表达呈负向关联关系( 图3)。
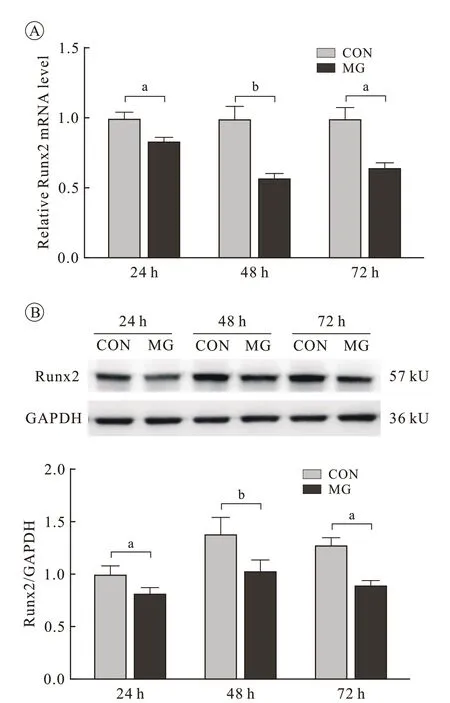
图 4 转染miR-135a-5p mimic或inhibitor后Runx2的表达变化A:qRT-PCR检测转染miR-135a-5p对Runx2 mRNA表达的影响; B:Western blot检测转染miR-135-5p对Runx2蛋白表达的影响Fig.4 Expression levels of Runx2 in MC3T3-E1 cells transfected with miR-135a-5p mimic, inhibitor and negative control A: mRNA expression of Runx2 by qRT-PCR after transfection; B: Protein levels of Runx2 by Western blotting after transfection (bP <0.01, vs CON group)
5 miR-135a-5p 可 调 控 Runx2 的 蛋 白 表 达MC3T3-E1 细胞转染 mimic 或 inhibitor 后 Runx2 的mRNA 水平未发生明显变化,Western blot 结果显示Runx2 蛋白表达分别显著降低或升高(P<0.01)。验证了miR-135a-5p 可通过抑制Runx2 的蛋白翻译过程调控Runx2 的表达( 图4)。
6 miR-135a-5p 可部分缓解模拟失重条件Runx2 的 表 达 降 低 miR-135a-5p inhibitor 转 染MC3T3-E1 细胞,并在模拟失重条件下培养48 h,通过PCR结果显示,转染miR-135a-5p inhibitor后,qRT-PCR 技术结果显示Runx2 的mRNA 表达水平未发生明显变化,Western blot 检测发现Runx2 的蛋白表达分别显著降低或升高(P <0.01)。提示抑制内源性miR-135a-5p 的表达部分缓解了模拟失重对Runx2 蛋白表达的抑制作用( 图5)。
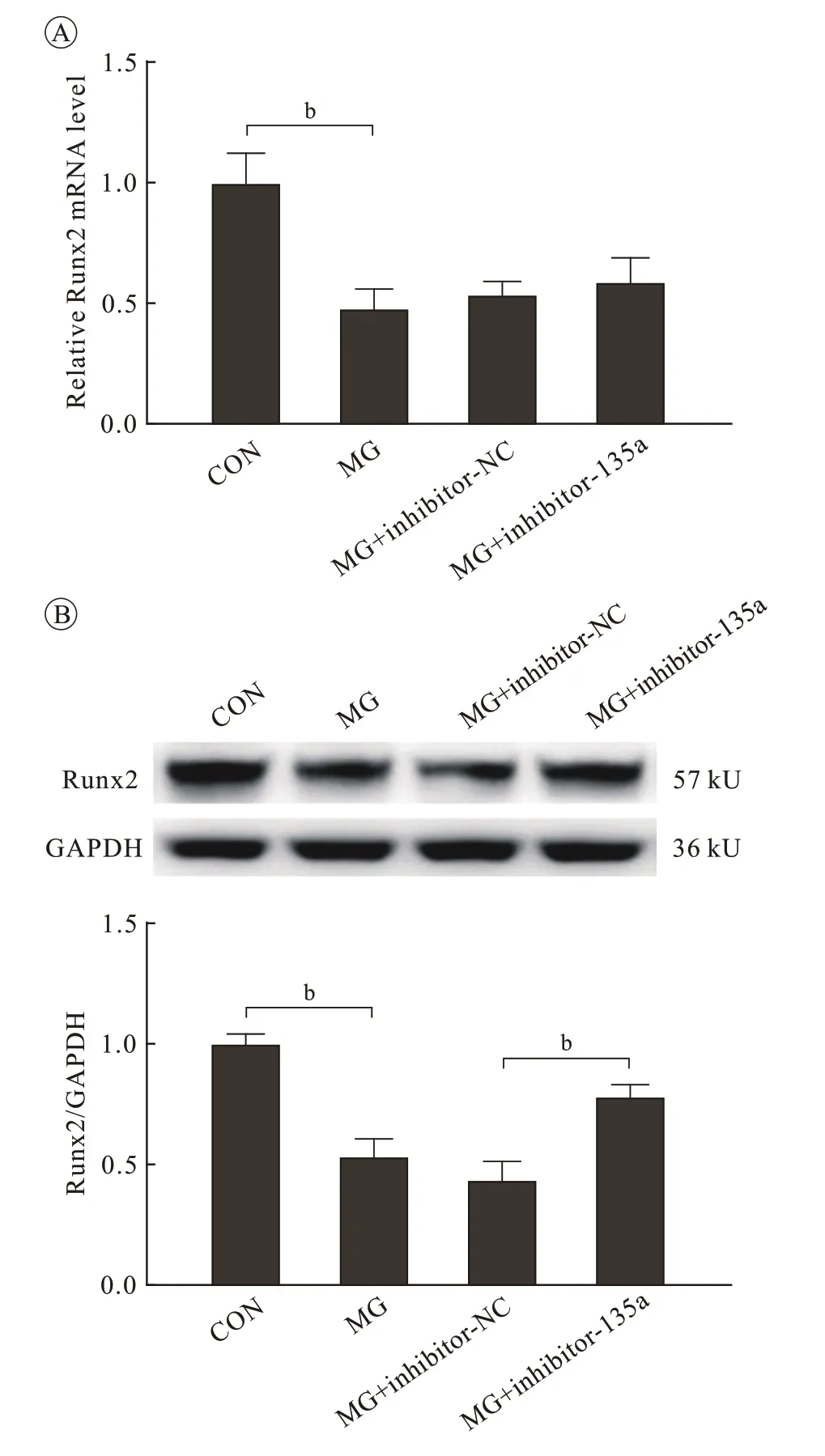
图 5 转染miR-135a-5p mimic 或inhibitor 后模拟失重48 h MC3T3-E1细胞中Runx2的表达变化A:qRT-PCR检测模拟失重后 Runx2 mRNA水平的表达;B:Western blot检测模拟失重后Runx2蛋白水平的表达Fig.5 Expression levels of Runx2 in MC3T3-E1 cells transfected with miR-135a-5p mimic, inhibitor and negative control under microgravity for 48 h A: mRNA expression of Runx2 by qRT-PCR under microgravity; B: Protein levels of Runx2 by Western blotting under microgravity (bP <0.01, vs CON group)
讨 论
为了筛选靶向Runx2 的具有重力敏感性的miRNA,为失重性骨丢失的在体靶向干预提供研究靶点,本实验通过RNAinter 预测出4 条与重要的成骨调节因子Runx2 具有结合位点的miRNA,并通过2D 回转器模拟失重处理MC3T3-E1 细胞。结果发现4 条miRNA 中miR-135a-5p 表达上调,并且进一步证实了miR-135a-5p 在模拟失重72 h内稳定上调,且与Runx2 的表达呈负向关联关系。已有文献报道,miR-135a-5p 可直接作用于Runx2的3’UTR 区,调节Runx2 的表达[12]。我们的实验对 MC3T3-E1 细 胞中 miR-135a-5p 与 Runx2 的调控关系进行了验证,即向MC3T3-E1 中转染了miR-135a-5p mimic 或 inhibitor, 结果发现 Runx2的mRNA 水平无明显变化,而蛋白表达分别下调和上调,验证了miR-135a-5p 可通过抑制Runx2的蛋白翻译调控Runx2 的表达,并进一步证实抑制miR-135a-5p 的表达可部分缓解模拟失重条件下Runx2 蛋白水平的下调,提示模拟失重条件下miR-135a-5p 可部分调控Runx2 的表达,但Runx2可能还受到其他机制的调控。
骨对力学刺激十分敏感,其结构和功能都与力学变化密切相关[13-14]。骨骼除承受包括肌肉收缩在内的机械应力直接作用外,骨骼细胞还受到通过场力方式直接作用的重力调控,正常的力学状态对维持骨形成和骨吸收的动态平衡至关重要。在航天失重环境中,应力和场力作用的显著减少,使得这种动态平衡被打破,表现为骨形成减少,骨吸收增加,骨小梁变薄,且随着航天飞行的时程增加,承重骨的骨钙代谢水平发生进行性累积性的变化,骨密度以平均每个月1% ~ 2% 的速率降低[15],航天失重环境引起的钙磷代谢负平衡在返回地面后也较难恢复且没有自限性,这导致失重性骨丢失成为困扰人类长期太空飞行的主要医学问题之一。目前对失重性骨丢失的具体机制仍未完全阐明,研究表明成骨细胞介导的骨形成能力下降在失重性骨丢失中发挥重要的作用。
miRNA 是一类广泛存在的,长度约为22 nt 的单链内源性非编码RNA,其可以与靶基因的mRNA的3’UTR 区或编码区序列结合,抑制其翻译或促进mRNA 的降解,进而调控靶基因的表达[16]。已有多个研究证实,miRNA 可调控成骨细胞的功能。miR-214 通过靶向ATF4 抑制成骨细胞活性[17];miR141 和miR-200 在MC3T3-E1 细胞中通过抑制成骨转录因子Dlx5 的表达,抑制成骨细胞的分化[18];miR-218 可抑制Wnt 信号通路负调控因子硬化蛋白的表达,而Wnt 信号通路配体Wnt3a 可诱导miR-218 的形成,miR-218 与Wnt 信号通路形成一个循环,刺激Wnt 信号通路的激活,调控成骨细胞的分化[19]。Runx2 是成骨细胞分化过程中的重要的转录因子[20],其可受到多个miRNA 的调控[21],如在间充质祖细胞中miR-204 和miR-211 可结合于 Runx2 的 3’UTR 区进而抑制 Runx2 的表达,使得间充质干细胞由向成骨细胞分化转化为向脂肪细胞的分化[22]。失重对成骨细胞中Runx2 的抑制作用已成为公认事实,我们课题组的前期研究已证实模拟失重条件下miR-132-3p、miR-33-5p、miR-103 及miR-139-3p[8-11]可分别通过不同的靶基因调控成骨细胞的功能,并通过在体成骨细胞靶向干预技术证实miR-132-3p、miR-33-5p 及miR-139-3p 可部分对抗小鼠的失重性骨丢失。为了进一步提高在体靶向干预效果,选择直接靶向Runx2 的miRNA 为干预靶点值得进一步研究。但目前模拟失重条件下与直接调控Runx2 有关的miRNA 的研究报道较少。
本研究中,我们所筛选出的重力敏感性miR-135a-5p 与成骨作用密切相关。有文献提出,在成纤维细胞中成纤维细胞生长因子18 可通过下调miR-135a-5p 的表达促进其矿化[23],miR-135a-5p 也与脂肪源干细胞的成骨分化有关[24],miR-135a-5p 还可直接作用于 Runx2 的 3’UTR 区调节成骨分化[12]。我们的实验验证了miR-135a-5p和Runx2 在MC3T3-E1 细胞的调控关系,并发现miR-135a-5p 在模拟失重条件下表达升高并且与Runx2 的蛋白表达呈负相关,转染miR-135a-5p inhibitor 可部分缓解模拟失重下Runx2 的蛋白表达降低。这些均表明miR-135a-5p 有望作为一个潜在的细胞内干预靶点,通过在体靶向研究技术,直接调控成骨细胞Runx2 的表达对抗失重性骨丢失。
综上,本实验通过RNAinter 预测靶向Runx2的4 条miRNA,并检测了其在模拟失重条件下的变化,结果发现miR-135a-5p 在模拟失重72 h 内显著上调且与Runx2 的蛋白表达呈负相关,验证了在MC3T3-E1 细胞中miR-135a-5p 可调控模拟失重条件下Runx2 的表达。本实验为确定miR-135a-5p 作为细胞内干预靶点,开展失重性骨丢失的小鼠在体靶向干预研究提供了实验依据。
