比较3D-FLAIR图像与hT2W-3D-FLAIR序列不同反转时间融合图像评估梅尼埃病膜迷路积水
2021-01-04张卫东谢佳培朱静怡李松柏
张卫东,谢佳培,朱静怡,李松柏,张 博*
(1.中国医科大学附属第一医院放射科,辽宁 沈阳 110001;2.中国医科大学附属第四医院放射科,辽宁 沈阳 110032)
梅尼埃病是一种以间歇性眩晕发作、波动性听力损失、耳鸣及耳闷等为特点的慢性疾病[1],其病理特点为内耳膜迷路积水[2]。经静脉注射钆对比剂后采集三维液体衰减反转恢复序列(three-dimensional liquid attenuation inversion recovery sequence, 3D-FLAIR)图像可用于观察梅尼埃病所致膜迷路积水[3-4],此时外淋巴呈高信号,耳蜗周围骨骼与内淋巴呈低信号,但两者之间边界不清;前庭膜迷路积水严重时,内淋巴与周围空气边界亦难以区分,评估影响膜迷路积水程度[5]。经鼓膜注射钆对比剂后采集三维真实重建反转恢复(three dimensional-real inversion recovery, 3D-real-IR)图像,显示内淋巴与周围骨骼的对比度较好,可区分内淋巴、外淋巴及骨骼结构,更好地显示膜迷路积水[5-7];但经静脉注射钆对比剂采集该序列图像却不能清晰显示上述结构,原因可能在于注射途径致外淋巴钆对比剂浓度较低[8]。经静脉注射钆对比剂后MRI评价膜迷路积水现已逐渐用于临床[9],但外淋巴强化程度不如经鼓膜注射[5,10]。NAGANAWA等[11]观察具有长回波时间的重T2 3D-FLAIR(heavy T2 3D-FLAIR, hT2W-3D-FLAIR)序列,发现重T2加权序列可增强液体信号与周围组织的对比度,提高检测低浓度钆对比剂的敏感度,辅以适当的反转时间以抑制内淋巴信号,其显示内淋巴优于传统3D-FLAIR和3D-real-IR序列。本研究比较传统3D-FLAIR图像与hT2W-3D-FLAIR序列融合图像评估膜迷路积水的价值。
1 资料与方法
1.1 一般资料 收集2019年3—12月40例临床诊断的单侧梅尼埃病患者,男23例,女17例,年龄21~74岁,平均(55.6±13.2)岁;其中19例左耳,21例右耳。纳入标准:①符合2015年美国耳鼻喉头颈外科学会制定的梅尼埃病诊断标准[12];②扫描前均经中耳CT检查排除中耳疾病;③无钆对比剂过敏史、神经性耳聋、中耳炎病史及耳部外科手术史。本研究经院医学伦理委员会批准(批准号:2018-298-2),所有患者均签署知情同意书。
1.2 仪器与方法 采用GE Signa Pioneer 3.0T MR扫描仪,21通道头线圈,常规行头部T2 FLAIR、内耳3D FIESTA-C Shim及T1W扫描;而后以流率2 ml/s经静脉注射对比剂钆布醇0.2 ml/kg体质量,采集内耳增强T1WI;注射对比剂4 h后行内耳3D-FLAIR、hT2W-3D-FLAIR序列扫描。扫描参数:3D-FLAIR,TR 9 000 ms,TE 163 ms,TI 2 175 ms,层厚1 mm,矩阵288×288,回波链长度180,激励次数4,扫描时间12 min 4 s;hT2W-3D-FLAIR,TR 9 000 ms,TE 377 ms,TI 2 250 ms(2 050 ms),层厚1.6 mm,矩阵288×288,激励次数2,扫描时间4 min 15 s。hT2W-3D-FLAIR(TI=2 250 ms)为外淋巴高信号、内淋巴低信号图像(positive perilymph image, PPI),hT2W-3D-FLAIR(TI=2 050 ms)为外淋巴信号抑制、内淋巴高信号图像(positive endolymph image, PEI)。对PEI进行反转,与PPI融合,得到融合图像。
1.3 图像分析 由1名具有30年神经系统影像学诊断经验的主任医师根据Nakashima膜迷路积水判定标准[13]评估膜迷路积水:以hT2W-3D-FLAIR融合图像和3D-FLAIR图像显示蜗管(基底转、中转和顶转)低信号区向前庭阶膨胀为耳蜗膜迷路积水阳性,前庭低信号区超过整个前庭面积的33.3%为前庭膜迷路积水阳性;发现患侧耳蜗任一转或前庭出现膜迷路积水时,即判定为内耳膜迷路积水。
1.4 统计学分析 采用SPSS 20.0统计分析软件。计数资料以频数表示。采用配对χ2检验比较2种序列检测患侧耳蜗基底转、中转、顶转和前庭膜迷路积水的差异。P<0.05为差异有统计学意义。
2 结果
2.1 MRI表现 2种序列图像均能清楚显示所有患耳耳蜗与前庭结构(图1),内淋巴区域均呈低信号,外淋巴因充盈对比剂而表现为高信号。周围骨骼和空气在3D-FLAIR图像上呈低信号,在融合图像上呈等信号(图2~4),故融合图像可更准确地区分内、外淋巴与周围骨骼空气的空间边界。

图2 患者男,67岁,左耳梅尼埃病 A.3D-FLAIR图像示左耳耳蜗基底转及前庭膜迷路积水,耳蜗基底转内淋巴(细箭)、周围骨骼和空气(粗箭)及前庭内淋巴(箭头)均呈低信号; B.融合图像示左耳耳蜗各转(基底转、中转、顶转)及前庭膜迷路积水,耳蜗各转内淋巴(细箭)及前庭内淋巴(箭头)呈低信号,周围骨骼和空气(粗箭)为等信号
2.2 2种序列显示膜迷路积水比较 融合图像显示耳蜗基底转、中转及顶转内淋巴积水的患耳数量明显高于3D-FLAIR图像(P均<0.05),显示前庭膜迷路积水患耳数量与3D-FLAIR图像差异无统计学意义(P>0.05),见表1。
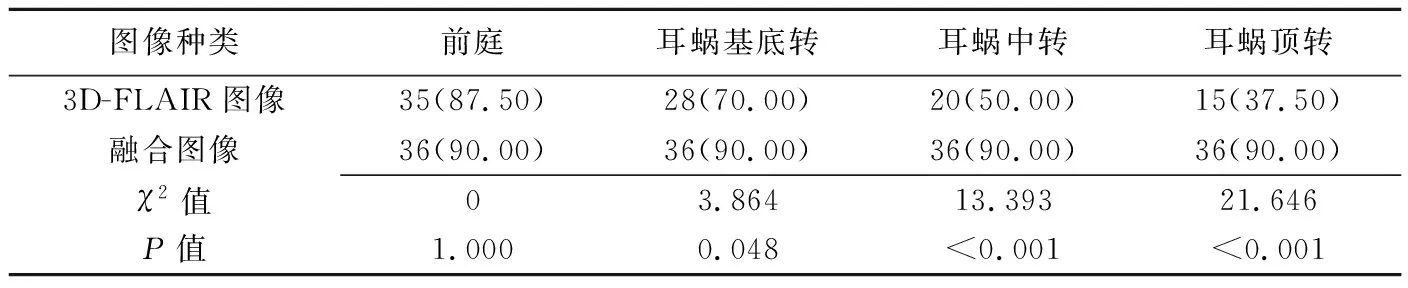
表1 3D-FLAIR图像与融合图显示膜迷路积水患耳数量比较[例(%),n=40]
3 讨论
TE指产生宏观横向磁化矢量的脉冲中点与回波中点的时间间隔,TE越长,T2权重越重;hT2W-3D-FLAIR序列的TE长于3D-FLAIR序列,故T2权重较3D-FLAIR序列更重。由于内外淋巴液的横向弛豫时间较长,周围骨骼及空气的横向弛豫时间较短,以hT2W-3D-FLAIR序列采集信号时,周围骨骼及空气的横向磁化矢量几乎完全衰减而残留较少,而内外淋巴液的横向磁化矢量残留较多,故内外淋巴液信号与周围骨骼及空气对比度增高,可更清晰地显示内外淋巴液与周围骨骼及空气的边界;通过适当选择反转时间获得PEI及PPI并进行融合获得融合图像,可更准确地评价膜迷路积水程度。
经周围静脉注射后,对比剂进入外淋巴的量较少,图像质量不及经鼓膜注射[14],为获得相当质量的图像,通常需要注射双倍剂量对比剂以提高外淋巴内药物浓度[15],存在一定风险,如发生肾源性纤维化[16]。既往研究[17]针对大鼠经静脉注射不同种类钆对比剂,发现皮肤中沉积的钆布醇含量最少。本研究经静脉注射双倍剂量钆布醇,低于最大允许剂量,且所有患者均未发现不良反应。
本研究结果显示,经静脉注射双倍剂量钆布醇后,融合图像中,内淋巴呈低信号,外淋巴为高信号,周围骨骼及空气为等信号,可清楚显示内淋巴的空间边界,与经鼓膜注射钆对比剂3D-real-IR序列图像类似[6],有助于区分内、外淋巴及周围结构边界,准确评价膜迷路积水程度,与NAGANAWA等[11]的研究结果一致。另外,hT2W-3D-FLAIR序列扫描时间显著少于3D-FLAIR序列,临床适用性更好。

图3 患者男,26岁,右耳梅尼埃病 A.3D-FLAIR图像示右耳前庭膜迷路积水,周围骨骼和空气(箭)及前庭内淋巴(箭头)均表现为低信号; B.融合图像示右耳前庭膜迷路积水,周围骨骼和空气(箭)为等信号,前庭内淋巴(箭头)显示为低信号

图4 患者男,40岁,左耳梅尼埃病 A.3D-FLAIR图像示左耳耳蜗中转膜迷路积水,耳蜗中转内淋巴(细箭)及周围骨骼和空气(粗箭)均呈低信号; B.融合图像示左耳耳蜗各转(基底转、中转、顶转)膜迷路积水,耳蜗各转内淋巴(细箭)为低信号,粗箭示周围骨骼和空气
早期梅尼埃病膜迷路积水起始于耳蜗顶转,即顶转最易扩张;之后随积水量增加而逐渐向下发展[18]。本研究结果表明,3D-FLAIR图像显示耳蜗顶转、中转、基底转水肿占比(37.50%、50.00%、70.00%)低于融合图像(90.00%、90.00%、90.00%),后者不仅检出3D-FLAIR图像显示的所有内淋巴积水,更能识别其未能检出的耳蜗内淋巴积水。3D-FLAIR图像中,耳蜗内淋巴与周围骨骼及空气均呈低信号。顶转发生水肿、尤其轻度水肿时,顶转内淋巴间隙与周围骨质相邻而难以清楚辨认。融合图像显示结果更符合梅尼埃病耳蜗内淋巴积水由顶转向基底转发展的进展过程,提示融合图像较3D-FLAIR图像显示耳蜗早期或轻度膜迷路积水更有优势。
本研究中2种序列图像显示前庭膜迷路积水患耳数量差异无统计学意义,推测原因可能在于前庭形态较耳蜗结构更为饱满,发生前庭膜迷路积水时,受压的外淋巴边缘范围更加明显,使得2个序列图像均能较好地显示。
综上所述,与3D-FLAIR图像相比,hT2W-3D-FLAIR融合图像对评估内梅尼埃病膜迷路积水更具有优势。本研究的局限性:①需2次扫描获得融合图像,可能因患者位置偏移而影响融合图像质量;②膜迷路积水未经组织病理结果证实。
