苜蓿连作对盐碱土壤微生物群落结构的影响
2021-01-04徐玉鹏黄素芳王秀领赵忠祥阎旭东
刘 震,徐玉鹏,黄 伟,黄素芳,王秀领,赵忠祥,阎旭东*
(1沧州市农林科学院,河北沧州 061001;2沧州市科技创新服务中心,河北沧州 061001)
土壤中种类繁多且具有不同功能特性的微生物,是生态系统中最重要和活跃的组成部分及土壤养分循环的主要驱动力[1,2],也是评价土壤质量和生产力的重要指标[3]。土壤微生物不仅参与了土壤矿质元素循环、有机质形成和发展以及自然环境掉落物的腐解过程,而且在植物生长发育及作物病虫害防治方面也有重要作用[4,5]。
苜蓿是多年生豆科植物,因其产量高,营养丰富被称为“牧草之王”,已作为一种优质的牧草在我国大面积种植[6]。在土壤贫瘠地区进行苜蓿栽培既可以解决当地牲畜饲料问题,同时又可以利用苜蓿广泛的适应性改善土壤理化性质,具有较高的生态效益[7,8]。贾倩民等[9]研究表明,干旱区盐碱地栽培苜蓿可以降低土壤容重及pH值,提高土壤有机质和全氮含量。杨珍平等[10]通过根管土柱试验研究了苜蓿对黄土母质生土的影响,发现土壤经过苜蓿根际穿插、切割和挤压作用,促进了土壤孔隙度的增加,同时提高了土壤酶活性,使土壤肥力水平向有利于作物生长的方向发展。张宝泉等[11]研究发现,随着紫花苜蓿连作年限增加,土壤有机质、全氮、全磷等养分指标增加,而主要养分与微生物生物量之间存在一定的相关性。但由于常用的土壤微生物多样性研究方法如DNA重组、DNA-DNA杂交、变性梯度凝胶电泳(DGGE)、温度梯度凝胶电泳(TGGE)等无法用于详细分析土壤微生物群落结构组成[12],而且目前苜蓿栽培与生态环境间关系的相关研究较少。因此本研究采用二代高通量测序技术,从细菌和真菌群落构成、土壤环境因子及二者相互关系等方面探讨苜蓿连作对黑龙港地区土壤微生物群落结构的影响,从生态角度阐述苜蓿连作改善土壤环境的部分机理,为推动苜蓿种植、全面发展草产业提供科学依据。
1 材料与方法
1.1 土壤
供试土壤为4年生苜蓿根际土壤(Y4),于2018年7月15日取自河北省沧州市献县北张白村沧州市农林科学院试验基地(116.36°E,38.31°N)。选取紧邻研究对象的未耕作土壤作为对照(YO)。根据5点取样法,每处理按照梅花形确定5个采样点,选取生长良好的苜蓿样品,去除其周边及表层杂草后,用抖落法取水平深度0~20 cm苜蓿根际土壤约10 g。将5个采样点的土壤充分混匀后,采用四分法选取1份土壤样品装入无菌密封袋,放入装有干冰的泡沫箱中。每个处理3次重复,待全部样品采集完成后置于超低温冰箱-80℃保存待测。
1.2 土壤理化性质测定
分别采用重铬酸钾法、碱解扩散法、Olsen法和火焰光度法测定有机质、碱解氮、有效磷和速效钾含量;采用酸度计电位法测定pH值。
1.3 苜蓿根际微生物多样性测定
采用二代高通量测序技术对苜蓿根际土壤样品中微生物的DNA特定长度(区域)PCR产物进行测序分析。具体操作步骤为:将土壤提取基因组后用1%的琼脂糖凝胶电泳检测总DNA提取质量,采用NanoDrop-ND1000测定总DNA浓度。采用引物(F1:5′-ACTCCTACGGGAGGCAGCA-3′,R1:5′-GGACTACHVGGGTWTCTAAT-3′)扩增细 菌16S rDNA基因V3+V4区域,采用引物(F2:5′-CTTGGTCATTTAGAGGAAGTAA-3′,R2:5′-GCTGCGTTCTTCATCGATGC-3′)扩增真菌ITS区域,回收PCR产物并测定浓度后进行测序。测序由北京百迈客科技有限公司采用Illumina-HiSeq平台完成。
1.4 数据分析
使用FLASH V1.2.7软件通过overlap对每个样品的reads进行拼接,得到拼接序列数据(Raw Tags),再采用Trimmomatic V0.33软件,对拼接得到的Raw Tags进行过滤,得到高质量的Tags数据,最后采用UCHIME V4.2软件鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags)用于信息分析。采用SPSS22.0进行数据统计分析。
2 结果与分析
2.1 苜蓿连作对土壤理化性质的影响
由表1可知,种植苜蓿会对土壤理化性质产生影响。同对照(Y0)相比,连作4年苜蓿(Y4)土壤有机质和碱解氮含量提高了54.33%和24.93%,pH值和有效磷含量降低了4.80%和32.36%,且变化幅度均达显著水平(P<0.05)。土壤速效钾含量虽有变化,但未达显著水平(P>0.05)。通过种植苜蓿降低了土壤pH值,减少了土壤盐渍化,同时提高了土壤有机质及碱解氮含量,起到了改善土壤环境的作用。
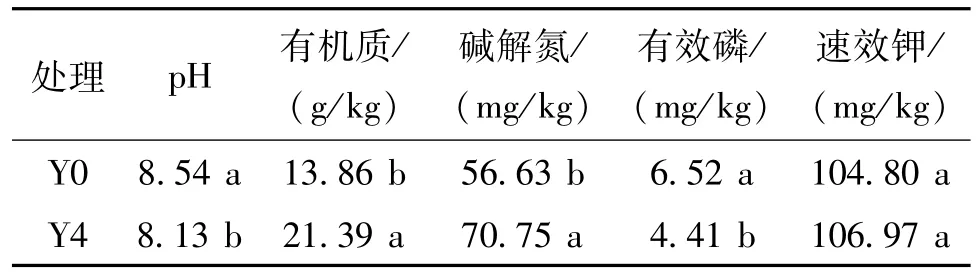
表1 不同处理土壤理化性质Table 1 Physical and chemical properties of soil in different treatments
2.2 苜蓿连作对土壤微生物指数的影响
样品经过双端Reads拼接、过滤后,2处理根际土壤细菌V3+V4区域获得有效序列338 043条,真菌ITS区获得有效序列324 888条,样品覆盖度均高于99.95%,符合检测标准。按照样品97%相似度水平划分OTUs,并统计ACE、Chao1、Shannon及Simpson指数,结果列于表2。
从表2可见,与对照相比,Y4处理细菌及真菌OTUs数量分别增加了21.05%和19.06%,说明通过种植苜蓿,可以增加土壤环境中微生物种类。比较细菌及真菌ACE指数及Chao1指数后可以发现,2个指数规律与OTUs相似,说明Y4处理土壤中细菌及真菌相对丰度(即微生物数量)均高于Y0处理。细菌及真菌Simpson指数表现为Y0大于Y4,Shannon指数则相反,也说明Y4样品的物种多样性高于对照Y0。由此可见,苜蓿连作后土壤根际微生物数量及种类均在一定程度上得到提高。

表2 根际土壤微生物多样性指数Table 2 Soil microbial diversity index
2.3 苜蓿连作对土壤细菌群落构成的影响
根据细菌分类相对丰度排名前10名结果(表3),门水平上Y0处理和Y4处理细菌群落构成相似,前10名分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)。变形菌门和酸杆菌门在Y0和Y4 2个处理中相对丰度均大于10%,其他细菌在Y0处理中相对丰度为1%~10%;而Y4处理除放线菌门(13.16%)外,其他7个细菌门类相对丰度均小于10%。与对照Y0相比,Y4处理酸杆菌门、放线菌门、芽单胞菌门、绿弯菌门和疣微菌门细菌相对丰度增加,分别提高了4.49、6.39、1.27、0.91和0.26个百分点;变形菌门、拟杆菌门、厚壁菌门、硝化螺旋菌门和浮霉菌门细菌则低于对照,相对丰度分别降低了7.63、3.13、3.08、0.15和0.06个百分点。
将相对丰度大于1%的细菌按类别进行划分,其余部分划为其他及未分类,可组成纲水平上的细菌分类。由表3可知,Y0中除α-变形菌纲(Alphaproteobacteria)和γ-变形菌纲(Gammaproteobacteria)外,其余细菌群落丰度均小于8%;Y4中除α-变形菌纲外,其余细菌群落均小于8%。2处理中α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、β-变形菌纲(Betaproteobacteria)和Subgroup_6等细菌群落相对丰度均大于5%,但芽胞杆菌纲在Y0土壤中的相对丰度为5.46%,在Y4土壤中仅2.87%。总体上看,与Y0相比,Y4土壤中相对丰度提高20%以上的细菌群落有芽单胞菌纲(Gemmatimonadetes)、放线菌纲(Actinobacteria)、Blastocatellia、Subgroup_6;相对丰度降低20%以上的细菌群落有γ-变形菌纲、δ-变形菌纲、芽胞杆菌纲(Bacilli)和鞘脂杆菌纲(Sphingobacteriia)。
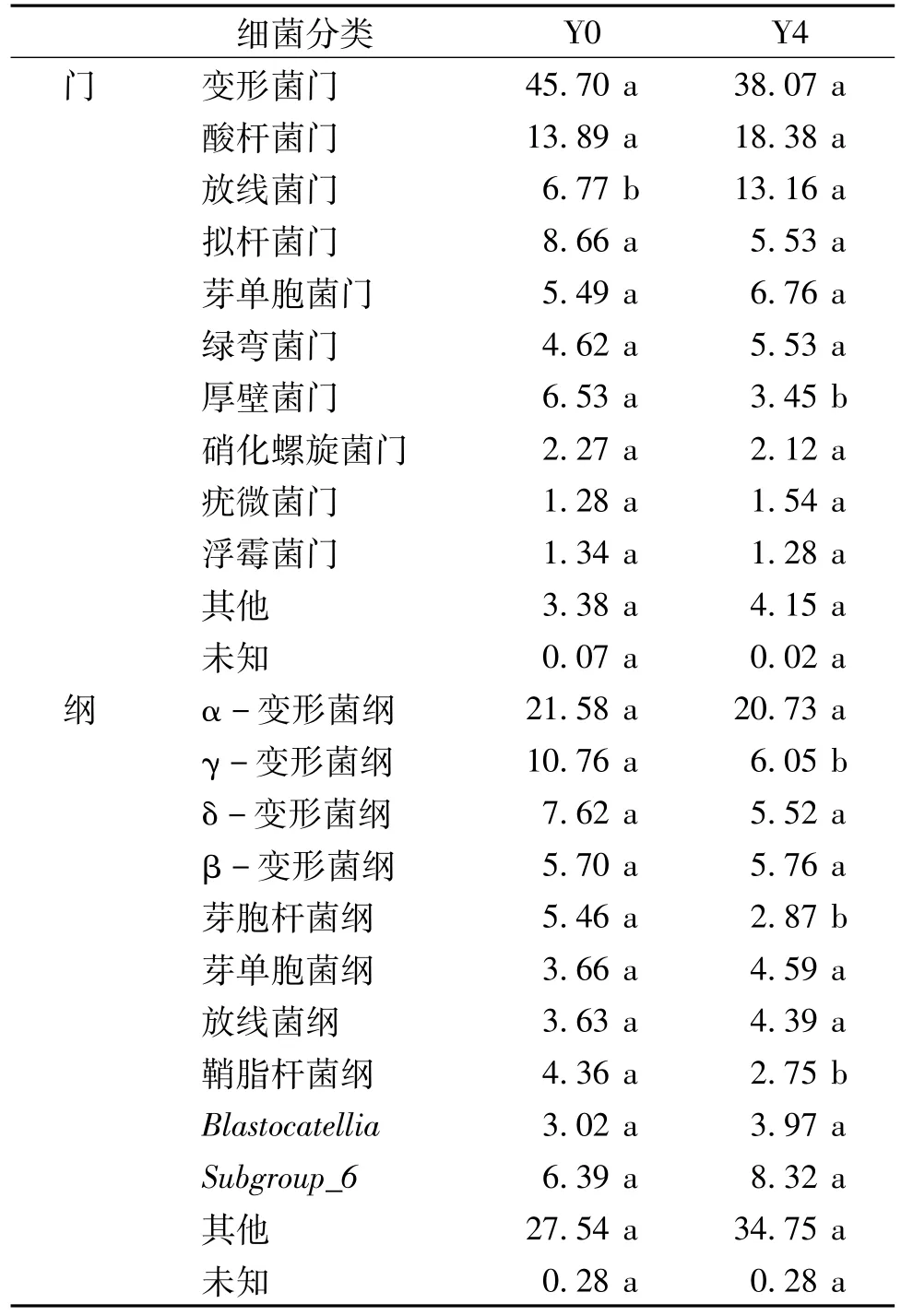
表3 细菌群落构成 %Table 3 Bacterial community composition
2.4 苜蓿连作对土壤真菌群落构成的影响
从门水平上的真菌分类结果上看(表4),按照相对丰度由高到低排列,土壤中主要存在10个真菌门,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、新美鞭菌门(Neocallimastigomycota)、毛霉门(Mucoromycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)、油壶菌门(Olpidiomycota)、丝足虫门(Cercozoa)和Aphelidiomycota。其中,Y0土壤中,子囊菌门真菌相对丰度较高,占58.90%;其次为担子菌门真菌,占12.11%。Y4土壤中,子囊菌门真菌相对丰度为66.14%,比对照高12.29%;担子菌门真菌相对丰度为10.36%,较对照低14.45%;新美鞭菌门、毛霉门、球囊菌门、壶菌门、油壶菌门和Cercozoa相对丰度分别比对照高37.89%、34.43%、59.09%、4.0%、42.86%和225.0%;Aphelidiomycota相对丰度则比对照低80.0%;被孢霉门相对丰度无显著差异。
2个处理中,纲水平上粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotiomycetes)和酵母菌纲(Saccharomycetes)相对丰度均大于5%,为根际土壤中优势菌种;锤舌菌纲(Leotiomycetes)、新囊菌 纲(Neocallimastigomycetes)、孢霉纲(Mortierellomycetes)、毛霉纲(Mucoromycetes)、伞菌纲(Agaricomycetes)和节担菌纲(Wallemiomycetes)相对丰度为1%~4%。与Y0相比,Y4土壤中粪壳菌纲、散囊菌纲、新囊菌纲、孢霉纲、伞菌纲和节担菌纲真菌群落相对丰度均提高了17.55%~37.97%;座囊菌纲、酵母菌纲、锤舌菌纲和毛霉纲真菌则降低了0.08%~21.77%。可见,连作苜蓿4年后,根际土壤间真菌群落构成发生了较大变化。

表4 真菌群落构成 %Table 4 Fungal community composition
2.5 微生物群落与土壤理化性质的相关性
为了阐明环境因子对土壤微生物群落结构的影响,在门水平上对土壤中细菌和真菌与土壤环境因子间的相关性进行了分析(表5)。结果表明,细菌群落结构中,变形菌门与pH呈负相关,与有机质(以下简称OM)、碱解氮(以下简称AN)、有效磷(以下简称AP)和速效钾(以下简称AK)呈正相关,硝化螺旋菌门的结果则相反,为负相关;酸杆菌门和放线菌门与pH、OM、AN和AK呈负相关,与AP呈正相关;芽单胞菌门除与pH及AP呈正相关外,与其余环境因子呈负相关关系;拟杆菌门同各环境因子均呈正相关,绿弯菌门结果同前者相反;厚壁菌门与pH、OM和AN呈正相关,与AP和AK呈负相关;疣微菌门与pH和OM呈负相关,与AN、AP和AK呈正相关;浮霉菌门除与OM呈正相关外,与其余环境因子均呈负相关。因此,OM、AN和AK等环境因子是与细菌群落变化相关性较大的土壤理化指标。
而在真菌群落结构中,子囊菌门与pH、AN和AK呈正相关,与OM和AP呈负相关;担子菌门除与AP呈负相关外,与其余环境因子均呈正相关;被孢霉门与pH和OM呈正相关,与AN、AP和AK呈负相关;油壶菌门与AP呈正相关,新美鞭菌门、毛霉门、球囊菌门、胡菌门真菌门类与各环境因子均呈负相关;丝足虫门与各环境因子间呈正相关;Aphelidiomycota与pH、OM和AN呈正相关,与AP和AK呈负相关。同其它环境因子相比,当AN和AK产生变化时,真菌群落反应较敏感。综合分析可以得出,除有机质可以影响土壤细菌群落变化外,碱解氮和速效钾也是影响土壤微生物群落变化的环境因子。
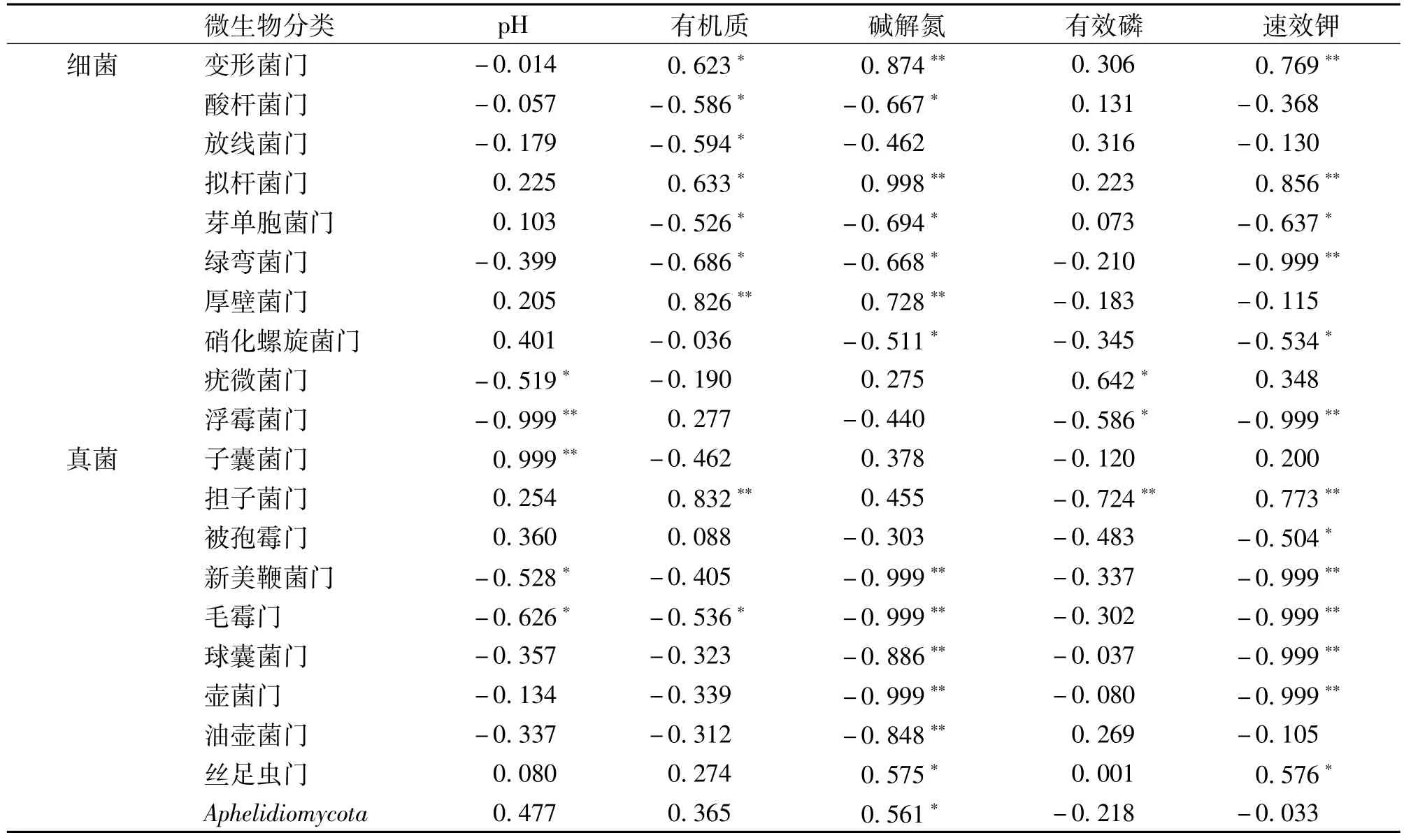
表5 土壤微生物相对丰度与环境因子的相关系数(门水平)Table 5 Correlation coefficient between relative abundance of soil microorganisms and environmental factors(Phylum)
3 讨论与结论
本研究采用第二代高通量16S rDNA测序技术对土壤样品中的所有微生物保守区序列进行检测,分析土壤中微生物物种的相对丰度及群落组成[13],可以更加真实反映土壤微生物组成情况。结果表明,苜蓿连作4年后,显著降低了土壤pH值,缓解了土壤盐碱化;增加了土壤有机质及碱解氮含量,提高了可供作物吸收的土壤养分;土壤中有效磷含量显著低于对照,可能是由于苜蓿生长过程中需要大量磷素,种植户在生产过程中为了减少成本投入磷肥量较少,导致连作4年后土壤中有效磷含量低于对照;土壤中速效钾含量在2个处理中差异不显著,说明其受苜蓿连作影响较小。同时,土壤中细菌和真菌多样性及相对丰度有所提高,增强了土壤抵抗逆境的能力。
苜蓿连作后细菌群落构成变化较大。同对照相比,连作4年后土壤中酸杆菌门细菌相对丰度提高了32.33%,而酸杆菌门细菌可以提高纤维素分解能力,部分细菌甚至可能具有光合作用[14,15],在分解植物残体和碳循环中起到了重要的作用;放线菌门相对丰度提高了94.39%,放线菌门可以产生多种次生代谢产物和胞外酶,因此在植物病害的防御方面有重要作用[16]。Mendes等[17]研究发现,土壤抗病能力同根际土壤中放线菌相对丰度成正相关,病害发生率较低的土壤中,放线菌的数量总是高于病害发生率较高的土壤。变形菌门和厚壁菌门相对丰度分别降低了16.70%和47.17%,Broszat等[18]、井晓欢等[19]和Liu等[20]研究表明,这两类细菌在逆境中数量会急剧增加。γ-变形菌纲、芽孢杆菌纲和α-变形菌纲的细菌则可以降解二甲四氯(MCPA,一种有机农药),从而使自身占据菌群优势。从试验结果来看,上述3个细菌纲均有不同程度的降低,说明连作苜蓿可在一定程度改善土壤环境质量。
根据真菌群落结构分析结果,子囊菌门所占比例最大,担子菌门次之。子囊菌可以产生大量的无性孢子,从而快速生长,这与王艳云等[21]研究结果相同。有研究认为,子囊菌是土壤中重要的真菌分解者,对降解土壤有机质起着重要的作用[12];也有研究认为,担子菌能够很好地降解木质纤维素,其种类丰富,具有食用和药用价值,也有一些是有害真菌,会使作物产生病害。随种植年限增加,担子菌门的相对丰度逐渐降低,可能与苜蓿周年刈割多次,凋落物较少,未能为担子菌提供更适宜的生存环境有关;球囊菌门中部分真菌能够与植物形成互利共生联合体,帮助植物吸收氮、磷等元素,提高植物对土传病害和干旱等生物及非生物胁迫的耐受性[22];油壶菌及伞菌纲相对丰度同土壤有机质、碱解氮等土壤理化性质呈显著正相关[23]。
综合分析表明,种植苜蓿可以降低土壤盐碱化程度,增加土壤养分,改善土壤生态环境,提高土壤抗逆能力。尤其是多年连作后,可以提高土壤微生物多样性,使有益微生物群落数量显著增加,研究结果为筛选适宜盐碱地区生存微生物菌株,开发相应的生物肥料奠定了基础,也为在华北地区推广苜蓿种植提供了理论依据。
