1株桑叶内生生防多黏类芽孢杆菌可湿性粉剂的制备及应用效果
2021-01-02王娜王彪蔡灏漾戚昱琦陈爱明唐子恒古扎来达吾坎尔
王娜 王彪 蔡灏漾 戚昱琦 陈爱明 唐子恒 古扎来?达吾坎尔


摘要:以筛选自健康桑树叶片的1株多黏类芽孢杆菌(Paenibacillus polymyxa)为研究对象,通过单因素试验、正交试验结合生物相容性确定可湿性粉剂的最佳配方,探讨可湿性粉剂的促生效应和安全毒理性,在此基础上探索菌株促生和拮抗机制。结果表明,可湿性粉剂的最佳配方为发酵液70%、载体硅藻土10%、分散剂聚乙烯醇5%、湿润剂十二烷基苯磺酸钠10%、稳定剂磷酸钾2.5%、保护剂糊精2.5%。可湿性粉剂主要性能检测结果显示,菌含量约为7.0×108 CFU/g,悬浮率为92.99%,湿润时间为20 s,细度为96.2%,pH值为 6.8,含水量为1.81%。可湿性粉剂热稳定性较好,耐受弱酸弱碱环境。平板对峙试验结果表明,可湿性粉剂对桑青枯病病原菌5号小种和灰霉菌仍有较高的拮抗性能,灌根处理对番茄幼苗有明显促生效果。浸根和茎穿刺处理对番茄幼苗无害;经口灌胃试验小鼠表明可湿性粉剂低毒性,对雄性个体影响较小,对雌性个体的伤害较大。培养基定性分析结果显示菌株可产生铁载体,能产生有机酸、胞外纤维素酶和蛋白酶,从而直接或间接促进植物生长和抑制病原菌的生長。
关键词:内生菌;多黏类芽孢杆菌;可湿性粉剂;促生;毒性;抑菌活性
中图分类号:S482.2+92 文献标志码: A
文章编号:1002-1302(2021)23-0115-10
收稿日期:2021-04-09
基金项目:江苏科技大学博士启动基金(编号:1102931901)。
作者简介:王 娜(1976—),女,山东烟台人,博士,副教授,主要从事植物病理学研究。E-mail:biojustwn@126.com。
农业生产受多方面制约,植物病害是其中主要因素之一。农业生产上,化学药剂是防治植物病害的主要手段,虽然防治效果显著,但是由于长期不合理使用,病原菌抗药性增强、环境污染严重、生物多样性破坏以及高毒高残留等[1-4]负面问题层出不穷。随着人们环保意识以及农产品安全意识的不断增强,生物防治受到了国内外植物保护工作者的重视,其中对环境友好的微生物农药受到人们青睐[5]。
生防细菌作为微生物农药的开发源之一,同其他生防微生物相比具有存在广泛、群体庞大、繁殖迅速、代谢活动复杂、对病原菌作用方式多样等特点,成为开发热点。目前研究者已从不同来源分离并鉴定出多种具有抗植物病原菌活性的生防细菌,其中以芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)生防细菌研究应用最多[6-9]。生防细菌来源广泛[10],但植物内生细菌因与植物互利共生、抗逆性强、危害小、定殖快等优点,成为微生物农药研究的主要对象[11-12]。
目前,利用植物内生菌作为微生物农药防治植物病害还存在一定问题。植物内生菌本身是一个生物活体,运输和保存对药效保持有重要影响。用于生物防治时,田间环境(土壤、植株表面及根际分泌物等)和植物体微生态环境中许多因子都会影响内生菌的生长和防病作用的发挥,从而造成内生菌的防治效果不稳定。同时内生菌产生的活性物质研究尚不成熟,难以得到较为纯净的有效成分,进而也影响了内生菌的实际应用。剂型的制备有利于生防菌的保护、稀释和缓释有效成分,扩大微生物农药的使用范围。可湿性粉剂(WP)是以包括生防菌在内的发酵液作为剂型化研究对象,既包含生防菌菌体又包含其产生的对植物病害有抑制作用的物质,制剂的防效作用更大。同时成本低、活性稳定,便于生产和商品化,是微生物农药的主要剂型[13]。
多黏类芽孢杆菌(Paenibacillus polymyxa)是芽孢杆菌科(Bacillaceae)类芽孢杆菌属(Paenibacillus)革兰氏阳性细菌,在自然界中分布广泛[14]。多黏类芽孢杆菌可以产生多种性能稳定的抗菌抑菌物质,可以防治多种由卵菌、真菌、细菌和线虫等引起的植物病害;同时还可以作为植物根际促生菌,通过产生激素、铁载体、溶磷性等直接或间接促进植物生长[15-18]。多黏类芽孢杆菌是被美国环境保护署(EPA)列为可商业应用的微生物种类之一,可用于农业、工业和水处理等方面[19];2006年也被我国农业部列为免做安全鉴定的一级菌种,是一种重要的病害生物防治微生物。
笔者所在课题组在前期工作中从健康桑树叶片中分离筛选出1株多黏类芽孢杆菌,对多种植物病原细菌和病原真菌具有广谱抗性,根际浇灌植物,能促进植物生长,在生物防治方面具有一定的潜能[20]。本研究以此菌株发酵液为原药,研究不同载体、湿润剂、分散剂和保护剂等助剂与菌细胞的生物相容性,通过正交试验筛选可湿性粉剂的优良配方,并测定该制剂对番茄生长的影响以及应用安全性和毒理性,并初步探究该菌株的促生长和拮抗特性,为此多黏类芽孢杆菌的进一步开发利用奠定基础。
1 材料与方法
1.1 试验时间及地点
试验于2019—2020年在江苏省镇江市四摆渡江苏科技大学西校区植物生物技术试验室开展。
1.2 供试菌株
供试内生菌株381分离自健康桑树(Morus alba L.)叶片,桑叶于2018年4月采自中国农业科学院蚕业研究所国家种质镇江桑树圃(桑树品种为9703)。生防细菌对多种病原细菌和病原真菌有较强拮抗作用。结合形态学和生理生化特征以及16S rRNA序列分析鉴定其为多黏类芽孢杆菌(Paenibacillus polymyxa)[20],现保存在江苏科技大学植物生物技术试验室。
供试病原细菌为桑青枯菌5号小种(Ralstonia solanacearum race 5),由中国农业科学院蚕业研究所桑病研究室提供。供试病原真菌为灰霉菌(Botrytis cinerea),由江苏科技大学植物生物技术试验室提供。
1.3 可湿性粉剂的制备
1.3.1 菌株粉剂制备液制备
用接种环将菌株接种于LB(lysogeny broth)液体培养基中(50 mL/150 mL),37 ℃、120 r/min振荡培养48 h,即得种子液。将种子液以体积分数3%接种量接入装液量为125 mL/250 mL的LB液体培养基中,32 ℃、120 r/min振荡培养 20 h,即得粉剂制备液。经测定制备液中菌含量为2.0×108~7.0×108 CFU/mL,芽孢率≥90%。
1.3.2 载体与助剂的初步筛选
分别将载体(滑石粉、高岭土、硅藻土、轻质碳酸钙)按照质量浓度为5%的比例,分散剂[木质素磺酸钠、羧甲基纤维素钠(CMC-Na)、聚乙烯醇(PVA)]按1.5 mg/mL的比例,湿润剂[十二烷基硫酸钠(SDS)、十二烷基苯磺酸钠(SDBS)、皂荚粉]按照0.25 mg/mL的比例,稳定剂[碳酸钙(CaCO3)、磷酸钾(K3PO4)、磷酸二氢钾(KH2PO4)、羧甲基纤维素钠(CMC-Na)]按照1.0 mg/mL的比例添加进LB培养基内,高压蒸汽灭菌后,制成平板。吸取1 mL粉剂制备液稀释105倍,分别取0.1 mL稀释液涂布在含有不同载体、分散剂、湿润剂和稳定剂的LB培养基平板上,以LB培养基作对照,每组3次重复。将平板置于37 ℃培养箱中静置培养12 h,记录各平板菌落数量,初步筛选出优势载体和助剂[21]。
1.3.3 可湿性粉剂的母粉制备
将生防菌粉剂制备液与初步筛选出的优势载体、分散剂、湿润剂和稳定剂按照制备液70%、载体15%、分散剂5%、湿润剂5%和稳定剂5%的比例混合搅匀,真空冷冻干燥24 h。干燥后的粉剂研磨成粉,制成可湿性粉剂母粉,用于复筛分散剂和湿润剂。
1.3.4 分散剂与湿润剂的复筛
在母粉制作中,制备液、载体、湿润剂和稳定剂种类及比例不变,分别将3种分散剂按照5%比例添加进母粉中,以不添加分散剂为对照,综合悬浮率、润湿力和生物相容性考虑,选择效果最佳分散剂。
在母粉制作中,制备液、载体和稳定剂种类及比例不变,按5%比例添加上述筛选的最佳分散剂,分别将3种湿润剂按照5%比例添加进母粉中,以不添加湿润剂为对照,综合悬浮率、润湿力和生物相容性考虑,选择效果最佳的湿润剂。
1.3.5 正交设计
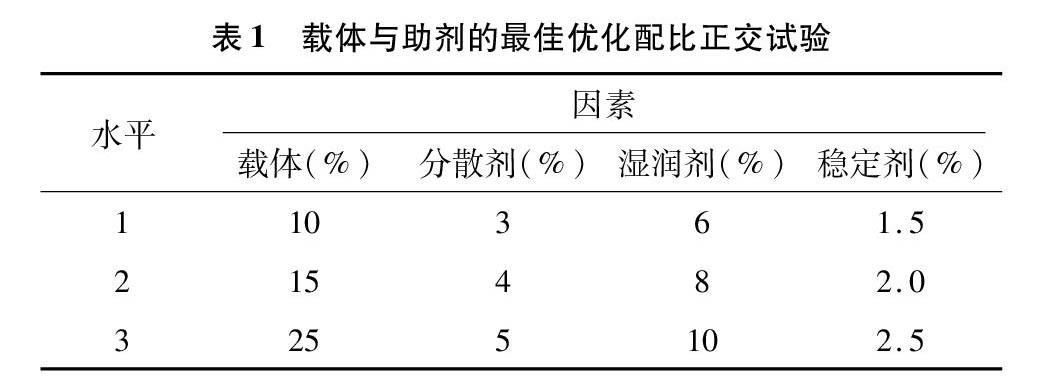
在上述试验的基础上,为了使可湿性粉剂的湿润时间和悬浮率达到最优,利用正交试验法(表1),以悬浮率和湿润时间为考察因素,对筛选出的载体和助剂进行考察,以确定最佳添加比例。
1.3.6 紫外保护剂的筛选
将4种紫外保护剂抗坏血酸、荧光素钠、糊精和黄原胶按与稳定剂添加量相同的比例添加到已确定的最佳配比中,制成可湿性粉剂。将可湿性粉剂和无菌蒸馏水按照1 g ∶9 mL的比例混合均匀,置于距离紫外灯(254 nm,20 W)40 cm处照射12、24 h。将粉剂液用无菌蒸馏水稀释104倍,取0.1 mL涂布在LB平板上,37 ℃ 培养箱中静置培养12 h,计算存活率。以不加保护剂作对照,每个处理重复3次。
1.4 可湿性粉剂指标检测
1.4.1 粉剂悬浮率、湿润时间、细度和pH值
按照国家标准GB/T14825—2006[22]、GB/T5451—2001[23]、GB/T16150—1995[24]、GB/T1601—1993[25]分别对粉剂的悬浮率、湿润时间、细度、pH值进行测定。
1.4.2 粉剂含水量
称取 10 g 样品放在已准确称量的培养皿(m1)中,105 ℃烘箱中持续烘干至恒质量(m2)。含水率=(m1+10-m2)/10×100%。
1.4.3 粉剂稳定性
热稳定性:1 g粉剂用500 mL无菌蒸馏水稀释,平均分成5份,分别置于25、30、50、75、100 ℃温度下水浴20 min,冷却至室温。各取 0.1 mL 稀释液均匀涂布在LB平板上,每组重复3次。将平板放入37 ℃培养箱培养12 h,记录平板菌落数。
酸碱稳定性:1 g粉剂用500 mL蒸馏水稀释制成稀释液。取稀释液8份,每份50 mL,分别用 0.1 mol/L HCl和0.1 mol/L NaOH调至pH值为 4、5、6、7、8、9、10、11。各取0.1 mL稀释液均匀涂布在LB平板上,每组重复3次。将平板放入37 ℃培养箱培养12 h,记录平板菌落数[26]。
1.5 可湿性粉剂安全性和毒理性试验
1 g粉剂用500 mL蒸馏水稀释制成稀释液。取在盆钵中培育30 d且生长良好、长势一致的番茄幼苗20株(1株/盆),分为4组,每组5株。对2组试验组幼苗进行浸根和针穿刺茎处理。浸根处理时将幼苗小心拔起,流水清洗去掉浮土,再用无菌水反复冲洗多次。将幼苗根完全浸泡在粉劑稀释液中 30 min,以无菌水处理作对照,处理后重新移栽在灭菌营养土中,常规培养14 d后观察生长情况。针穿刺茎处理时在幼苗茎高度一半的位置用灭菌刀片划5 mm的小口并用移液枪吸取40 μL粉剂稀释液接种,以无菌水作对照。常规培养14 d后观察生长情况。
依据文献[27],以小鼠为材料,运用霍恩氏法将小白鼠分为剂量组1(0.316 mg/20 g)、剂量组2(1.000 mg/20 g)、剂量组3(3.160 mg/20 g)、剂量组4(10.000 mg/20 g)、空白对照组(0 mg/20 g)以测定半数致死量(LD50)。每组10只,雌雄各半(5雄5雌),灌胃前隔夜禁食但不禁水,称质量后1次灌胃给药,灌胃后至少间隔3 h进食。4组分别按剂量组用量 2 mL 无菌水稀释后经口灌胃。以14 d(每天固定时间灌胃1次)为1个周期测试粉剂急性经口毒性,并分析小鼠体质量和脏器系数变化,确定粉剂毒理性。
1.6 可湿性粉剂对病原菌的抑制效果
取直径为6 mm的病原菌菌块接种在KB培养基(病原细菌)和马铃薯葡萄糖琼脂(PDA)培养基(病原真菌)平板中央,两侧适当距离处各放一无菌滤纸片(直径6 mm)。0.1 g粉剂用50 mL无菌蒸馏水稀释,取20 μL粉剂稀释液滴加在滤纸片上,37 ℃ 静置培养24 h,观察试验结果。
1.7 可湿性粉剂促生效果试验
取生长良好、生长势一致的15 d盆栽番茄幼苗(1棵/盆),试验组每2 d浇灌1次粉剂稀释液,每次50 mL,以浇灌蒸馏水为对照。每组重复10次,培养30 d,观察番茄幼苗生长效果[28]。
1.8 菌株的促生长和拮抗特性分析
1.8.1 促生长特性分析
溶磷性分析:将菌株点接在NBRIP培养基[葡萄糖10.00 g,MgCl2·6H2O 5.00 g,Ca3(PO4)2 5.00 g,MgSO4·7H2O 0.25 g,KCl 0.20 g,(NH4)2SO4 0.10 g,蒸馏水1 000 mL,pH值7.0]平板上,37 ℃倒置培养4 d,观察是否有无色透明圈[29]。
产铁载体分析:将菌株点接在CAS培养基平板上,37 ℃倒置培养4 d,观察是否有黄色光圈[30]。
产吲哚-3-乙酸(IAA)分析:将菌株接种于浓度为100 mg/L色氨酸的LB液体培养基中,37 ℃、120 r/min条件下振荡培养24 h。取100 μL菌悬液滴于白色瓷板上,同时加入等量的Salkowski显色液进行显色反应。同时以加入100 μL IAA(50 mg/L)的标准溶液为阳性对照。室温避光条件下30 min后,若颜色变红则表示有IAA产生[31]。
1.8.2 拮抗特性
产有机酸分析:将菌株点接在产有机酸分析培养基(葡萄糖6.0 g,酵母浸膏1.0 g,蛋白胨1.0 g,MgSO4·7H2O 0.2 g,CaCO3 1.0 g,溴甲酚紫微量,琼脂15.0 g,蒸馏水1 000 mL,pH值为7.2~7.4)平板上,37 ℃倒置培养2 d,观察是否有黄色的光圈[32]。
产纤维素酶分析:配制产纤维素酶分析培养基(葡萄糖1.0 g,酵母浸膏0.1 g,蛋白胨0.5 g,琼脂15.0 g,羧甲基纤维素钠5.0 g,蒸馏水1 000 mL),将菌株点接在平板上,37 ℃倒置培养3 d。培养皿中加入0.2 %刚果红染液,40 min后倒掉染色液,再加入1 mol/L NaCl脱色15 min,观察是否有黄色降解圈[33]。
产蛋白酶分析:配制产蛋白酶分析培养基(葡萄糖1.0 g,酵母浸膏0.1 g,蛋白胨0.5 g,琼脂 15.0 g,蒸馏水1 000 mL,pH值为6.0。高压灭菌后再加入50 mL灭菌的8%明胶溶液),将菌株点接在平板上,37 ℃倒置培养3 d。培养皿中加入饱和硫酸铵溶液浸没菌落,30 min后倒掉溶液,观察是否有无色透明圈[33]。
产几丁质酶分析:将菌株点接在产几丁质酶分析培养基(胶体几丁质5.0 g,蛋白胨5.0 g,酵母浸膏2.5 g,NaCl 5.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH值为7.0~7.4)平板上,37 ℃倒置培养2 d,观察是否有无色透明圈[34]。
1.9 数据分析
采用Microsoft Excel 2007软件处理数据和制图,采用SPSS软件Duncans多重分析进行差异显著性检验。
2 结果与分析
2.1 载体及助剂的初筛
以粉剂活菌量为检测指标,从生物相容性的角度来分析,高岭土、滑石粉和轻质碳酸钙3种载体显著抑制生防菌的生长,而硅藻土与对照组差异不显著(图1-A);SDS、SDBS和皂荚粉3种湿润剂中,SDS对生防菌生长影响最大,SDBS的影响次之,而皂荚粉对菌生长基本无影响(图1-B);木质素磺酸钠和PVA对生防菌生长有一定的影响,但CMC-Na与对照组相比差异不显著(图1-C);碳酸钙、磷酸钾、磷酸二氢钾、CMC-Na 4种稳定剂中,磷酸钾对生防菌的活性影响很小,与对照组差异不显著(图1-D)。初步确定选择硅藻土、皂荚粉、CMC-Na和磷酸钾制备可湿性粉剂的母粉。
2.2 助剂中分散剂和湿润剂的复筛
湿润时间和悬浮率是评价可湿性粉剂的2个重要指标,国标要求可湿性粉剂悬浮率≥70%,湿润时间≤120 s,因此对湿润剂和分散剂进一步复筛。将分散剂木质素磺酸钠、CMC-Na和PVA分别按照5%比例添加进母粉中,测定母粉悬浮率和湿润时间。结果(表2)表明,PVA的分散效果[(88.09±2.03)%]和湿润时间[(74.00±5.29)s]均达到国家标准要求。又因为其生物相容性较好,最终确定分散剂为PVA。以相同方法测定湿润剂对母粉的影响,结果(表3)表明SDBS的分散性和湿润时间均最佳,由于其生物相容性较好,最终确定湿润剂为SDBS。
2.3 载体和助剂最佳配比优化
经过上述筛选,确定可湿性粉剂的载体为硅藻土,湿润剂为十二烷基苯磺酸钠(SDBS),分散剂为聚乙烯醇(PVA),稳定剂为磷酸钾。由表4可知,A因素载体对悬浮率和湿润时间的影响均较大,说明载体的用量不易过少,但是载体为A2和A3时悬浮率都达不到国家标准(悬浮率≥70%),所以选择载体A1(10%)。各组合中湿润时间均符合国家标准(湿润时间≤120 s),因此悬浮率为主要选择指标。正交试验表中A1B3C3D1组合的悬浮率为最佳配方组合,此组合不在试验组合中。补充试验结果表明,A1B3C3D1的悬浮率不符合国家标准。而组合A1B3C3D3的悬浮率达到了国家标准,所以选择A1B3C3D3作为试验配比,制备可湿性粉劑。
2.4 紫外保护剂的筛选
当可湿性粉剂施用时,菌体会受到紫外线照射,影响活性,使粉剂生防效果大大减弱。在粉剂中加入紫外保护剂,可吸收掉大部分的紫外辐射从而保持生防菌的活性。按照“2.3”节中确定的最优配方并加入2.5%的紫外线保护剂,筛选最佳保护剂。由表5可知,在经过紫外线(UV)照射12 h后,添加黄原胶和糊精的可湿性粉剂芽孢存活率和菌含量均较高,但是经24 h UV照射后,添加黄原胶的粉剂芽孢存活率和菌细胞含量都有所下降,因此选择糊精作为紫外保护剂。
2.5 可湿性粉剂指标检测
根据筛选的载体和助剂及紫外保护剂制备生防菌可湿性粉剂(表6),经测定悬浮率为92.99%,湿润时间为20 s,细度为96.2%,pH值为6.8,含水量为1.81%,菌含量约7.0×108 CFU/g,均符合国家标准值。
可湿性粉剂经不同温度(25、35、50、75、100 ℃)处理20 min后,温度低于50 ℃时菌含量保持稳定;随着温度的上升,菌含量逐渐降低但是仍保持在一定水平,表明可湿性粉剂的耐热性较强(图2-A)。因此在大田使用时不会受到实际环境温度的影响。从酸碱处理结果可以看出,粉剂在pH值为6~9时保持较高的菌含量,且彼此间差异不显著,表明粉剂在弱酸弱碱环境下菌活性保持稳定(图2-B)。自然界中洁净水的pH值范围基本上都在6~9之间,实际使用时只需用常规洁净水稀释即可。
2.6 可湿性粉剂抑菌效果和盆栽促生效果
用平板对峙法检测可湿性粉剂对2种指示菌的抑制效果,结果(图3)表明该粉剂对桑青枯病病原菌5号小种和灰霉菌有良好的抑制效果。说明粉剂制备过程中仍然保持了生防菌的抑菌特性。
1 g粉剂用500 mL蒸馏水稀释制成稀释液浇灌番茄幼苗。经15 d和30 d灌根处理,试验组番茄长势良好,无病变发生,高度和增长率均显著高于对照组(表7)。表明可湿性粉剂能促进番茄生长,保持了生防菌的促生长特性。
2.7 可湿性粉剂安全性和毒理性分析
经过稀释液浸根和穿刺处理的番茄幼苗移栽后生长发育状况正常,番茄幼苗的叶片未出现黄叶和枯萎状况,茎部和根系无病变状况发生,与对照组无明显差异,表明可湿性粉剂对植物无危害。
对小鼠经口灌胃14 d后,高剂量组(剂量组3和剂量组4)小鼠行动迟缓、精神低郁;低剂量组(剂量组1和剂量组2)小鼠活动正常,行动灵敏。通过霍恩氏法测定半数致死量LD50>500 mg/kg,确定可湿性粉剂为低毒性(表8)。各组小鼠在经口灌胃后,雌雄小鼠体质量增长率受影响程度不同。低剂量组对雄性小鼠体质量增长无影响,但高剂量组显著抑制小鼠体质量增加(P<0.05);雌性小鼠中剂量组1显著增加小鼠体质量,而剂量组2和剂量组3对生长无影响,剂量组4则明显抑制雌性小鼠生长(P<0.05)(表9)。4个剂量组粉剂对雄性小鼠的心脏、脾脏、肾脏和胃均无伤害,甚至在一定程度上能够促进其生长发育,但对肝脏有显著影响(P<0.05);雌性小鼠中除了对胃无影响外,4个剂量组对心脏、脾脏、肾脏和肝脏均有显著影响(P<0.05)(表10)。表明可湿性粉剂具有一定毒性,但对雄性个体影响较小,对雌性个体影响较大。
2.8 菌株的促生长和拮抗特性分析
在定性分析试验中,溶磷性检测培养基和几丁质酶检测培养基平板上菌落周围无无色透明圈,液体培养加入显色剂后无红色产生,表明菌株无溶磷性、不能产生IAA和胞外几丁质酶。产铁载体、有机酸、蛋白酶和纤维素酶检测培养基平板上菌落周围有明显的透明圈或光圈形成, 表明菌株381可产生铁载体、有机酸、蛋白酶和纤维素酶(图4)。
3 讨论与结论
生物农药的开发利用既提高了经济效益,又保护生态环境,是当前农药行业绿色发展的重要方式[35]。生物農药菌剂的研制,微生物活性是决定生防菌能否走向市场的关键[36]。农药中可湿性粉剂不使用溶剂和乳化剂,对植物较为安全。但可湿性粉剂中的载体和助剂,不仅影响菌剂的理化性质,还与微生物活性密切相关,因此必须考虑载体和助剂与微生物的相容性,保证生防菌的数量。本试验以单因素和正交试验相结合的方法探究载体和各种助剂与生防菌多黏类芽孢杆菌381的相容性,并测定可湿性粉剂的重要指标,以此筛选出最佳的载体和助剂及其配比。通过对载体、湿润剂、分散剂、稳定剂、紫外保护剂的筛选,确定多黏类芽孢杆菌381可湿性粉剂的最佳配比为发酵液70%、硅藻土10%、聚乙烯醇(PVA)5%、十二烷基苯磺酸钠(SDBS)10%、磷酸钾2.5%、糊精 2.5%。该配方的可湿性粉剂的悬浮率为92.99%,湿润时间为 20 s, 菌含量约7.0×108 CFU/g,各项指标均达到国家标准。
可湿性粉剂是以包括生防菌在内的发酵液作为剂型化研究的对象,既包含生防菌菌体又包含其产生的对植物病害有抑制作用的物质,防治作用更大。目前可湿性粉剂是微生物农药的主要剂型,在生产上得到广泛应用[26]。多黏类芽孢杆菌是具有极高应用价值的安全生防菌株,对青枯病、枯萎病、根腐病、软腐病等多种土传植物病害有较好的防控效果[37-38]。多名学者对多黏类芽孢杆菌可湿性粉剂的制备及其应用进行了研究[39-41]。本试验测定的可湿性粉剂主要性能指标均明显高于其他研究研制的可湿性粉剂,但菌含量略低,这可能与381菌株粉剂制备液的配制有关。
可湿性粉剂的载体是一种惰性填料,具有多网孔结构或片、层状结构,有较强的吸附能力和吸附容量。载体在可湿性粉剂中占有较大比例,对制剂的性能和微生物活性有主要影响。贺振宁等制备枯草芽孢杆菌 B1514可湿性粉剂[42],李磊等制备解淀粉芽胞杆菌Ht-q6可湿性粉剂[43],凡超等制备发光杆菌可湿性粉剂[44]时,都选用硅藻土作为载体,与本试验确认的载体一致。而硅藻土与苏云金芽孢杆菌、白僵菌[45]以及解淀粉芽孢杆菌BA-12[26]的相容性较差。由此可见,不同种类的载体对微生物的存活和活性影响差异很大,即使同一载体,不同微生物也会产生不一样的效果。
助劑不仅可以提高防效,延长货架期,还能降低成本。倪荣等的研究表明,PVA和CMC-Na对可湿性粉剂的湿润时间有不同的影响。本研究中PVA大大降低可湿性粉剂的湿润时间,与其结果一致[46]。此外,明亮等研究发现,可湿性粉剂的理化因素会在干燥、粉碎过程中受到影响[47]。因此,生防菌381可湿性粉剂的工艺优化还可以进行进一步完善。
本试验制备的可湿性粉剂的耐热性良好,温度低于50 ℃时菌含量保持稳定,温度较高时菌含量仍保持在较高水平。因此,田间叶片喷施或者灌根使用时,实际环境温度不会影响粉剂的作用效果。粉剂稀释液pH值偏中性,在pH值为6~9时保持较高的菌含量,且彼此间差异不显著。自然界中洁净水的pH值范围基本上都在6~9之间,实际使用时只需用常规洁净水稀释悬浮,无需特殊处理,而且此pH值范围也不受植物体本身酸碱度的影响。粉剂处理番茄幼苗,对植物无毒害作用;小鼠经口灌胃试验结果表明粉剂对动物有一定的毒害作用,但属于低毒级别,田间可以放心施用。
铁是植物生命活动的重要营养元素,参与或调控了光合作用、呼吸作用、固氮、DNA合成等多个代谢过程。在自然界中,铁主要以难溶的Fe3+化合物形式存在,可溶性铁含量相对较低,使铁的生物有效性大大降低。铁载体(siderophore)是生长在低铁环境中的细菌、真菌合成的一类具有高度专一性的低分子量的铁螯合剂。在缺铁条件下,微生物依赖其分泌的铁载体来溶解、运输环境中的难溶性铁,提高土壤中有效铁的浓度,同时被微生物同化的铁在微生物死亡或铁载体被分解后可释放出来被植物所利用[48]。试验菌株381及其粉剂均能够促进植物生长,铁载体的分泌发挥着一定的作用。
铁载体在生防菌抑制病原菌中也发挥着重要作用。大部分病原微生物不具有分泌铁载体的能力或能力很低。低铁环境中生防菌分泌铁载体到环境中,螯合铁来维持自身生长的需要,并且分泌的铁载体一般不会被病原微生物利用,因此创造了铁浓度更低的环境从而抑制植物病原菌的生长[49]。菌株381及其粉剂可有效抑制检测菌株的生长,定性平板检测除了能够分泌铁载体外,还能够分泌有机酸,产生胞外纤维素酶和蛋白酶。有机酸可通过能量竞争、透化细菌外膜、提高胞内渗透压、抑制生物大分子合成、诱导宿主产生抗菌肽等方式抑制微生物生长[50-52];蛋白酶属于水解酶类,可有效分解蛋白质,通过抑制细菌体外生物膜的形成、破坏细菌细胞壁肽聚糖的结构或真菌细胞壁蛋白质成分等方式达到抑制微生物生长的效果[53-54];低等真菌细胞壁成分以纤维素为主,而高等真菌则以几丁质为主,纤维素酶或几丁质酶可有效破坏细胞壁结构,进一步影响真菌的生长。前期试验中菌株381还可能代谢产生生物碱、黄酮或萜类物质,这些物质在一定程度上均有杀菌抑菌的作用[20]。因此菌株381及其粉剂对多种病原细菌或真菌的广谱抗性可能是其产生的多种物质综合作用的结果。
本研究中,确定了内生生防菌381可湿性粉剂的配方、性质、安全性、毒理性、抑菌性及其促生效果,并初步探索了促生和抑菌的可能机制。但是菌株在植物体内的定殖繁殖规律、粉剂在田间施用的防控效果及防控注意因素、菌株与其他生物间的作用关等还需要进一步探究。
参考文献:
[1]王 智. 辽宁省不同地区番茄灰霉病菌抗药性研究[D]. 沈阳:沈阳农业大学,2016.
[2]张静静. 吉林省主要城市城郊土壤-蔬菜系统中有机氯农药残留及风险研究[D]. 长春:中国科学院研究生院东北地理与农业生态研究所,2016.
[3]李晓强,孙跃先,叶光祎,等. 使用化学农药对农业生物多样性的影响[J]. 云南大学学报(自然科学版),2008,30(增刊2):365-369.
[4]卜元卿,孔 源,智 勇,等. 化学农药对环境的污染及其防控对策建议[J]. 中国农业科技导报,2014,16(2):19-25.
[5]Sturz A V,Christie B R,Nowak J.Bacterial endophytes:potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences,2000,19(1):1-30.
[6]Sivasakthi S,Usharani G,Saramraj P. Biocontrol potentiality of plant growth promoting bacteria (PGPR)-Pseudomonas fluorescens and Bacillus subtilis:a review[J]. African Journal of Agricultural Research,2014,9(16):1265-1277.
[7]Villegas-Escobar V,Ceballos I,Mira J J,et al.Fengycin C produced by Bacillus subtilis EA-CB0015[J]. Journal of Natural Products,2013,76(4):503-509.
[8]Lee J Y,Shim J M,Yao Z,et al.Antimicrobial activity of Bacillus amyloliquefaciens EMD17 isolated from Cheonggukjang and potential use as a starter for fermented soy foods[J]. Food Science and Biotechnology,2016,25(2):525-532.
[9]Kilani-Feki O,Khiari O,Culioli G,et al.Antifungal activities of an endophytic Pseudomonas fluorescens strain Pf1TZ harbouring genes from pyoluteorin and phenazine clusters[J]. Biotechnology Letters,2010,32(9):1279-1285.
[10]韩长志. 植物病害生防菌的研究现状及发展趋势[J]. 中国森林病虫,2015,34(1):33-37.
[11]Etesami H,Alikhani H A,Mirseyed H H.Root bacterial endophytes as potential biological control agents against fungal rice pathogens[J]. Archives of Phytopathology and Plant Protection,2019,52(7/8):560-581.
[12]Seliem M K,El-Mahrouk M E,El-Banna A N,et al. Micropropagation of Philodendron selloum:influence of copper sulfate on endophytic bacterial contamination,antioxidant enzyme activity,electrolyte leakage,and plant survival[J]. South African Journal of Botany,2021,139:230-240.
[13]刘振华,罗远婵,张道敬,等. 农用微生物杀菌剂剂型研究进展[J]. 农药学学报,2014,16(5):497-507.
[14]Ash C,Priest F G,Collins M D.Molecular identification of rRNA group 3 bacilli (ash,farrow,wallbanks and collins) using a PCR probe test[J]. Antonie Van Leeuwenhoek,1993,64(3/4):253-260.
[15]Li Y L,Chen S F.Fusaricidin produced by Paenibacillus polymyxa WLY78 induces systemic resistance against Fusarium wilt of cucumber[J]. International Journal of Molecular Sciences,2019,20(20):5240.
[16]Vater J,Herfort S,Doellinger J,et al.Fusaricidins from Paenibacillus polymyxa M-1,a family of lipohexapeptides of unusual complexity-a mass spectrometric study[J]. Journal of Mass Spectrometry,2017,52(1):7-15.
[17]Bent E,Chanway C P.Potential for misidentification of a spore-forming Paenibacillus polymyxa isolate as an endophyte by using culture-based methods[J]. Applied and Environmental Microbiology,2002,68(9):4650-4652.
[18]Bolwerk A,Lagopodi A L,Wijfjes A H M,et al.Interactions in the tomato rhizosphere of two Pseudomonas biocontrol strains with the phytopathogenic fungus Fusarium oxysporum f. sp. radicis-lycopersici[J]. Molecular Plant-Microbe Interactions,2003,16(11):983-993.
[19]Wang Z W,Liu X L.Medium optimization for antifungal active substances production from a newly isolated Paenibacillus sp.using response surface methodology[J]. Bioresource Technology,2008,99(17):8245-8251.
[20]王 彪,潘英豪,侯佳蓝,等. 一种桑树细菌性病原内生拮抗细菌的筛选、鉴定及其生防活性[J]. 微生物前沿,2019,8(3):110-120.
[21]李志禮,庞煜霞,葛圆圆,等. 木质素磺酸钠分散剂的制备及其在农药中的应用[J]. 中国造纸,2010,29(5):38-42.
[22]国家技术监督局. 农药可湿性粉剂悬浮率测定方法:GB/T 14825—1993[S]. 北京:中国标准出版社,2004.
[23]中华人民共和国国家质量监督检验检疫总局. 农药可湿性粉剂润湿性测定方法:GB/T 5451—2001[S]. 北京:中国标准出版社,2004.
[24]国家技术监督局. 农药粉剂、可湿性粉剂细度测定方法:GB/T 16150—1995[S]. 北京:中国标准出版社,2004.
[25]国家技术监督局. 农药pH值的测定方法:GB/T 1601—1993[S]. 北京:中国标准出版社,1994.
[26]李姝江,方馨玫,曾艳玲,等. 解淀粉芽孢杆菌BA-12可湿性粉剂研制及对核桃根腐病的防治效果[J]. 中国生物防治学报,2016,32(5):619-626.
[27]曾建红,欧贤红,郭俊平,等. 莪术醇原药对大鼠慢性毒性的试验研究[J]. 现代农业科学,2008,15(11):21-23.
[28]罗 洋,滕 应,罗绪强,等. 里氏木霉FS10-C可湿性粉剂的研制及其促生效果测定[J]. 生物技术通报,2016,32(8):194-199.
[29]韩丽珍,林佳静,郑 欢,等. 一株溶磷菌的抗逆促生特性及对种子萌发的研究[J]. 种子,2019,38(10):34-40.
[30]杨常娥,鲁艳莉,倪捍成,等. 创伤弧菌产铁载体菌株的筛选及其诱导条件的响应面优化[J]. 食品工业科技,2017,38(3):159-165.
[31]詹寿发,卢丹妮,毛花英,等. 2株溶磷、解钾与产IAA的内生真菌菌株的筛选、鉴定及促生作用研究[J]. 中国土壤与肥料,2017(3):142-151.
[32]杨继业,郭晓军,郭 威,等. 产有机酸芽孢杆菌的筛选、鉴定及产芽孢条件优化[J]. 饲料工业,2015,36(4):44-51.
[33]Sunitha V H,Devi D N,Srinivas C.Extracellular enzymatic activity of endophytic fungal strains isolated from medicinal plants[J]. World Journal of Agricultural Sciences,2013,9(1):1-9.
[34]譚海刚,李 静,赵祥颖. 产几丁质酶菌株的筛选及酶解产物鉴定[J]. 粮油食品科技,2013,21(2):65-67.
[35]郭利京,王 颖. 我国农药施用的时空演变[J]. 江苏农业科学,2019,47(14):327-331.
[36]陈 源,卜元卿,单正军. 微生物农药研发进展及各国管理现状[J]. 农药,2012,51(2):83-89.
[37]张 楠,陈 岩,王丽丽,等. 多黏类芽胞杆菌对植物土传病害的防控及促生长作用研究进展[J]. 微生物学杂志,2017,37(5):91-97.
[38]苍桂璐,张付云,杨 阳,等. 多黏类芽孢杆菌的研究进展[J]. 安徽农业科学,2013,41(2):487-489.
[39]李畅方,罗时华,何 强,等. 康地蕾得防治番茄青枯病药效试验[J]. 广东农业科学,2003,30(6):38-39.
[40]赵新海,钟丽娟,张庆华,等. 多黏类芽孢杆菌在黄瓜叶面和土壤中定殖能力及其对土壤微生物的影响[J]. 世界农药,2009,31(5):25-27.
[41]刘振华. 多黏类芽孢杆菌和海洋芽孢杆菌可湿性粉剂的研制及其加工工艺的优化与放大[D]. 上海:华东理工大学,2011.
[42]贺振宁,李海燕,苏 媛,等. 枯草芽孢杆菌B1514可湿性粉剂的研制及其对小麦纹枯病的防效[J]. 河南农业科学,2015,44(11):67-72.
[43]李 磊,许 敏,王美琴.生防菌解淀粉芽胞杆菌Ht-q6可湿性粉剂的研制及对番茄病害的田间防效[J]. 中国生物防治学报,2018,34(5):738-745.
[44]凡 超,邵雪花,匡石滋,等. 发光杆菌可湿性粉剂的研制及对荔枝采后贮藏的影响[J]. 广东农业科学,2017,44(12):110-115,174.
[45]王志英,孙丽丽,张 健,等. 苏云金杆菌和白僵菌可湿性粉剂研制及杀虫毒力测定[J]. 北京林业大学学报,2014,36(3):34-41.
[46]倪 荣,李紫嫣,钟文文,等. 10亿芽孢/g解淀粉芽孢杆菌可湿性粉剂的研究[J]. 安徽农业科学,2016,44(24):111-114.
[47]明 亮,刘程程,杨晓云,等. 生物杀菌剂解淀粉芽孢杆菌B1619水分散粒剂配方及助剂筛选[J]. 中国生物防治学报,2015,31(4):529-535.
[48]谢小军. 根际细菌铁载体化感作用研究[D]. 北京:中国农业大学,2002:9-11.
[49]孙 萌. 铁载体高产菌株的ARTP选育及其铁载体产量提高机理的初步分析[D]. 无锡:江南大学,2017.
[50]刘晓宇,傅海燕,黄国和,等. 美人蕉有机酸组分对铜绿微囊藻的化感作用[J]. 环境工程学报,2015,9(12):5769-5774.
[51]黄新琦,温 腾,孟 磊,等. 土壤强还原过程产生的有机酸对土传病原菌的抑制作用[J]. 植物保护,2015,41(6):38-43.
[52]张 军,田子罡,王建华,等. 有机酸抑菌分子机理研究进展[J]. 畜牧兽医学报,2011,42(3):323-328.
[53]Gaonkar S K,Furtado I J.Characterization of extracellular protease from the haloarcheon Halococcus sp.strain GUGFAWS-3 (MF425611)[J]. Current Microbiology,2020,77(6):1024-1034.
[54]Tang B L,Yang J E,Chen X L,et al.A predator-prey interaction between a marine Pseudoalteromonas sp. and Gram-positive bacteria[J]. Nature Communications,2020,11:285.
