水稻田土壤铁锰氧化菌的分离与鉴定
2021-01-02王娟娟阙天洋胡珈玮赵雨涵钱晓晴张振华
王娟娟 阙天洋 胡珈玮 赵雨涵 钱晓晴 张振华


摘要:铁、錳氧化物可以富集、钝化重金属,在一定程度上阻止其进入水稻根系,对于土壤污染修复,降低水稻污染风险有重要的生态意义。采用改良纤毛菌培养基,单菌落稀释转接法分离纯化铁锰氧化菌,分析相关菌株的形态特征,对菌株的16S rRNA基因序列进行测定分析,对其及产物进行电镜扫描与能谱分析,并分析产物对重金属镉的吸附效率。结果分离得到具有铁锰氧化功能的菌株5株,形状为椭球至短杆状,均为不动杆菌属(Acinetobacter)。能谱分析表明,除MOB4之外菌株样品均有明显Fe和Mn波峰,以及O波峰,推断有大量铁锰氧化物存在。液体培养表明,接种菌株可使培养液中的镉含量下降35.25%,下降率远高于对照。综上所述,通过筛选获得菌株为不动杆菌属,具有氧化铁、锰的功能,并可能促进介质中氧化铁的生成,进而提高对介质中溶解态重金属镉的吸附。
关键词:水稻田;铁锰氧化细菌;筛选;镉吸附;不动杆菌属
中图分类号:S182 文献标志码: A
文章编号:1002-1302(2021)23-0243-06
收稿日期:2021-07-05
基金项目:国家自然科学基金青年科学基金(编号:41701093);中国博士后基金(编号:2017M611928);国家重点研发计划课题(编号:2017YFD0200107)。
作者简介:王娟娟(1979—),女,江苏泗洪人,博士,副教授,主要从事环境微生物学研究。E-mail:wangjuanjuan@yzu.edu.cn。
通信作者:张振华,博士,研究员,主要从事农业资源与环境学研究。E-mail:zhenhuaz70@hotmail.com。
铁(iron,Fe)和锰(manganese,Mn)是地壳中占比较大的2种过渡金属元素。两者生物、化学性质均比较活跃,在自然环境中极易生成活性表面积较大的氧化物。铁锰氧化物以及铁锰氢氧化物,具有较大的比表面和大量的—OH基团,参与土壤中多种离子的吸附与解吸过程,并表现出一定的氧化还原作用。除了对钙、磷等离子具有较强的吸附作用外,对镉、铅、砷等重金属(或类重金属)元素以及有机物也具有一定的吸附作用[1-2]。含铁矿物在酸碱度和氧化还原条件发生改变时易发生氧化或还原作用以及沉淀或溶解作用,决定着含铁矿物中铁和其他有关金属元素在土壤中的存在形态、转化特征和生物活性[3],充当土壤重金属元素的固定钝化剂或改良剂,成为一种重金属生物污染的地球化学屏障。
铁是高等生物必需的微量营养元素,同时在特定条件下成为细菌的潜在能源物质[4]。微生物参与铁氧化过程有主动与被动作用。前者通过酶反应将Fe(Ⅱ)氧化成Fe(Ⅲ),从而获得能量;后者则作为结合和成核表面而促进氧化铁在细胞壁和胞外聚合物上的沉淀。此外,由微生物代谢引起的pH值变化和某些细菌渗出物的产生也可能有利于铁氧化物形成[5]。在对二十余种湿地植物进行调查时发现,根际有铁细菌的存在概率达到92%[6],其中,由微生物活动形成的铁氧化物占到铁氧化物总量的50%~90% [7-8]。微生物介导产生的铁氧化物可以进一步催化铁氧化过程。
锰的价态同样较多,经常参与土壤中一系列的生物和地球化学过程,尤其是与铁等其他金属的氧化过程有着密切的联系。锰氧化菌在海洋和陆地均有分布,它可以通过酶直接将锰氧化,也可以通过生理活动改变环境的pH值和氧化还原电位(Eh),促进锰的化学氧化[9]。微生物在锰的氧化过程中的作用要远大于非生物氧化作用[10],甚至常被认为是推动自然界中锰氧化物形成的主要贡献者[11]。据报道,典型的锰氧化细菌为异养微生物,并不从锰氧化过程中获取能量,介导锰氧化过程可能是为了减轻重金属及紫外线胁迫等危害因子。
铁锰氧化菌是指可以同时氧化铁锰并从过程中获得能量的微生物,这一过程伴随着能量代谢及呼吸电子传递等。近些年来,由于对水体金属污染处理的关注,不少学者对铁锰氧化菌进行了相关研究[12-13]。蛋白胨酵母膏完全培养基(PYCM)因对锰氧化菌具有较强选择性而常被用来筛选锰细菌[14]。在自然界中,铁、锰氧化菌往往伴生存在,因此另加入柠檬酸铁铵,可同时检测细菌对铁的氧化能力。
水稻是我国最重要的粮食作物,水稻产量占我国粮食总产量的40%以上。水稻长期生长在淹水环境,根系通气组织发达,可以向根际土壤泌氧,造成土壤微域氧化还原电位差和铁氧浓度梯度,从而为铁氧化菌提供良好生境[15],微生物介导形成的氧化铁可吸附于植物根际周围,形成铁膜[2]。铁膜的成分除了铁氧化物外,还含有一定比例的锰氧化物,铁膜对多种重金属具有吸附作用[16]。如常见于稻田的周丛生物即为铁锰氧化物、微生物以及微生物分泌的有机物和其他有机物所组成,在稻田重金属固定方面具有积极意义[17]。铁膜的存在不仅影响到水稻对污染元素的吸收与累积,也在一定程度上影响着营养元素的吸收与累积[18-20],进而影响粮食的营养和安全问题,因此关于铁膜的研究被广泛关注[21]。
研究发现,细菌可能在调控水稻田铁膜产生过程中起着关键作用,但目前对于水稻土铁锰氧化菌的研究还有待深入。本试验采用改良的纤毛菌培养基对富铁水稻田土壤铁锰氧化菌进行富集、纯化,从系统分类学上对菌种进行鉴定,并对其形态学及氧化产物以及其对重金属的吸附进行进一步分析,明确了其氧化铁锰的效果,结果可为研究稻田重金属污染治理提供参考依据。
1 材料与方法
1.1 样品采集
供试稻田土壤样品采自江苏省镇江市丹徒区荣炳镇南庄村。土壤有机质含量范围25%~35%,土壤pH值 6.0左右,耕作层生物可利用还原态铁含量为2.0 mg/g(干土)。采集水稻分蘖期根际土壤用于培养铁锰氧化细菌。
1.2 培养基准备
改良纤毛菌培养基(modified Leptothrix medium,简称培养基A):2 g/L MnCO3·H2O2、0.3 g/L NH4Cl、1 g/L酵母提取物、1 mL/L微量元素(TES)溶液、1 mL/L维生素(Vit)溶液(ATCC配方)、2 mL/L 柠檬酸铁溶液(将2.83 g硫酸亚铁和3 g柠檬酸三钠分别溶解后混匀,定容至20 mL,以 0.22 μm 无菌滤膜过滤后冷冻保存)、20 g/L琼脂。
缺铁的改良纤毛菌培养基(以下简称培养基B)的配方为A培养基去掉柠檬酸铁溶液。缺锰的改良纤毛菌培养基(以下简称培养基C)的配方为培养基A去掉MnCO3·H2O。
1.3 菌种分离与筛选
将土壤样品以等同于生理盐水的矿物营养液在10-8~10-1进行梯度稀释,并各取100 μL均匀涂布在A培养基上。在25 ℃条件下培养3 d后挑取单菌落转接至新的平板上,经4~5次转接,可得到单菌落。将分离得到的细菌接种到事先准备好的培养基A、B、C上,在25 ℃条件下培养1周,对其生长状况进行观察记载。采用亮柏兰(LBB)染料对可能生成的锰氧化物进行检测。
1.4菌种系统分类鉴定
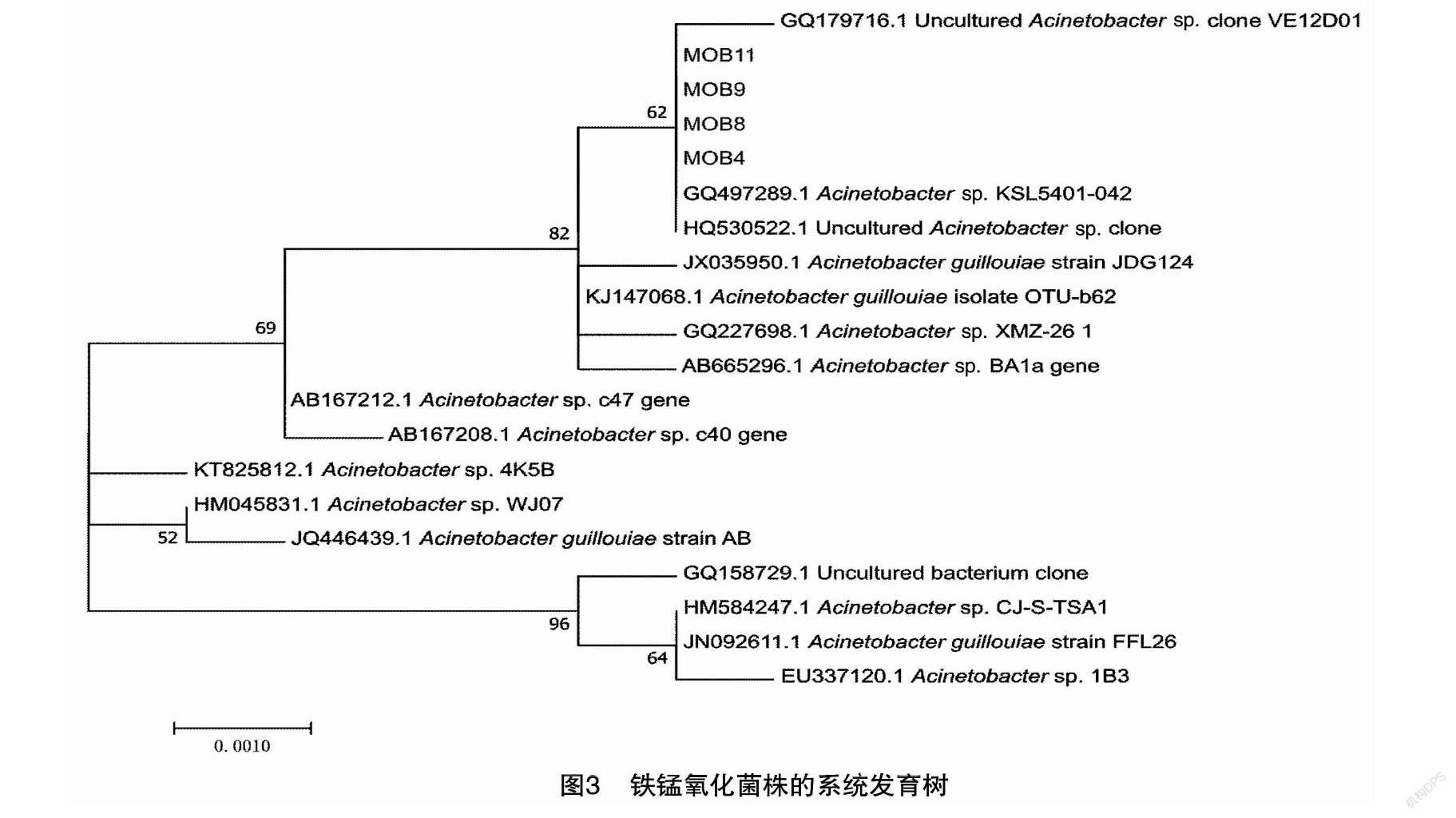
挑选生长较好的菌落,采用Ezup柱式细菌基因组DNA抽提试剂盒(生工,SK8255),按供应商步骤提取细菌DNA。采用通用细菌引物扩增16s rDNA,所用试剂盒为BigDye Terminator v1.1 试剂盒。引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)与1492R(5′-AGAGTTTGATCCTGGCTCAG-3′)。通过1%琼脂糖凝胶电泳观察PCR产物生成情况,并进行纯化回收(SanPrep柱式DNAJ胶回收试剂盒SK8131)。纯化的PCR产物用于Sanger测序,测序平台为ABI测序仪(3730xl DNA Analyzer)。采用DNAMAN将测定序列拼接后,使用NCBI在线Blast数据库进行比对(Blastn),比较所获序列与已知核酸序列的同源性。下载近缘序列,并采用软件系统进化数构建软件MEGA(https://www.megasoftware.net/)对序列进一步分析,并采用Neighbor joining方法建立菌种的系统发育树。
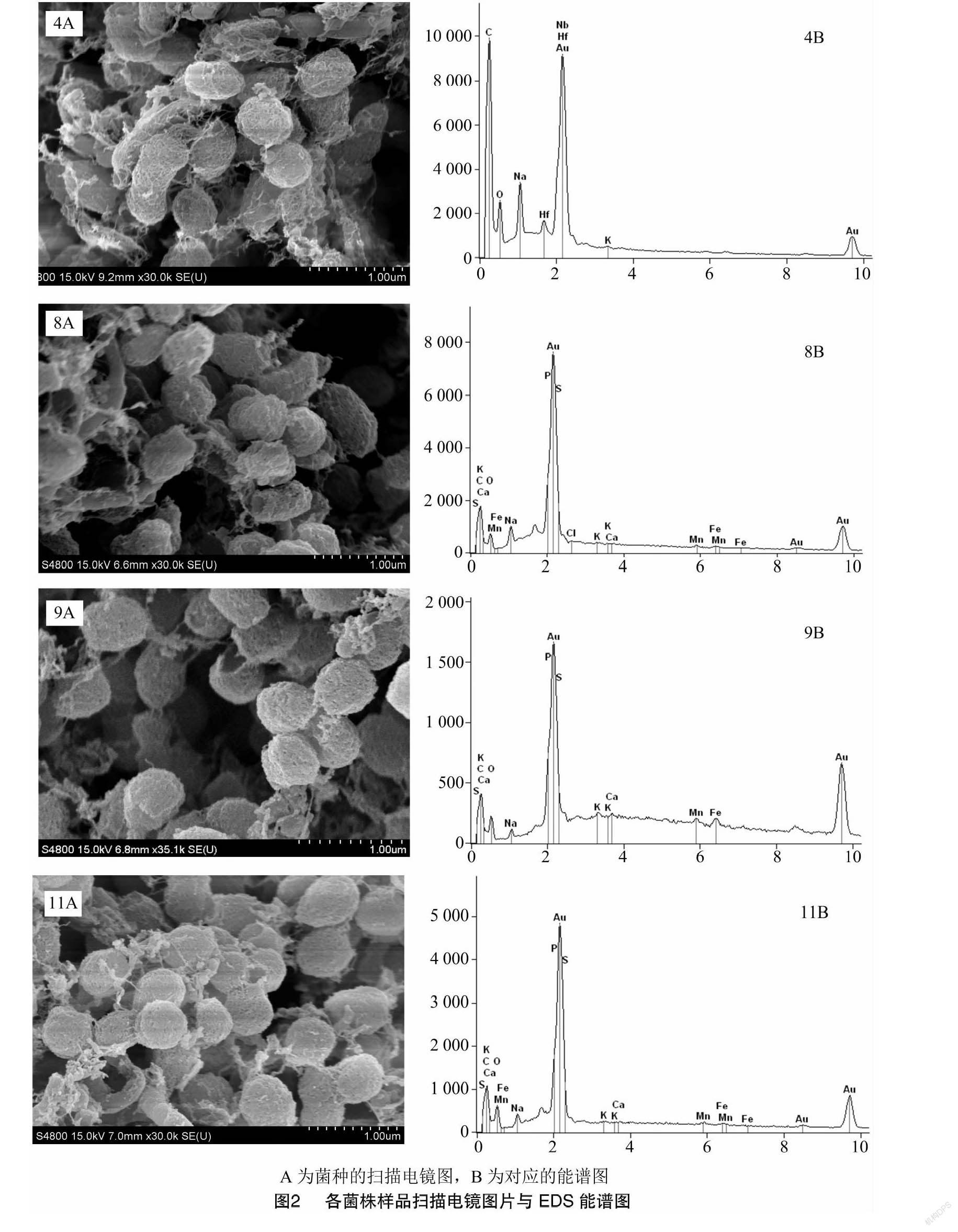
1.5 扫描电镜(SEM)与EDS能谱分析
将生长3 d左右的完好菌落从培养基上切取下来,参照扫描电镜样品处理常规方法先进行固定(2.5% 1,5-戊二醛电镜专用固定液),洗涤后脱水(分别采用30%、50%、70%、80%、90%梯度浓度乙醇)、经过CO2临界点干燥后,进行喷金处理。最终所得样品采用环境扫描电子显微镜(PHILIPS,XL30ESEM)进行分析观察。选取合适区域进行EDS能谱分析(加速电压为0.5~20.0 keV,放大倍数为35 000倍)。上述测定于扬州大学理化测试中心进行。
1.6 菌株对镉的耐性及吸附的影响
选取菌种MOB8,采用不加琼脂的改良纤毛菌培养基C,分别加入终浓度为0、0.25、0.50、0.75、1.00 mg/L 的Cd2+(CdCl2),接种后于25 ℃摇床(120 r/min)培养1周,观察记录菌种生长情况。最后添加最终浓度为5.0 mg/L的Cd2+,分别于1、3、5、7、9 d取样,离心过滤,用原子吸收法测定溶液中Cd2+浓度,以评估菌株及其产物对镉的吸附能力。
2 结果与分析
2.1 铁锰氧化菌的筛选
在接种土壤稀释浓度平板上选取12株有铁锈色的菌落,采用划线稀释法转接进行。在继续培养时,发现有的菌落颜色加深,推测可能是由于所产生的色素积累所致,舍弃该类菌,继续其他菌种的转接与纯化。最终获得4株具有潜在铁锰氧化功能的菌株,分别编号为MOB4、MOB8、MOB9和MOB11(图1)。
几株菌的菌落相对较小,生长速度慢,表面光滑黏稠,呈赭黄色或棕褐色,菌落中心颜色深且颜色不随培养时间变化。在菌株生长过程中,发现有一些菌株的菌落四周产生赭色晕圈,如菌株MOB4与MOB11在3种培养基上均出现红棕色晕圈。LBB染色鉴定也发现有氧化锰产物的生成。
相对而言,菌株MOB8在含铁和锰的培养基(A)上生长得较快,而在缺锰的培养基(C)上所形成的菌落最大。在缺锰的C培养基上前4 d未见生长,1周后开始出现明显菌落,后期逐渐增加。同样,菌株MOB9在含鐵锰的培养基(A)上生长状况最佳,培养的前4 d在C上也未见生长,8 d后开始出现菌落(图1)。可见缺锰对这2株菌影响要大于缺铁。
2.2 菌落扫描电镜(SEM)与能谱分析结果
几株菌的扫描电镜结果(图2)表明,其细胞形态均为球形至短杆形,大小为0.4~0.8 μm。在细胞表面包裹着大量的絮状物和颗粒物,这可能是细胞生长所产生的胞外聚合物,以及一些铁、锰的氧化产物。随机选择各株菌的电镜样品的一些区域进行X射线能谱分析,通过分析测定细胞表面的主要元素组成。从分析结果可以看出,除菌株MOB4外,各菌株表面均有一定量的铁锰元素。菌株MOB8与MOB11的能谱图中的Fe和Mn波峰要高于MOB9,表明所含铁、锰相对较高。各菌株能谱测定结果中氧(O)的峰值也较高,结合平板培养与氧化物染色结果可以推测,这些菌株表面可能含有较大比例的铁锰氧化物,其产物的具体结构与组成有待进一步分析。
2.3 菌株的16S rRNA基因序列分析
对菌株的16S rRNA 基因的测序分析,采用邻接法所构建的系统进化树(图3)。菌株MOB4、MOB8、MOB9和MOB11在系统分类上比较接近,可以确定为同一属。经过BLAST比对,其序列与不动杆菌Acinetobacter guillouiae相似度为99%,为近缘物种。可以将试验筛选所得的4株菌鉴定为不动杆菌属(Acinetobacter)。有关该菌氧化金属铁锰的报道尚未多见。
2.4 菌株对重金属镉吸附的影响
选取分离得到的铁氧化菌MOB8进行液体培养试验,发现其对镉的耐受临界浓度为0.75 mg/L,高于此浓度生长严重受影响。因此,选择在培养基中加入最终浓度为5.0 mg/L的Cd2+,以检测菌株及其产物对镉的吸附能力。在培养的4~5 d,接种组瓶中变浑浊、开始出现铁锈色的氧化物,空白组无明显变化。培养9 d后,接种组样品中的镉含量下降了35.25%,空白组样品中的镉含量则下降了5.98%。镉浓度的变化趋势和菌株液体培养中Fe2+的浓度变化趋势大致相同,表明氧化铁的生成吸附了溶液中游离态的Cd2+。
3 讨论与结论
自然界中铁与锰元素的氧化在很大程度上取决于微生物活动,微生物氧化作用要远高于非生物氧化过程[21-22]。微生物参与形成的铁锰氧化物一般聚集于细胞表面,与胞外聚合物一起,形成较大的比表面[21]。因而,相对于化学氧化产物而言,生物铁氧化物具有更高的吸附容量,对于环境中有害的重金属离子及一些有机污染物有较大的吸附能力[23]。生物铁锰氧化物对地球化学循环的贡献已得到相关关注,来自不同环境的铁锰氧化细菌也有报道[21],而来自于水稻田的纯菌种研究较少。水稻田以淹水条件为主,以微生物驱动铁、锰氧化过程在水稻土中十分普遍,且常常居于主导地位[24]。鉴于当前我国稻田重金属污染现状严峻,铁锰氧化菌在环境生态效应及生产上应用潜力巨大。
前人研究表明,改良纤毛菌培养基(modified Leptothrix medium)是一种选择性培养基,适合用于铁锰氧化菌的筛选。通过采用该方法所获得的铁锰氧化菌包括弗氏柠檬酸杆菌(Citrobacter freundii)、节杆菌属(Arthrobacter)和芽孢杆菌属(Bacillus sp.)等[25-27]。本试验通过选用改良纤毛菌培养基,成功培养出4株具有氧化铁、锰功能的细菌MOB4、MOB8、MOB9、MOB11。根据16S rRNA 基因序列测定结果,结合菌种生长形态特征,将其鉴定为Acinetobacter sp.。Acinetobacter常见于土壤,为革兰氏阴性菌,严格好氧,属不动细菌属。前人从活性污泥中分离得到该种菌[28],发现其具有降解苯酚的特性。此外,该种菌被证明耐高盐与耐重金属离子,具有耐抗生素性[29]。但该类菌对于金属铁、锰的氧化能并尚未多见报道。根据铁、锰氧化菌的生长特征与元素分析结果,可以初步判断本试验分离出的菌株对铁和锰均具有一定的氧化能力,其产物的组成与结构特征需进一步研究。本试验初步表明,该类细菌的生长有利于促进二价铁的氧化,并提高对溶液中重金属镉的吸附。
综上所述,本研究从富铁的水稻田土壤中分离筛选得到 4 株具有铁锰氧化功能的菌株,经过形态学及分子生物学鉴定为不动杆菌(Acinetobacter sp.)。菌株的生长可吸附并降低溶液中镉的含量。
参考文献:
[1]李芳柏,王旭刚,周顺桂,等. 红壤胶体铁氧化物界面有机氯的非生物转化研究进展[J]. 生态环境,2006,15(6):1343-1351.
[2]Du Z L,Li K J,Zhou S X,et al. Degradation of ofloxacin with heterogeneous photo-Fenton catalyzed by biogenic Fe-Mn oxides[J]. Chemical Engineering Journal,2020,380:122427.
[3]刘侯俊,张俊伶,韩晓日,等. 根表铁膜对元素吸收的效应及其影响因素[J]. 土壤,2009,41(3):335-343.
[4]董明芳.根际铁锰氧化菌对水稻铁锰膜形成和Cd吸收转运的影响[D]. 南宁:广西大学,2016.
[5] Ehrlich H L,Newmann D K,Kappler A. Ehrlichs geomicrobiology[M]. 6th ed. Boca Raton,Florida,USA:CRC Press,2015.
[6]Weiss J V,Emerson D,Backer S M,et al. Enumeration of Fe(Ⅱ)-oxidizing and Fe(Ⅲ)-reducing bacteria in the root zone of wetland plants:implications for a rhizosphere iron cycle[J]. Biogeochemistry,2003,64(1):77-96.
[7]Neubauer S C,Emerson D,Megonigal J P. Life at the energetic edge:kinetics of circumneutral iron oxidation by lithotrophic iron-oxidizing bacteria isolated from the wetland-plant rhizosphere[J]. Applied and Environmental Microbiology,2002,68(8):3988-3995.
[8]Hu M,Li F B,Lei J,et al. Pyrosequencing revealed highly microbial phylogenetic diversity in ferromanganese nodules from farmland[J]. Environmental Science Processes & Impacts,2015,17(1):213-224.
[9]段國文,耿新燕,魏绪宇,等. 锰氧化细菌的生理生态功能与作用机制研究进展[J]. 微生物学通报,2020,47(9):3039-3053.
[10]Hastings D,Emerson S. Oxidation of manganese by spores of a marine Bacillus:kinetic and thermodynamic considerations[J]. Geochimica et Cosmochimica Acta,1986,50(8):1819-1824.
[11]张 璐,李婷婷,王 芳,等. 锰氧化细菌的分离鉴定及其锰氧化特性的分析[J]. 微生物学通报,2011,38(3):328-332.
[12]陈丽芳,姚 远,李 敏,等. 两株产铁锰氧化酶细菌的鉴定及系统发育分析[J]. 亚热带资源与环境学报,2009,4(4):53-58.
[13]孙 楠,谌燕丽,张 颖,等. 碳化稻壳-铁锰氧化菌耦合净化严寒村镇高铁锰地下水效能与机制[J]. 环境科学,2017,38(3):1028-1037.
[14]Shopska M,Paneva D,Kadinov G,et al. Study on the composition of biogenic iron-containing materials obtained under cultivation of the Leptothrix sp.on different media[J]. Applied Biochemistry and Biotechnology,2017,181(3):867-883.
[15]Emerson D,Weiss J V,Megonigal J P.Iron-oxidizing bacteria are associated with ferric hydroxide precipitates (Fe-plaque) on the roots of wetland plants[J]. Applied and Environmental Microbiology,1999,65(6):2758-2761.
[16]Hansel C M,Francis C A.Coupled photochemical and enzymatic Mn(Ⅱ) oxidation pathways of a planktonic Roseobacter-like bacterium[J]. Applied and Environmental Microbiology,2006,72(5):3543-3549.
[17]陳保冬,赵方杰,张 莘,等. 土壤生物与土壤污染研究前沿与展望[J]. 生态学报,2015,35(20):6604-6613.
[18]Singh V K,Singh A L,Singh R,et al. Iron oxidizing bacteria:insights on diversity,mechanism of iron oxidation and role in management of metal pollution[J]. Environmental Sustainability,2018,1(3):221-231.
[19]Zecchin S,Corsini A,Martin M,et al. Rhizospheric iron and arsenic bacteria affected by water regime:implications for metalloid uptake by rice[J]. Soil Biology and Biochemistry,2017,106:129-137.
[20]陈淋霞,张 萌,石佳佳,等. 铁氧化菌耐砷机制及其砷污染修复应用的研究进展[J]. 微生物学通报,2020,47(9):3054-3064.
[21]郑 洁,孟佑婷,方瑶瑶,等. 一株锰氧化细菌的分离、鉴定及其锰氧化特性[J]. 微生物学报,2016,56(11):1699-1708.
[22]万文结,薛芷筠,张泽文,等. 锰氧化菌Arthrobacter sp. HW-16的锰氧化特性和氧化机制[J]. 环境科学,2017,38(5):2036-2043.
[23]彭进国,谢小兰.一种生物铁氧化物对镉的吸附特性[J]. 环境工程,2015,33(增刊1):975-980.
[24]陈娅婷,李芳柏,李晓敏.水稻土嗜中性微好氧亚铁氧化菌多样性及微生物成矿研究[J]. 生态环境学报,2016,25(4):547-554.
[25]郑 莹,王亚娥,牟 彪.具有铁氧化功能的硝基苯降解菌的筛选及特性[J]. 中国环境科学,2018,38(5):1837-1843.
[26]张 璐,李婷婷,王 芳,等. 锰氧化细菌的分离鉴定及其锰氧化特性的分析[J]. 微生物学通报,2011,38(3):328-332.
[27]刘颜军,周静晓,王革娇. 锰氧化菌Bacillus sp. MK3-1的Mn(Ⅱ)氧化特性和除锰能力研究[J]. 微生物学通报,2009,36(4):473-478.
[28]张海涛,刘文斌,杨海君,等. 一株耐盐高效苯酚降解菌的筛选、鉴定、响应面法优化与降酚动力学研究[J]. 环境科学学报,2016,36(9):3200-3207.
[29]贺强礼,刘文斌,杨海君,等. 一株苯酚降解菌的筛选鉴定及响应面法优化其降解[J]. 环境科学学报,2016,36(1):112-123.
