增强MRI 纹理分析对于肝内胆管细胞癌患者行肝动脉灌注化疗疗效及预后的预测价值
2020-12-30杨柏帅陈天佑侯毅斌李清涛
杨柏帅,袁 敏,陈天佑,侯毅斌,周 粟,李清涛
肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)起源于胆管上皮,发病率居原发性肝癌中第二位,初次诊断的ICC 患者,能手术切除的仅占10%[1];无法手术切除的ICC,未经治疗中位生存期小于5 个月[2],如果接受系统化疗,中位生存期约为 1年[3]。肝动脉灌注化疗(hepatic arterial infusion,HAI)可以将药物持续地直接注入肝脏,在提高肿瘤局部药物浓度的同时,并不增加化疗药物毒性,从而减少全身不良反应。对于病灶局限于肝脏或转移局限于肝门部淋巴结的不可切除ICC,肝动脉灌注化疗必要时联合系统化疗的疗效优于单纯的系统化疗[4]。影像纹理分析,可以无创评估肿瘤内部异质性。研究已经证实,CT 图像的纹理分析在评估肿瘤治疗疗效方面具有一定的应用价值[5-6]。已有研究显示,MRI 图像特征与ICC 切除术后早期复发具有一定相关性[7-8]。但对于不可切除的 ICC,相关研究尚很缺乏。本研究旨在初步探索增强MRI 纹理分析对于不可切除的ICC 患者行HAI 疗效及预后的预测价值。
1 材料与方法
1.1 一般材料
回顾性分析 2014年5月至 2019年5月我中心诊治的113 例肝内胆管细胞癌病例。
1.1.1 入组标准 ①组织病理确诊为ICC;②术前1周以内接受过肝脏MRI 增强检查;③之前未接受其他抗肿瘤治疗,如手术切除、放疗、化疗、消融、靶向治疗或免疫治疗;④KPS 评分≥70 分,PS 评分≤1 分;⑤肝内至少有1 个可评估病灶,最大直径>1 cm,初始治疗2 个月后进行增强MRI 检查和疗效评价;⑥本研究仅入组肿瘤局限于肝脏的或转移灶局限于肝门部淋巴结的无法手术切除ICC,其余远处转移ICC 均接受常规系统化疗。
1.1.2 排除标准 ①合并肝门部淋巴结以外的淋巴结转移及肿瘤远处转移;②合并其他肿瘤;③合并肝脏基础疾病,如各种原因肝硬化,病毒性肝炎,硬化性胆管炎,自身免疫性肝病等[9];④无法进行增强MRI 检查;⑤合并HAI 或系统化疗禁忌,包括:白细胞计数<4.0×109/L、血小板计数<80×109/L、总胆红素>1.5 倍正常值上限、 转氨酶>3 倍正常值上限、白蛋白<28 g/L、凝血酶原时间较正常值延长3 s以上、 肌醉>115 μmol/L、 合并严重心肺肾功能障碍、或存在严重感染等。
采集基础信息,包括现病史,既往史,实验室检查结果(血常规、肝肾功能、凝血功能、CEA、CA19-9、CA125、AFP),影像资料(胸部平扫 CT,腹盆腔增强MRI),消化内镜(胃镜、肠镜检查明确排除胃肠肿瘤肝转移可能),并按照 AJCC(American Joint Committee on Cancer)2017 版肝内胆管细胞癌分期标准行TNM 分期。所有病例均经肝胆外科评估,确定为无法手术切除的ICC,包括无法重建的血管侵犯;术后残肝体积可能无法维持正常肝脏功能;高龄或合并心肺功能障碍无法耐受手术切除等。所有患者均针对本治疗签署知情同意书。
1.2 方法
排除在治疗过程中因疾病进展而死亡患者6例,因治疗不良反应而无法耐受患者5 例,因故未完成2 次MRI 增强检查患者3 例,无可评估肝内胆管癌病灶22 例,实际完整随访患者77 例,其中男性 49 例,女性 28 例,平均年龄(62.4±9.5)岁(30~81 岁),肿瘤分期,T 分期:T1 期 20 例,T2 期 27 例,T3,17 例,T4 期 13 例;N 分期:N0 期 47 例,N1 期30 例。
1.2.1 图像采集与处理
1.2.1.1 MRI 检查方法:MRI 检查前 24 h 内不进行对比剂增强的影像学检查,检查前4 h 空腹。对患者进行呼吸训练,在呼气末屏气。采用飞利浦公司的 Ingenia3.0T MR 扫描仪,ds Torso Coil 体线圈,呼吸门控。MR 扫描序列包括:屏气冠状位T2 SPAIR,呼吸触发横轴位T2 SPAIR,自由呼吸横轴位弥散DWI(b=0、50、800),屏气横轴位 mDIXON 四相,增强扫描屏气横轴位mDIXON-W(扫描参数:TE=1.13 ms,TR=3.2 ms,层厚 3.5 mm,FOV380×330,采集方式:3D),高压注射器经手背静脉注入MR 增强对比剂钆钡葡胺(Gd-BOPTA),剂量 0.1 mmol/kg,流速 1.2 mL/s,随后以相同流速注入20 mL 0.9%NaCl 溶液冲管。在注射对比剂后33 s 开始扫描动脉晚期、75 s 扫描门脉期、150 s 扫描延迟期。
1.2.1.2 图像处理:在PACS 工作站根据患者T2WI及增强扫描序列确定病灶位置及最大层面,选出病灶在动脉期及门脉期与T2WI 相应的最大层面,且动脉期与门脉期为同一层面。对于单发病灶,选择病灶最大径层面,对于多发病灶,选择直径最大的两个可重复测量病灶层面,将图像从PACS 工作站以BMP格式导出,导入纹理分析软件MaZda(版本 4.6.2),选取2 位有3年以上腹部MRI 影像诊断经验的高级职称医师,且均对于患者临床资料不知情,分别沿病灶边缘手动勾画感兴趣区(region of interest,ROI)(图 1)。
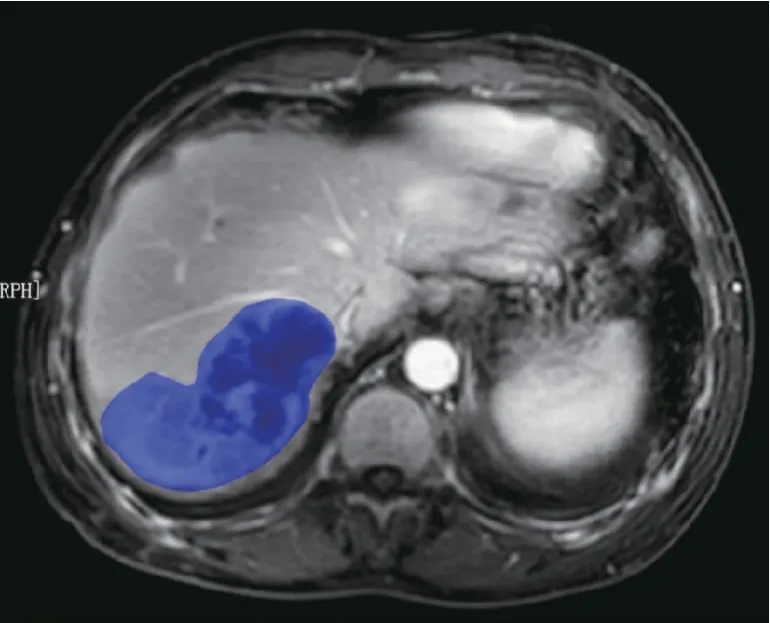
图1 1 例肝内胆管癌患者感兴趣区勾画图
1.2.2 纹理分析 本研究选择文献普遍报道并常用的一阶直方图中的偏度(skewness)、峰度(kurtosis)与二阶灰度共生矩阵中的均值(mean)和熵(entropy)进行分析。
1.2.3 HAI 局麻后穿刺股动脉,引入4~5 F RH导管(美国强生公司),分别行腹腔干、肝总动脉、肠系膜上动脉等造影,明确所有肝脏病灶供血分支后,使用2.7 F 微导管(日本朝日公司)超选肝动脉或其他肿瘤供血分支,行灌注化疗。
1.2.4 药物应用 药物选择及剂量参考胆管细胞癌系统化疗方案[10-11],再选取系统化疗剂量的60%行HAI,口服化疗药物剂量同系统化疗。具体方案如下:吉西他滨600 mg/m2与奥沙利铂60 mg/m2分别稀释后,经导管持续滴注2 h,21 d 为1 个周期,治疗3 个周期,共44 例患者。吉西他滨600 mg/m2与奥沙利铂40 mg/m2分别稀释后,经导管持续滴注2 h,同期口服卡培他滨 1 000 mg/m22 次/d,d1-14,21 d为1 个周期,治疗3 个周期,共33 例患者。
1.2.5 随访评估 治疗2 个月后行全面评估,包括实验室检查结果(血常规、肝肾功能、凝血功能、CEA、CA199、CA125),影像资料(胸部平扫 CT,腹盆腔增强MRI),采用RECIST 1.1 标准进行疗效评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),将 CR+PR+SD 定为肿瘤控制组,将 PD 定为肿瘤进展组。评估两组患者靶病灶术前纹理分析参数的差异。
1.2.6 后续治疗 治疗期间密切患者化疗相关不良反应,按照 CTCAE3.0 标准(National Cancer Institute Common Toxicity Criteria version 3.0),如果出现Ⅰ~Ⅱ度不良反应,则按指南减量,出现Ⅲ度以上不良反应则停药。随访评估为肿瘤控制的患者,继续治疗直至进展。出现肿瘤进展,如果患者可以耐受二线治疗,则肝内病灶进展,更换二线药物(白蛋白紫杉醇)继续行HAI,肝外进展则改为二线药物(白蛋白紫杉醇)行系统化疗。本研究中,二线治疗后再次进展患者,均选择最佳支持治疗。
1.3 统计学分析
采用SPSS 22.0 软件进行统计学分析,符合正态分布的计量资料采用独立样本t 检验,不符合正态分布的,用Mann-Whitney U 检验。对于两名影像医师勾画感兴趣区所测量出的MRI 纹理特征参数,应用组内相关系数评价观察者间一致性,将>0.8视为一致性较好。对于一致性较好的参数,采用2名医师测得参数的平均值进行数据分析,再绘制受试者工作特征(ROC)曲线,确定增强MRI 纹理分析预测不可切除ICC 行HAI 疗效的菩值及效能(灵敏度、特异度及最大约登指数),并依据纹理分析结果分组,制作Kaplan-Meier 生存曲线,行 Log-Rank 检验,再应用Cox 回归分析对预后影响因素行多因素分析,以P<0.05 认为差异有统计学意义。
2 结果
2.1 近期疗效
完成随访患者77 例,治疗2 个月后按照RESIST 1.1 标准评估,CR 0 例(0%)、PR 12 例(15.6%)、SD 27 例(35.1%)、PD 38 例(49.3%),肿瘤控制 39 例(50.7%)。治疗期间 62 例(80.5%)患者出现化疗后Ⅰ、Ⅱ度不良反应,5 例患者因Ⅲ度不良反应而停止治疗,故未纳入后续研究,治疗期间所有患者均未出现严重外周神经毒性。
2.2 一致性分析
2 名医师分别勾画病灶动脉期与门脉期ROI,提取特征性参数,行一致性分析,其偏度、峰度、均值和熵的组内相关系数均>0.8,视为一致性较好,故应用2 名医师测得参数的平均值进行数据分析。
2.3 纹理分析
患者按疗效评估分为进展组和控制组,分别计算治疗前可评估病灶动脉期、 门脉期各纹理特征参数,评估得出治疗前两组患者动脉期图像,在偏度、峰度、均值和熵之间无差异,门脉期图像,在偏度、峰度、均值之间无差异,熵值之间,进展组熵值(1.592±0.137)大于控制组熵值(1.465±0.066),(P<0.05),两组差异有统计学意义,提示病灶熵值越高,近期疗效越差。
2.4 ROC 曲线
以治疗前门脉期图像病灶熵值与肿瘤控制情况绘制ROC 曲线,测得曲线下面积为(AUC)为0.817,灵敏度为79.5%,特异度为76.3%,最大约登指数为0.558,对应熵值为1.503。提示基于纹理分析得到的熵值结果,预测HAI 近期疗效具有较好的诊断效能(图 2)。
2.5 生存分析
77 例患者,平均随访12.3 个月,中位总生存期(mOS)12 个月。以初始治疗结果分为进展组(38 例,49.4%)和控制组(39 例,50.6%),绘制 Kaplan-Meier生存曲线,进展组mOS 8 个月,控制组13 个月,行Log-Rank 检验,P=0.006,差异有统计学意义,提示初始治疗效果好的患者,预后相对较好(图3)。以MRI 纹理分析得出的门脉期图像病灶熵值结果作为分组依据,熵值≥1.503 为高熵值组、熵值<1.503为低熵值组,绘制Kaplan-Meier 生存曲线,高熵值组中位生存期11 个月,低熵值组中位生存期13 个月,行Log-Rank 检验,P=0.116,差异无统计学意义,提示熵值结果尚不能作为患者远期预后预测指标(图 4)。

图2 基于门脉期图像病灶熵值与肿瘤控制情况的ROC 曲线

图3 两组患者的生存曲线
2.6 多因素分析
将患者可能影响预后的因素:年龄、性别、T 分期、N 分期、HAI 治疗方案、门脉期病灶熵值、初始治疗疗效分组作为自变量,行Cox 回归分析。结果显示,治疗前T 分期是独立预后影响因素(表1)。
3 讨论

图4 不同熵值患者的生存曲线

表1 多因素Cox 回归分析结果
ICC 起源于胆管上皮,最常见的病理类型为腺癌,近年来发病率在全球范围内不断上升,目前在原发性肝癌中排第二,占原发性肝癌的5%~15%,唯一的治愈方式是手术切除。但是,由于疾病缺乏早期症状,临床也无有效的筛查手段,同时ICC 极易肝内播散、淋巴结转移,血管侵犯以及血行远处转移,因此,绝大多数患者确诊时已经无法手术切除[12]。进展期 ICC 预后不良,相对传统的吉西他滨单药治疗,吉西他滨联合顺铂、5-FU、奥沙利铂或卡培他滨的方案,生存期改善有限,尚无一种方案具有绝对优势,生存期也不超过1年,目前已有的靶向治疗药物,对于患者的生存期也没有延长[13-14],因此亟待更加有效的治疗方式。
HAI 对于ICC 是一种有效的治疗方式,将高剂量化疗药物直接经动脉灌注入肿瘤区域,在提高肿瘤局部药物浓度的同时,不增加化疗毒性,减少了全身不良反应[15]。Konstantinidis 等[4]的研究显示,对于局限于肝脏的不可手术切除的ICC,系统化疗联合HAI 的疗效明显优于单纯系统化疗,治疗后肿瘤控制率更高,生存时间也更长(30.8 个月比18.4 个月),对于局限性淋巴结转移的患者,HAI 也有着更好的总生存期(29.6 个月比 15.9 个月),HAI 联合系统化疗可以最大限度提高肝脏病灶疗效,同时对于肝外微小转移灶也有一定的疗效。本研究,也得出类似的结果,本研究中患者近期 PR、SD、DCR 及中位OS 均不亚于既往系统化疗的结果[10-11]。提示 HAI 对于局限于肝脏不可切除的ICC 患者疗效满意。
尽管大量文献已经证实HAI 治疗ICC 患者的有效性,并提示其能显著改善预后,但是,仍有约50% ICC 患者一线治疗后肿瘤持续进展,由于ICC进展迅速,这部分患者几乎没有机会接受二线治疗。因此,早期预测化疗反应对于临床治疗决策和患者筛选就显得尤为重要。传统上,仅基于肿瘤大小的测量对于治疗效果评估及预测存在一定的局限性[16]。而纹理分析,作为一种生物影像标志物,可以无创评估肿瘤内部异质性,反映肿瘤亚型、 细胞增殖或凋亡、代谢活性、血管结构等。通过分析图像中像素、灰阶等特征参数,纹理分析比形态学分析更为详细且能定量地评价病变特征,是一种非常有前途的生物影像标志物[17]。同时,近期研究显示,肿瘤内部的异质性与治疗后不良反应和生存期密切相关。理论上,通过纹理分析量化肿瘤异质性,对于肿瘤的诊断、分级、随访监测、预测疗效及预后具有重要价值[18]。已有大量的文献证实,肿瘤影像的纹理特征与临床疗效及预后之间存在密切关联[19-20],CT 图像纹理分析已被证实有助于预测结直肠癌肝转移患者疗效及预后[6,21-22]。同时,相较于普通 CT 图像,增强 MRI 采集的信息更多,对于血流、血管通透性和细胞外间隙的变化更加敏感[23]。因此,MRI 图像纹理分析可以更好地评估肿瘤特征,鉴别病理类型,区分恶性程度,并能预测治疗效果[16,24-25]。本研究也得出类似结果,证实了MRI 图像纹理分析对于患者行HAI 的近期疗效具有良好的预测价值。
Zhang 等[26]的研究结果提示,肿瘤异质性越高,对于治疗有更好的反应,考虑与这些肿瘤低氧微环境、不规则血管新生和细胞外血管通透性等特征相关,异质性越高的肿瘤往往具有更高的代谢水平和更丰富的血管分布[19-20]。而化疗的效果很大程度取决于化疗药物的输送,也就与肿瘤的血供和代谢密切相关。理论上,异质性越高的肿瘤,能更多地将化疗药物输送到病变区域,相对提高了药物吸收和生物利用度,从而得到相对更好的疗效。与之相反,也有文献提示,肿瘤异质性与肿瘤生物学特征密切相关,异质性越高,相对恶性程度越大,预后也较差[27]。本研究提示,熵值较高的病灶,对应较高的异质性与较大的肿瘤恶性程度,这部分病灶治疗效果相对较差,一个可能的解释是,经静脉途径行系统化疗,肿瘤局部药物浓度极大地依赖于肿瘤血供,导致肿瘤异质性越高,血供越丰富,疗效反而越好,而经动脉直接行HAI,从给药方式上提高了局部药物浓度,从而降低了肿瘤血供的影响,使得疗效更多取决于肿瘤的恶性程度。
本研究中对预测HAI 疗效的参数中,动脉期的参数均无意义,而门脉期中的熵值与疗效密切相关,这可能与绝大多数ICC 病灶呈渐进性强化相关,理论上,ICC 病灶,门脉期强化相对明显,有利于准确显示肿瘤异质性,从而能更好地显示肿瘤内部纹理特征参数,有助于揭示病变内微观生物学特征,进而对于疗效评估及预后预测具有一定的参考价值。
本研究提示纹理特征参数对于患者近期疗效具有预测价值,但患者如果按照熵值高低分组,两组患者远期生存曲线差异无显著性,多因素分析也提示熵值不作为独立的预后因素。可能的解释是,影响ICC 患者预后的因素复杂多样,进行性肝功能衰竭、急性门脉高压所致的消化道出血、腹腔多发转移所致的肠梗阻、抑或是肺多发转移导致的呼吸衰竭对于患者预后均有重要影响,而这些是无法从肝内病灶的MRI 图像纹理分析中获得并进行预测的。因此,MRI 纹理分析目前只能作为局部病灶近期疗效预测的一种选择方式,尚无法作为患者总生存期的预测指标。
本研究存在一定局限性:①本研究为回顾性分析且病例数相对有限;②基于病灶纹理特征分析只能提供肿瘤评估病灶、 评估层面的纹理特征信息,不能代表整个肿瘤病灶,也无法提供肝内非肿瘤浸润部分的信息,而这可能与肿瘤浸润、转移、患者肝功能情况密切相关,甚至直接影响预后;③本研究为了化疗效果、不良反应以及纹理分析本底的一致性,排除了各类型肝炎及肝硬化患者,但临床实践中,起源于肝炎肝硬化的肝内胆管癌数量众多,文献已证实,ICC 与丙型病毒性肝炎(HCV)和非乙醇性肝硬化密切相关[28-29],对于这部分患者,尚待进一步研究;④ICC 按其生长方式可分为3 种组织学类型:肿块型、胆管周围浸润型和胆管内生长型[30],由于纹理分析以及影像随访评估的局限,本组入选的病例均为肿块型,因此本研究结果暂不适用于所有的肝内胆管细胞癌。
增强MRI 纹理分析对于不可切除的ICC 患者行肝动脉灌注化疗的近期疗效具有一定预测价值。
