葡萄MPT基因家族鉴定与表达分析
2020-12-29杨明霞连红娟王晓芳杜宜洋董志刚
杨明霞,连红娟,王晓芳,杜宜洋,董志刚,纪 薇,,*
(1.山西农业大学 果树研究所,山西 太原 030031; 2.山西农业大学 园艺学院,山西 太谷 030801)
线粒体磷酸转运体(mitochondrial phosphate transporter, MPT)是位于线粒体内膜上的一种重要的功能蛋白,负责将重要代谢底物无机磷酸通过线粒体内膜从细胞质转移到线粒体基质中,在细胞维持正常功能中起到了关键的生理作用[1]。植物体中,MPT主要分为Pi/H+同向转运体,Pi/OH-逆向转运体以及Pi/Pi转运体。源于膜两侧的pH梯度的线粒体电子传递链是Pi吸收的主要动力。MPT相对分子质量约为30 ku,由3个串联结构域构成。每个结构域含有100个氨基酸左右,扭转串联成两个α-螺旋组成跨膜结构,因此MPT总共有6个跨膜结构域[2]。
高度保守的MPT的氨基酸序列比对在近年来才在植物中开展[3-4]。很多残基的功能还没有被试验验证,但其磷酸转运活性被一致认可。随后的表达分析表明,桦树的MPT的表达随着幼叶的长大缓慢提高,在幼茎中表达量最高,经臭氧胁迫2 h后,mRNA在转录水平上积累,在处理12 h后,受诱导程度最高[3]。也有报道说明,植物中的MPT除了受到臭氧的诱导外,还存在真菌诱导响应[4]。总而言之,MPT在发育中的器官和组织中,有很高的表达量,来满足这些部位对高能量的需求。这些表达模式说明MPT对于细胞维持正常功能起到了关键的生理作用。
对于葡萄MPT基因家族已有部分研究,但大多集中于能量的需求及运输途径探究,对于植物MPT与逆境胁迫抗性的关系,仍不是很清楚。本研究通过生物信息学,及已公布的葡萄基因组序列信息,筛选VvMPT基因,分析其基因序列、染色体定位、理化性质、系统进化关系、基因结构、启动子分析、保守基序和组织表达模式,为进一步研究VvMPT基因功能提供参考和理论依据。
1 材料与方法
1.1 基因组和转录组数据来源
葡萄全基因组数据来源于葡萄基因组CRIBI生物技术中心(CRIBI Genomics, http://genomes. cribi.unipd.it/grape/),拟南芥MPT蛋白序列下载于拟南芥数据库(http://www.arabidopsis.org),水稻MPT蛋白序列下载于 PlantTFDB数据库(http://planttfdb.cbi.pku.edu.cn)。
1.2 葡萄MPT基因家族成员的鉴定及序列分析
从Pfam数据库(http://pfam.xfam.org/)中下载MPT基因家族的HMM序列比对文件(PF00153),然后从葡萄基因组CRIBI生物技术中心下载包含葡萄基因组蛋白质序列注释的自定义数据库,并用HMMER检索。同时将比对文件转换格式后,以MPT的保守结构域为探针,通过生物编辑器从葡萄基因组中鉴定葡萄MPT基因进行补漏。候选的HMMER序列进一步使用Pfam和SMART(http://smart.embl-heidelberg.de/)筛选葡萄蛋白序列中含有MPT结构域的序列(E-value≤10-10)。然后使用Pfam和SMART检测其蛋白结构域,除去不含MPT结构域的序列获得VvMPT家族的基因序列。
利用在线软件ExPASy(http://www. expasy.org/tools/)预测葡萄MPT蛋白的氨基酸序列与理化性质,包括相对分子质量、等电位、亲水性、不稳定系数等。利用PSORTH进行亚细胞定位。并将葡萄MPT基因比对拟南芥数据库获得拟南芥的同源基因,为葡萄MPT家族成员的基因功能预测提供参考。
1.3 系统进化树的构建
利用ClustalX V.2.0将候选蛋白与拟南芥、水稻MPT基因家族蛋白进行多序列比对,使用MEGA 6.0软件,采用最大似然法(maximum likelihood,ML)(Bootstrap=1 000)进行系统进化树的构建。使用在线版网络标识软件生成MPT基因家族的序列标识 (http://weblogo.berkeley.edu/logo.cgi)。
1.4 葡萄MPT基因家族基因结构分析
根据所得葡萄MPT基因蛋白序列和基因序列,利用在线软件 GSDS 2.0(http://gsds.cbi.pku.edu.cn/index.php)进行基因结构分析。
1.5 葡萄MPT保守基序motif分析染色体定位和共线性分析
利用MEME(http://meme-suite.org/)在线程序分析葡萄MPT转录因子家族保守基序,预测基序的数量设置为20个;用TBtools分析得到葡萄MPT的motif模式图,以此对葡萄MPT基因蛋白保守基序进行分析。利用MAP Inspector进行染色体定位作图。使用软件TBtools得到基因串联重复图。利用TBtools进行共线性作图。
1.6 MPT家族基因表达分析
从NCBI数据库中下载与葡萄生长发育有密切关系的组织器官RNA-Seq数据,包括根、新鲜叶片、成熟花、花芽、成熟果实、内种皮、外种皮、根茎叶果混合样、授粉后50 d的果皮、授粉后95 d的果皮和授粉后140 d的果皮,详情见表1。利用Kallisto v0.43.1软件对转录组数据表达差异进行分析,将所得的差异数据进行log2(TPM+1)转换,最后用R绘制葡萄MPT基因家族的表达热图。
从植物表达数据库下载全部的多阵列平均归一化微阵列表达数据(http://plexdb.org/)。分析四个试验相关微阵列:PEG胁迫反应、低温胁迫反应、热胁迫反应、病原体和氧化应激反应。
使用Gene Expression Omnibus数据集(http://www.ncbi.nlm.nih. gov/gds/)分析54个不同的葡萄组织(GSE36128)中VvMPT基因的标准化转录物表达数据。用多实验查看器(MeV)绘制葡萄MPT基因家族的表达热图。
2 结果与分析
2.1 葡萄MPT基因家族成员的鉴定及序列分析
从Pfam数据库中下载MPT基因家族的序列比对文件(PF00153),用HMMER筛选葡萄蛋白序列中含有该结构域的序列,进一步使用Pfam和SMART筛选葡萄蛋白序列中含有MPT结构域的序列,基于E-value≤10-10[5]。将比对文件转换格式后,以MPT的保守结构域为探针,通过生物编辑器从葡萄基因组中鉴定出67个葡萄MPT基因,通过Hmmscan程序检索Pfam-A数据库发现64个MPT基因都含有MPT蛋白结构域,其中两个基因(VIT_214s0068g00890.1、VIT_217s0000g00030.1)除了具有典型的MPT保守结构域外,还有其他的结构域EF-hand,还有1个基因(VIT_209s0002g01610.1 AAA_5)含有5个结构域(AAA_5、MPT、AAA_3、AAA_lid_5和AAA_lid_7),另外VIT_200s0827g00030.1、VIT_200s1209g00010.1、VIT_216s0039g00600.1无基因结构域标识,因此从MPT家族基因中剔除。最终,本文从葡萄基因组中预测出64个MPT基因,根据这些基因所在的染色体位置1到19从上到下的顺序分别命名为VvMPT1至VvMPT64。
通过ExPASy在线工具,对葡萄MPT基因家族进行理化性质分析。分析结果显示,VvMPT33的氨基酸长度为4 800,相对分子质量(MW)为542 048.11 u,VvMPT48和VvMPT64的氨基酸长度最小为64,剩余VvMPT的长度范围为105~829个氨基酸,相对分子质量(MW)为6 618.57~91 222.66 u。其等电位范围从5.34到10.11不等,亲疏水性均值(GRAVY)范围为-0.253~0.403(表1)。亚细胞定位预测发现,VvMPT6主要定位于细胞外,包括细胞壁;VvMPT2、VvMPT10、VvMPT38、VvMPT57和VvMPT64,5个主要定位于线粒体;VvMPT3、VvMPT7、VvMPT22、VvMPT24、VvMPT28、VvMPT2、VvMPT36、VvMPT49、VvMPT56,9个主要定位于内质网;其余基因主要定位于细胞质。
2.2 VvMPT染色体定位分析及基因的串联重复
染色体定位分析显示,葡萄的64个MPT基因定位于19条染色体中,4个MPT基因定位于未组装的基因组序列支架,因此,未定位于任何特定染色体。在图1中,发现染色体6和19中具有单个MPT基因,染色体1、3、11、12和15中各自具有2个MPT基因,染色体2、5、7、9和10具有3个MPT基因,染色体6、13和染色体17具有4条MPT基因。染色体4、14、18各有5条MPT基因。
本研究分析了64个VvMPT基因在19条葡萄染色体上的串联重复事件,其中200 kb内包含两个或更多基因的染色体区域被定义为串联重复事件。目前VIT_214s0068g01250.1和VIT_214s0068g01260.1存在串联重复。
2.3 葡萄MPT基因家族基因结构及系统发育树分析
为了研究VvMPT基因的系统进化关系,利用VvMPT蛋白全长序列构建系统进化树。据分析,通过ClustalX V.2.0对葡萄64个VvMPT基因,拟南芥(双子叶)58个AtMPT基因,水稻(单子叶)25个OsMPT基因进行多序列比对,使用MEGA 6.0软件,采用最大似然法进行系统进化树的构建(图2)。
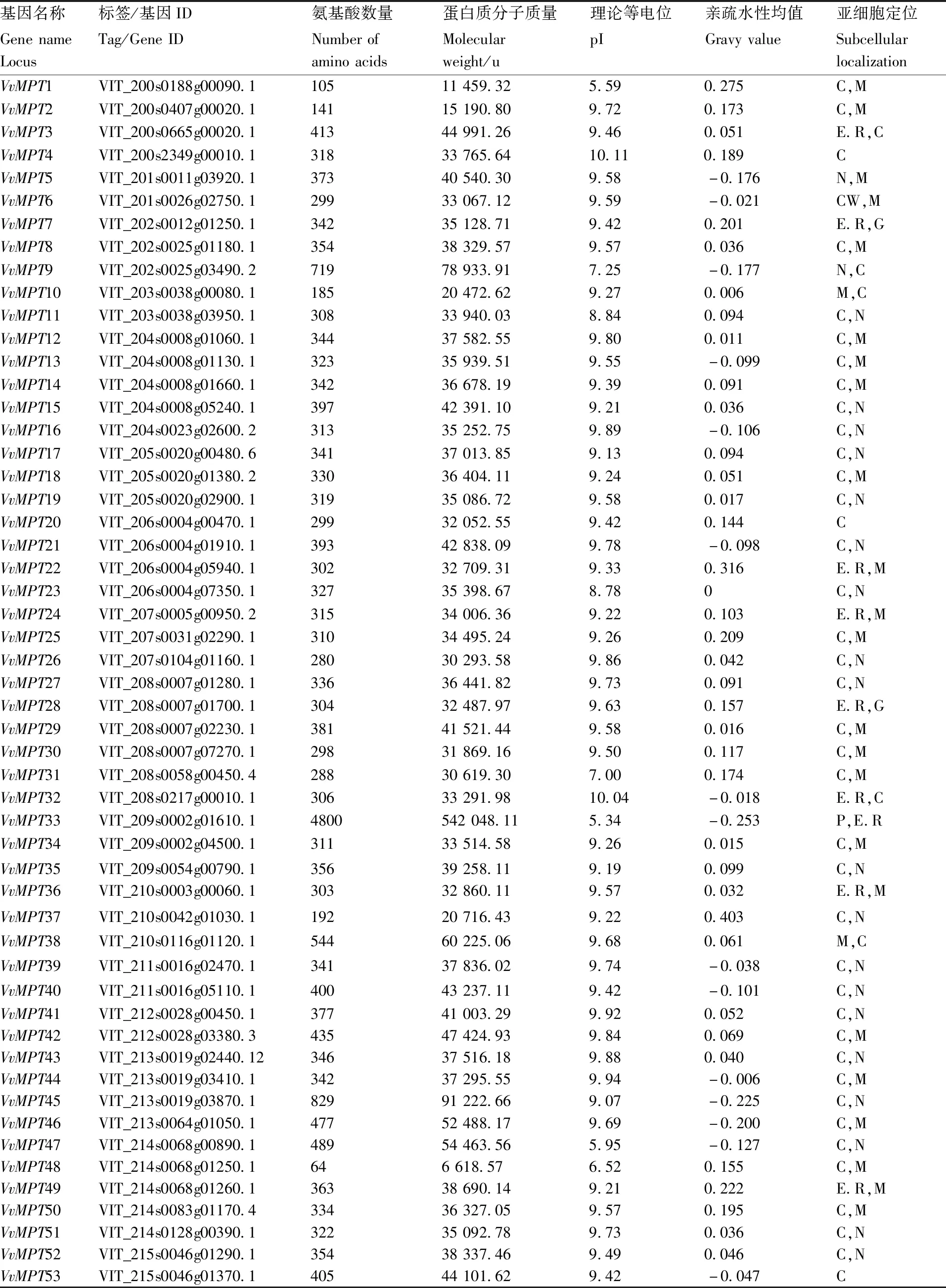
表1 葡萄MPT家族基本信息

红色方框为串联重复。The red box is a series repetition.图1 VvMPT基因家族染色体定位Fig.1 Chromosome location of VvMPT family members
依据拟南芥AtMPT的分类标准,稍作改动后将MPT分为7组并用GroupⅠ-GroupⅦ 表示(图2)[6]。由图可将MPT基因分为7类,分别为Group Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅶ。其中Group Ⅰ 有5个VvMPT基因,Group Ⅱ有10个VvMPT基因,GroupⅢ有7个VvMPT基因,Group Ⅳ有22个VvMPT基因,Group Ⅴ有3个VvMPT基因,Group Ⅵ有5个VvMPT基因,Group Ⅶ有11个VvMPT基因。在Group Ⅵ中只有拟南芥和葡萄家族基因,且包含两对同源基因。

Vv,葡萄;At,拟南芥;Os,水稻。Vv, Vitis vinifera L.; At, Arabidopsis thaliana; Os, Oryza sativa L.图2 MPT基因家族的进化分析Fig.2 Phylogenic tree of MPT family members
2.4 葡萄MPT蛋白结构及保守基序分析
为研究VvMPT基因结构的特征,用在线软件GSDS2.0分析其基因结构(图3)。结构分析表明,VvMPT基因家族成员的基因结构稳定,不同的VvMPT基因所含外显子和内含子数量差异不大,外显子数为1~55,内含子数为1~54。绝大多数的VvMPT外显子数都在5个以上,其中有8个VvMPT有14个外显子,外显子数随着系统进化树由外端分支到内部分支逐渐增多。同时除了VvMPT17、VvMPT38、VvMPT19以外,其余基因5′上游比3′下游序列长,VvMPT基因家族外显子长度保守性差,没有显著规律[7-9]。
2.5 葡萄MPT基因启动子上游2 kb顺式作用元件分析
在64个VvMPT的启动子区域中,对顺式调控元件进行分析,研究非生物胁迫响应机制。在64个VvMPT的启动子区域中,胁迫相关顺式元件包括ABA响应元件ABRE(response to ABA)、厌氧诱导响应元件ARE (anaerobic induction)、茉莉酸反应CGTCA-motif(MeJA-responsive)、赤霉素反应P-box(gibberellin responsive)、水杨酸反应TCA-element(salicylic acid responsive)、分生组织表达CAT-box(meristem expression)、干旱诱导MBS(rought-inducibility)、生长素应答AuxRR-core(auxin responsive)、防御和胁迫反应TC-rich repeats(defense and stress responsive)、低温响应元件LTR (response to low temperature)[10]。为了确定VvMPT基因家族启动子上游2 kb区域的顺式作用元件,在该基因家族起始密码子上游2 kb碱基序列中进行搜索,结果表明,VvMPT基因家族成员中ABRE(ABA响应原件)最多有125个,MBS(干旱诱导响应元件)32个,LTRE(低温响应元件)22个最少。在VvMPT基因家族中,除VvMPT1、VvMPT13、VvMPT14、VvMPT25、VvMPT26、VvMPT29、VvMPT31、VvMPT33、VvMPT36、VvMPT37、VvMPT40、VvMPT45、VvMPT49、VvMPT55、VvMPT58、VvMPT61、VvMPT62、VvMPT63、VvMPT64以外,其余均含有ABRE响应元件;VvMPT10在ABRE上的响应均最高。VvMPT62不含其中任何一种顺式作用元件(表2)。
2.6 葡萄MPT基因家族的表达分析
为进一步分析葡萄MPT基因的特性和功能,对MPT基因组织特异表达情况进行分析,获得了各组织中VvMPT的表达量构建表达热图(图4)。结果显示,VvMPT1在茎、卷须中低表达,VvMPT11、VvMPT37在叶片、浆果中相比其他器官中等表达,VvMPT48、VvMPT58在各器官中低表达,VvMPT12、VvMPT21、VvMPT22、VvMPT27、VvMPT29、VvMPT56在各器官中高表达无明显差异。VvMPT31在芽、卷须、花粉中低表达,在浆果、花粉、叶片、叶轴上中高度表达。
2.7 葡萄MPT家族基因与拟南芥MPT家族基因共线性分析
利用基因组比较方法,将经过大量研究的物种的基因组结构和功能的知识转移到研究较少的物种通常是一种方便且高效的方法。因此,将葡萄中MPT家族基因与模式植物拟南芥中的同源基因进行比较,以预测它们的功能。根据比较基因组分析(图5),共鉴定出31对同线关系,包括29个AtMPT基因和26个VvMPT基因。发现了10个AtMPT基因(AT1G07025.1、AT2G30160.1和AT2G37890.1、AT3G53940.1,AT3G54110.1、AT5G58970.1,AT3G05290.1、AT5G27520.1,AT5G61810.1、AT5G51050.1)和5个VvMPT基因(VIT_206s0004g07350.1、VIT_208s0007g01280.1、VIT_208s0007g01700.1、VIT_214s0128g00390.1、VIT_217s0000g00030.1)参与到至少3对共线性关系中。根据该分析,配对的VvMPT-AtMPT基因位于葡萄和拟南芥基因组之间具有同线性的基因组区域。
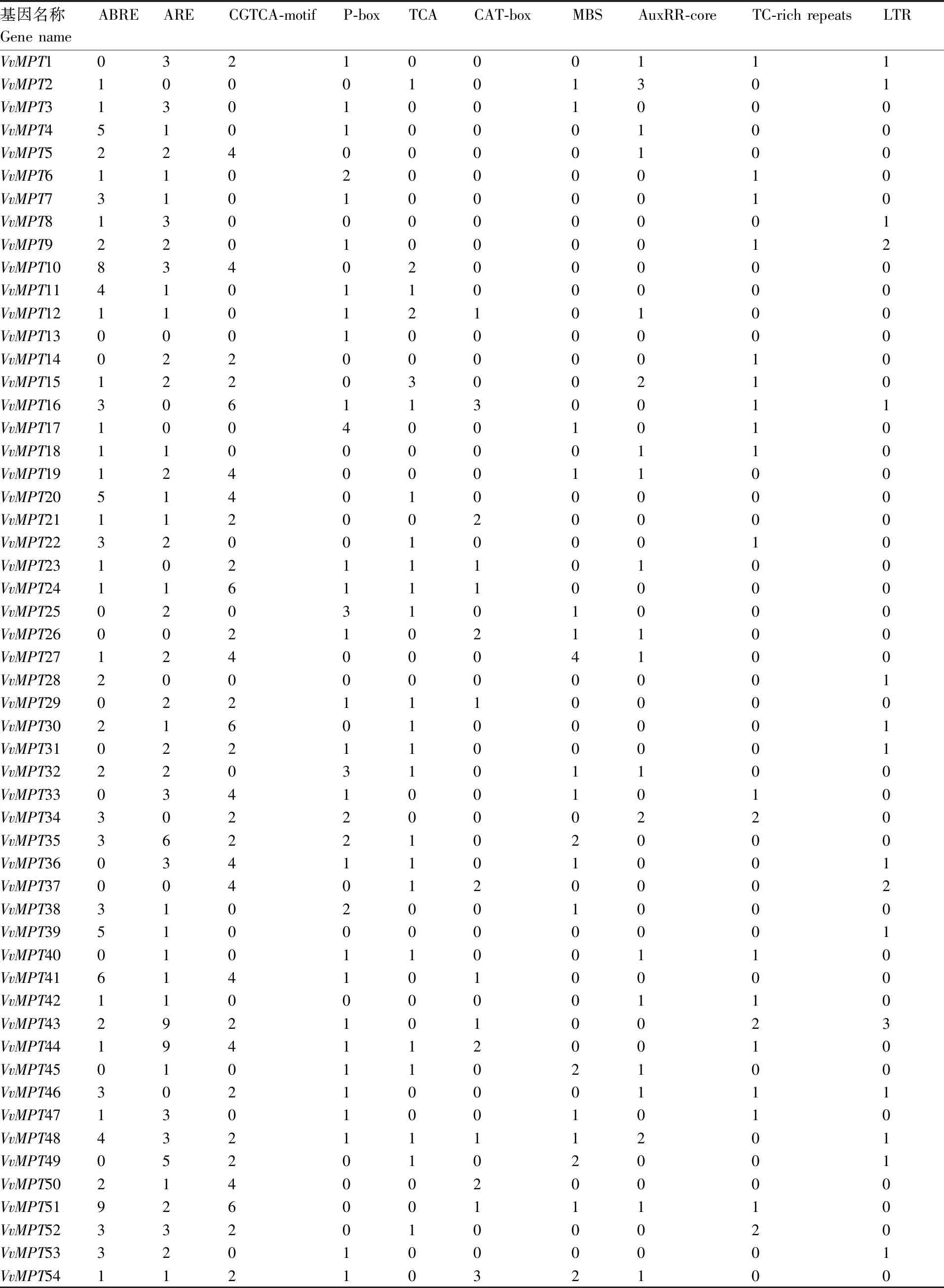
表2 葡萄VvMPT 基因家族启动子序列主要顺式元件分析
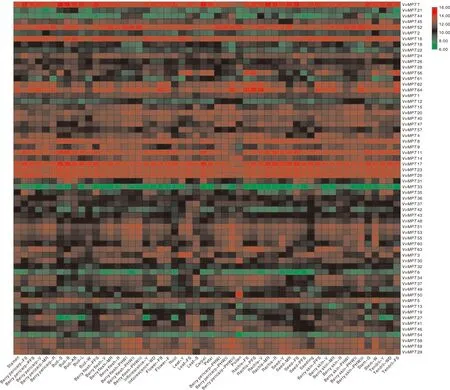
图4 葡萄MPT基因在不同组织部位的表达热图Fig.4 Heat map of MPT gene expression in different tissues of grape

图5 葡萄和拟南芥的MPT基因家族同源性分析Fig.5 Synteny analysis of MPT genes from Vitis vinifera L. and Arabidopsis thaliana
3 结论与讨论
MPT类家族是位于线粒体内膜上的一种重要的功能蛋白,在细胞维持正常功能中起到了关键的生理作用。在人类和牛的基因组中,只有一个基因编码线粒体磷酸转运体,随后经过可变剪切,产生两种形式的MPT,A型和B型。A型只是为需能高的组织例如肌肉等提供能量,而B 型可对所有的组织提供基本的能量需求[11-12]。植物MPT的研究滞后,Kiiskinen等[4]研究发现,在桦树的基因组中只存在一个线粒体磷酸转运体,而随后Takabatake等[3]说明在植物中存在多个拷贝的线粒体磷酸转运体,这一点与动物和酵母的MPT存在差别。本研究利用生物信息学方法,通过鉴定分析一共筛选出64个可能的葡萄MPT基因家族成员。64个VvMPT分布于19条染色体上,亚细胞定位分析表明,64个VvMPT主要定位于线粒体中。
将鉴定的64个VvMPT基因与来源于拟南芥、水稻的83个MPT基因构建进化树,并结合拟南芥基因家族的分类标准将其分为7组。进化树分析表明,大部分葡萄MPT基因与拟南芥MPT基因亲缘关系更近,这与葡萄、拟南芥都是双子叶植物这一事实相符。
外界环境尤其是一些非生物逆境如干旱、低温等条件的作用下,具有胁迫响应元件的基因表达水平也会升高,顺式作用元件分析表明,在64个葡萄MPT家族基因中检测到125个ABRE(ABA响应元件)、32个MBS(干旱诱导响应元件)、22个LTRE(低温响应元件),推测大多数VvMPT基因在生长素信号下被转录表达,在成熟和衰老过程中会产生更多的脱落酸、赤霉素、水杨酸和茉莉酸等内源激素,葡萄中VvMPT在不同的非生物胁迫下能被诱导和转录调控,这些推测在一些试验中得到了验证[13-19]。这些研究均表明,植物可以通过植物激素传递的信号来调节自身的生长来适应不断变化的外界环境[20-21]。我们后续的分析将集中于有关环境胁迫和植物激素相互关系的研究。
拟南芥作为一种模式植物,各类基因的研究都比较深入,根据共线性分析结果结合已有拟南芥相关研究来预测葡萄同源基因的功能,可以快速有效地缩短研究进度。本研究根据比较基因组分析,共鉴定出31对VvMPT-AtMPT基因,包括26个VvMPT基因和30个AtMPT基因,配对的VvMPT-AtMPT基因位于葡萄和拟南芥基因组之间具有同线性的基因组区域。这些基因可能来源于一个共同的祖先,具有潜在的相似功能,且在物种分化前就已完成基因复制现象。已有研究表明,AtMPT1(AT2G17270)、AtMPT2(AT3G48850)和AtMPT3(AT5G14040)受到高盐胁迫、渗透胁迫的不同程度的诱导[1],而VvMPT11(共线性于AtMPT1)、VvMPT55、VvMPT56(共线性于AtMPT2)是否有类似功能将是我们的一个重要研究内容。
本研究组织特异性表达表明,VvMPT12、VvMPT21、VvMPT22、VvMPT27、VvMPT29、VvMPT56在各器官中高表达。VvMPT31 在芽、卷须、花粉中低表达,在浆果、花粉、叶片、叶轴上中高表达。研究结果与以往的研究结果中VvMPT基因在果皮、花、叶中高表达[4]基本一致,表明VvMPT基因家族成员在花器官的发育中起到了重要作用。然而,具体功能仍需要进一步的实验分析来证实。
通过对葡萄MPT基因的研究分析,为进一步了解葡萄MPT基因家族成员的结构与功能的关系、揭示MPT基因在参与葡萄花器官生长发育的调控机制与维持细胞离子平衡等方面奠定了一定的理论基础。今后研究的重点是葡萄MPT基因家族成员的功能验证、MPT基因响应各种胁迫及生长素信号的调控机制,有助于了解MPT基因功能的特异性,推动植物花器官发育过程中及环境胁迫下转录因子信号传导网络的研究与发展。
