姜黄素对H2O2致H9c2心肌细胞损伤的抗凋亡作用及对NF-κB信号通路的调节作用研究
2020-12-28顾长海李忠陈冬玲
顾长海 李忠 陈冬玲
摘 要 目的:探討姜黄素对H2O2致H9c2心肌细胞损伤的抗凋亡作用及对核因子κB(NF-κB)信号通路的调节作用。方法:将大鼠H9c2心肌细胞随机分为正常对照组、损伤模型组和姜黄素低、中、高剂量组(25、50、100 μmol/L)。正常对照组不作任何干预;损伤模型组细胞以50 μmol/L H2O2诱导12 h以建立损伤模型;姜黄素各剂量组经相应浓度药物预处理24 h后,再以50 μmol/L H2O2诱导12 h。继续培养24 h后,采用MTT法和TUNEL法分别检测细胞的存活率和凋亡率;采用WTS-8法和显色法分别检测细胞中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量;采用免疫荧光法检测细胞中微管相关蛋白1轻链3(LC3)阳性表达的相对荧光强度;采用实时定量聚合酶链式反应法检测细胞中NF-κB p65 mRNA的表达水平;采用Western blotting法检测细胞中NF-κB p65、磷酸化NF-κB p65(p-NF-κB p65)蛋白的表达水平。结果:与正常对照组比较,损伤模型组细胞的存活率和SOD活性均显著降低,细胞凋亡率、MDA含量、LC3阳性表达相对荧光强度以及NF-κB p65 mRNA和NF-κB p65、p-NF-κB p65蛋白的表达水平以及p-NF-κB/NF-κB比值均显著升高(P<0.05)。与损伤模型组比较,姜黄素各剂量组细胞存活率和SOD活性均显著升高,细胞凋亡率、MDA含量、LC3阳性表达相对荧光强度以及NF-κB p65 mRNA和NF-κB/p65、p-NF-κB p65蛋白的表达水平以及p-NF-κB p65/NF-κB p65比值均显著降低(P<0.05)。结论:姜黄素能够提高H2O2致损伤H9c2心肌细胞的存活率、降低其凋亡率,提高心肌细胞中SOD活性并降低MDA含量;上述作用可能与调节心肌细胞NF-κB信号通路有关。
关键词 姜黄素;H9c2细胞;心肌细胞损伤;抗凋亡作用;核因子κB信号通路
ABSTRACT OBJECTIVE: To investigate the anti-apoptotic effect of curcumin on H2O2-induced H9c2 cardiomyocyte injury and the regulation of NF-κB signaling pathway. METHODS: H9c2 cardiomyocyte were randomly divided into normal control group, injury model group, curcumin low-dose, medium-dose and high-dose groups (25, 50, 100 μmol/L). Normal control group didnt received any intervention. The cells in injury model group were induced with 50 μmol/L H2O2 for 12 h to establish the injury model. The cells in curcumin groups were treated with relevant concentration of drugs for 24 h, and then induced with 50 μmol/L H2O2 for 12 h. After cultured for 24 h, survival rate and apoptotic rate of cells were measured by MTT method and TUNEL method; SOD activity and MDA content were determined by WTS-8 assay and color test; relative fluorescence intensity of LC3 positive expression was detected by immunofluorescence method; mRNA expression of NF-κB p65 in cells was detected by real-time PCR; Western blotting assay was used to detect the protein expression of NF-κB p65 and p-NF-κB p65 in cells. RESULTS: Compared with normal control group, survival rate and SOD activity were decreased significantly in injury model group, while apoptotic rate, MDA content, relative fluorescence intensity of LC3 positive expression, mRNA expression of NF-κB, protein expression of NF-κB p65 and p-NF-κB p65 as well as p-NF-κB/NF-κB were increased significantly (P<0.05). Compared with injury model group, survival rates and SOD activities were increased significantly in curcumin groups, while apoptotic rates, MDA contents, relative fluorescence intensities of LC3 positive expression, mRNA expression of LC3 positive cells, protein expression of NF-κB p65 and p-NF-κB p65 as well as p-NF-κB p65/NF-κB p65 were decreased significantly (P<0.05). CONCLUSIONS: Curcumin can increase the survival rate of H2O2-induced H9c2 cardiomyocyte injury, decrease its apoptotic rate, increase SOD activity and decrease MDA content in cardiomyocytes. Above effects may be related to the regulation of NF-κB signaling pathway.
KEYWORDS Curcumin; H9c2 cells; Cardiomyocyte injury; Anti-apoptotic effect; NF-κB signaling pathway
心血管疾病严重危害人类健康,是目前病死率最高的疾病[1]。心血管疾病发生机制非常复杂,心肌细胞损伤是各种心血管疾病的病理生理学基础[2]。有研究指出,氧化应激可引起心肌细胞凋亡,损伤心肌细胞功能并引发心力衰竭等心血管系统疾病[2]。核因子κB(NF- κB)信号通路是调节体内多种组织细胞损伤及氧化应激状态的重要信号通路。已有研究证实,NF-κB信号通路的异常激活与心肌细胞损伤的发生密切相关[3-4]。姜黄素是从姜科、天南星科植物的根茎中提取得到的化合物,具有抗炎、抗氧化应激等多种药理作用[5]。近年来研究表明,该化合物对心肌细胞损伤具有显著的改善和修复作用[6],但其对受损心肌细胞的保护作用及NF-κB信号通路的影响目前尚未见明确报道。为此,本研究拟初步探讨姜黄素对H2O2致心肌细胞损伤的抗凋亡作用以及其对NF-κB信号通路的调节作用,旨在为该化合物的临床应用及心肌细胞损伤的药理作用研究提供参考依据。
1 材料
1.1 仪器
Gallios型流式细胞仪(美国Beckman Coulter公司);Multiskan FC型酶标仪(美国Thermo Fisher Scientific公司);HERAcell型CO2培养箱、Multiskan Sky型酶标仪[赛默飞世尔科技(中国)有限公司];ECO 48型聚合酶链式反应(PCR)仪(英国PCRmax公司);MP4型垂直电泳仪、ChemiDocTouch型化学发光成像系统(美国Bio-Rad公司);XSP-12CAC型光学显微镜(上海缔伦光学仪器有限公司);TCS SP5型激光扫描共聚焦显微镜(德国Leica公司);QL-9001型振荡器(海门市麒麟医用仪器厂)。
1.2 药品与试剂
姜黄素对照品(成都曼思特生物科技有限公司,批号:20191022,纯度:≥96%);MTT检测试剂盒(北京群晓科苑生物技术有限公司,批号:YS171211A);反转录试剂盒(日本Takara公司,批号:180223CC);反转录聚合酶链反应(RT-PCR)试剂盒(南京威特曼生物技术有限公司,批号:180115001);细胞裂解液(南京碧云天生物技术研究所,批号:180221A);胰酶细胞消化液(批号:C0201)、免疫染色洗涤液(批号:P0106)、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(批号:P0012)、TUNEL细胞凋亡检测试剂盒(批号:C1088)、超氧化物歧化酶(SOD)活性检测试剂盒(WST-8法)(批号:S0101)、丙二醛(MDA)检测试剂盒(批号:S0131S)、NF-κB p65兔单克隆抗体(批号:AF1234)、磷酸化NF-κB p65(p-NF-κB p65)兔單克隆抗体(批号:AF5881)和GAPDH兔单克隆抗体(批号:AF1186)、辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号:A0208)、Alexa Fluor 350标记的山羊抗兔免疫荧光染色试剂盒(含荧光标记的IgG二抗,批号:P0175)、青霉素-链霉素混合溶液(批号:C0222)、二甲亚砜(DMSO,批号:ST038)、胎牛血清(批号:C0227)、封闭液(批号:P0260)、抗荧光猝灭剂(批号:P0126)、TritonX-100试剂(批号:P0096)、TdT酶(批号:D3106)、荧光标记液配制检测液、Trizol试剂(批号:R0016)、RNA酶水(批号:R0022)、Western blotting显色液(批号:P0018M)均购自上海碧云天生物科技有限公司;微管相关蛋白1轻链3(LC3)兔单克隆抗体(武汉三鹰生物技术有限公司,批号:14600-1-AP);DMEM/F12培养基(北京索莱宝科技有限公司,批号:31600);4′,6-二脒基-2-苯基吲哚(DAPI)荧光染料(美国Abcam公司,批号:AF30A5123);上、下游引物均由赛默飞世尔科技(中国)有限公司设计、合成;其余试剂均为分析纯或实验室常用规格,水为双蒸水。
1.3 细胞
大鼠H9c2心肌细胞购自中国科学院上海生科院细胞资源中心,于-80 ℃冻存。
2 方法
2.1 细胞培养与传代
取冻存的H9c2细胞,于37 ℃溶解后转移至10 mL无菌离心管中,加至适量含10%胎牛血清及1%青霉素-链霉素混合溶液的DMEM/F12培养基(以下简称“完全培养基”)中,以800 r/min离心5 min。弃去上清液,细胞加入适量完全培养基重悬后,接种于培养皿中,置于37 ℃、5%CO2恒温培养箱中培养(培养条件下同),定期更换新鲜的完全培养基,待细胞生长融合至70%~80%时进行传代。
2.2 分组、造模与给药
参照文献方法[7],收集对数生长期的H9c2细胞,随机分为正常对照组、损伤模型组[50 μmol/L H2O2(以不含血清和青霉素、链霉素的DMEM/F12培养基稀释)]和姜黄素低、中、高剂量组[25、50、100 μmol/L(以适量DMSO溶解后,再以不含血清和青霉素、链霉素的DMEM/F12培养基稀释);剂量参照本课题组前期预试验结果设置]。其中,正常对照组细胞不作任何干预,常规培养;损伤模型组细胞经50 μmol/L H2O2诱导培养12 h以复制细胞损伤模型;姜黄素各剂量组经相应浓度药物预处理24 h后,再以50 μmol/L H2O2诱导培养12 h。
2.3 细胞存活率的检测
采用MTT法检测。取对数生长期的H9c2细胞,按1×104个/孔接种于96孔板中,按“2.2”项下方法分组、造模、给药,并另设调零组(只加入不含血清和青霉素、链霉素的DMEM/F12培养基,不加细胞悬液),每组设3个复孔。培养24 h后,于避光条件下加入5 mg/mL的MTT溶液20 μL,于培养箱中室温避光孵育4 h后,弃去上清液,然后每孔加入DMSO 150 μL,置于振荡器上振荡5 min。使用酶标仪于490 nm波长处检测各孔的光密度(OD)值并计算细胞存活率:细胞存活率=(试验组细胞平均OD值-调零组细胞平均OD值)/(正常对照组细胞平均OD值-调零组细胞平均OD值)×100%。上述试验重复3次。
2.4 细胞凋亡率的检测
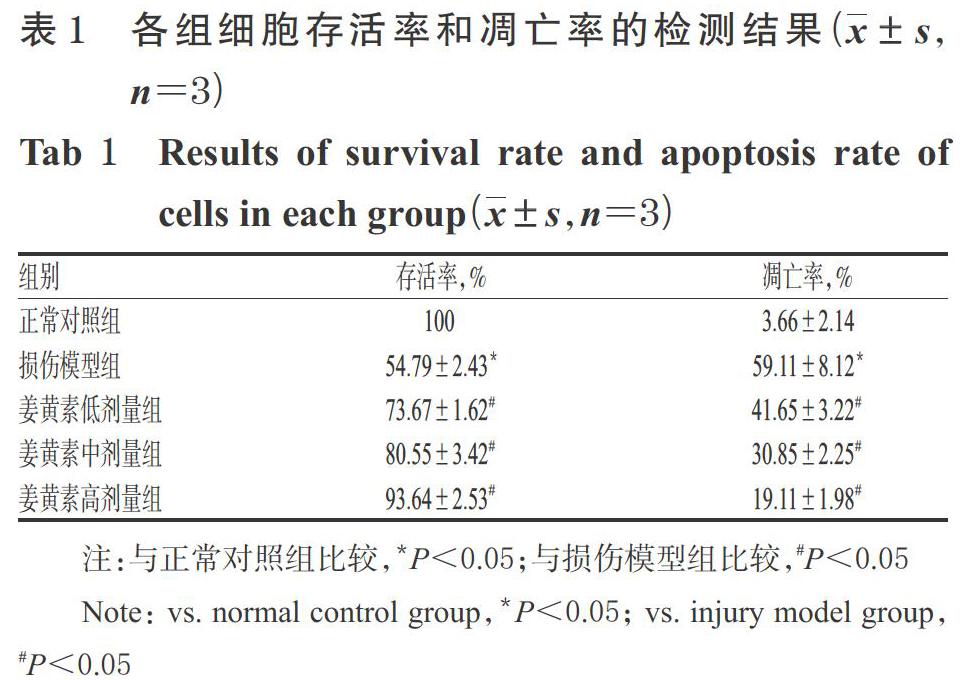
采用TUNEL法检测。取对数期生长的H9c2细胞,按5×104个/孔接种于放有细胞爬片的6孔板中,按“2.2”项下方法分组、造模、给药,每组设3个复孔。培养24 h后,取出细胞爬片,用磷酸盐缓冲液(PBS,pH 7.4)清洗2次后,置于4%多聚甲醛溶液中于室温固定30 min;用PBS清洗2次,用含0.3%TritonX-100试剂的PBS室温孵育5 min;每孔加入TdT酶5 μL和荧光标记液配制检测液45 μL,于37 ℃避光孵育1 h,滴加DAPI荧光染料避光孵育5 min;用PBST溶液清洗5 min×4次以除去多余的染料,再以PBS清洗3次,经中性树脂封片。采用激光扫描共聚焦显微镜对树脂片进行成像分析,对TUNEL阳性细胞(即镜下细胞核呈绿色荧光的凋亡细胞)进行计数并计算细胞凋亡率。上述试验重复3次。
2.5 细胞中SOD活性及MDA含量的检测
取对数生长期的H9c2细胞,按5×105个/孔接种于6孔板中,按“2.2”项下方法分组、造模、给药,每组设3个复孔。培养24 h后,收集细胞并加入细胞裂解液适量,于冰上裂解30 min后,于4 ℃下以12 000 r/min离心15 min,取上清液。经BCA法测定蛋白浓度后,分别按WTS-8法和显色法以酶标仪检测SOD活性和MDA含量,严格按照相应试剂盒说明书操作。上述试验重复3次。
2.6 细胞中LC3阳性表达相对荧光强度的检测
采用免疫荧光法检测。取对数期生长的H9c2细胞,按5×104个/孔接种于放有细胞爬片的6孔板中,按“2.2”项下方法分组、造模、给药,每组设3个复孔。培养24 h后,取出细胞爬片,于4%多聚甲醛溶液中固定15 min,用PBS清洗5 min×3次;用封闭液室温封闭60 min,加入LC3一抗(稀释度为1 ∶ 500),于4 ℃孵育过夜;用PBST溶液清洗后,加入Alexa Fluor 350标记的IgG二抗(稀释度为1 ∶ 2 000),室温避光孵育1 h;滴加DAPI荧光染料,避光孵育5 min;用PBST溶液清洗5 min×4次以除去多余的染料,加入抗荧光猝灭剂适量终止反应。使用荧光显微镜观察并拍照,采用Image J 1.6.0软件分析试验组与正常对照组阳性细胞的相对荧光强度(LC3表达阳性的细胞染色后呈绿色荧光)。上述试验重复6次。
2.7 细胞中NF-κB p65 mRNA表达水平的检测
采用实时定量PCR法检测。取对数期生长的H9c2细胞,按1×106个/孔接种于6孔板中,按“2.2”项下方法分组、造模、给药,每组设5个复孔。培养24 h后,收集细胞至1.5 mL离心管中,加入Trizol试剂1 mL,静置30 min,加入氯仿适量(约为离心管中试剂总体积的1/5),涡旋振荡15 s后,以12 000 r/min离心15 min。取上清液,加入等体积异丙醇,上下颠倒混匀后冰浴10 min;以12 000 r/min离心10 min,弃去上清液,沉淀加入70%乙醇1 mL,混匀;以12 000 r/min离心5 min,弃去上清液,沉淀风干后加入无RNA酶水溶解,按反转录试剂盒说明书操作,将RNA反转录为cDNA,再按RT-PCR试剂盒说明书操作进行PCR扩增。扩增体系(共100 ?L):10×扩增缓冲液10 ?L,4×dNTPs 8 ?L,上、下游引物各1 ?L,模板cDNA 1 ?L,Taq DNA聚合酶 1 ?L,加水至100 ?L。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,共30個循环;72 ℃再延伸10 min。NF-κB p65上游引物为5′-GCTCTCTGCTCCTCCCTGTTCT-3′,下游引物为5′-GCCAAATCCGTTCACACCGACCT-3′,产物长度为79 bp;β-actin上游引物为5′-TGGAGTCGGATAACTGCTCAGGAG-3′,下游引物为5′-AGACTGGAGTTCACCTGTGGATGG-3′,产物长度为102 bp。采用Applied Biosystems 7500 2.0.6荧光分析软件进行分析,以β-actin为内参,按2-ΔΔCt法计算NF-κB p65 mRNA的表达水平。上述试验重复3次。
2.8 细胞中NF-κB p65、p-NF-κB p65蛋白表达水平的检测
采用Western blotting法检测。取对数生长期的H9c2细胞,按1×104个/孔接种于6孔板中,按“2.2”项下方法分组、造模、给药,每组设3个复孔。培养24 h后,收集细胞,加入裂解液提取总蛋白,采用BCA法测定蛋白浓度。取蛋白50 μg,于100 ℃变性5 min后,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,再转移至PVDF膜上,用封闭液室温封闭1 h;加入NF-κB p65、p-NF-κB p65、GAPDH一抗(稀释度均为1 ∶ 500),4 ℃孵育过夜;用PBST溶液清洗后,加入HRP标记的二抗(稀释度为 1 ∶ 2 000),室温孵育1 h;用PBST溶液清洗后,以显色液显影。利用化学发光成像系统成像并使用Image J 1.6.0软件分析,以目标蛋白与内参(GAPDH)的灰度值比值表示目标蛋白的表达水平,以p-NF-κB p65与NF-κB p65蛋白的灰度值比值表示NF-κB p65的磷酸化水平。上述试验重复3次。
2.9 统计学方法
采用SPSS 19.0软件对数据进行统计分析,采用Graphpadprism 5软件作图。计量资料以x±s表示,多组间数据比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
3 结果
3.1 各组细胞存活率和凋亡率比较
与正常对照组比较,损伤模型组中TUNEL阳性细胞数明显增多,细胞存活率显著降低,而凋亡率显著升高(P<0.05);与损伤模型组比较,姜黄素各剂量组中TUNEL阳性细胞数明显减少,细胞存活率均显著升高,而凋亡率均显著降低(P<0.05),且随着姜黄素剂量的增加,有细胞存活率逐渐升高、凋亡率逐渐降低的趋势。各组细胞存活率和凋亡率的检测结果见表1,TUNEL法显微图见图1(图中,DAPI标记细胞核,TUNEL表示凋亡阳性细胞,Merge表示两者叠加)。
3.2 各组细胞中SOD活性和MDA含量比较
与正常对照组比较,损伤模型组细胞中SOD活性显著降低,而MDA含量显著升高(P<0.05);与损伤模型组比较,姜黄素各剂量组细胞中SOD活性显著升高,而MDA含量显著降低(P<0.05),且随着姜黄素剂量的增加,有细胞中SOD活性逐渐升高、MDA含量逐渐降低的趋势。各组细胞中SOD活性和MDA含量的检测结果见表2。
3.3 各组细胞中LC3阳性表达相对荧光强度比较
与正常对照组比较,损伤模型组细胞中LC3阳性表达明显增多,其相对荧光强度显著升高(P<0.05);与损伤模型组比较,姜黄素各剂量组细胞中LC3阳性表达有所减少,其相对荧光强度均显著降低(P<0.05),且随着姜黄素剂量的增加,LC3阳性表达相对荧光强度有逐渐减弱的趋势。各组细胞中LC3阳性表达相对荧光强度的检测结果见表3、图2(图中,DAPI标记细胞核,LC3表示LC3阳性表达细胞,Merge为两者叠加)。
3.4 各组细胞中NF-κB p65 mRNA以及NF-κB p65、p-NF-κB p65蛋白的表达水平比较
与正常对照组比较,损伤模型组细胞中NF-κB p65 mRNA和NF-κB p65、p-NF-κB p65蛋白的表達水平以及p-NF-κB p65/NF-κB p65比值均显著升高(P<0.05);与损伤模型组比较,姜黄素各剂量组细胞中上述指标的表达水平以及p-NF-κB p65/NF-κB p65比值均显著降低(P<0.05),且随着姜黄素剂量的增加,上述指标水平均有逐渐降低的趋势。各组细胞中NF-κB p65 mRNA和NF-κB p65、p-NF-κB p65蛋白表达水平的检测结果见表3,蛋白表达的电泳图见图3。
4 讨论
随着心血管疾病发病率的逐年升高,心肌细胞损伤与冠心病、心力衰竭、高血压等多种心血管疾病的关系逐渐成为研究热点。有研究指出,长期的氧化损伤状态会导致心肌组织细胞大量死亡,若不及时干预,可能会导致心肌功能丧失,引发心力衰竭等疾病;同时,心肌细胞的大量凋亡会释放多种炎症介质,可进一步加重心肌组织的氧化应激损伤[8]。此外,心肌功能异常可能会导致脑等多个组织、器官发生供血不足,进而引起其缺血性损伤,导致患者病死率升高[8]。
姜黄素是从姜科植物郁金Curcuma aromatica Salisb.的块根、姜黄C. longa L.的根茎、莪术C. zedoaria (Berg.) Rosc.的根茎和天南星科植物菖蒲Acorus calamus L.的根茎中提取分离得到的单体化合物[5]。现代药理研究表明,姜黄素具有抗炎、抗氧化、调脂、抗病毒、抗感染、抗肿瘤、抗凝、抗肝纤维化、抗动脉粥样硬化等多种药理作用[6,9]。近年来研究报道,姜黄素对脓毒症、心肌缺血再灌注损伤、氧化应激损伤等多种原因引起的心肌细胞损伤有明显的改善作用[10-12],提示姜黄素对心肌细胞损伤的药理作用及机制值得进一步深入探讨。
H2O2诱导的心肌细胞氧化损伤是目前实验室常用的一种心肌细胞损伤造模方法。H2O2作为易穿透细胞膜的活性氧成分,由于其性质稳定且易得,是细胞损伤模型常用的诱导剂[13]。H2O2诱导的损伤模型是研究体外细胞损伤最常用的模型,可最大程度地模拟体内细胞损伤的病理生理过程[14]。本研究选用来源于胚胎期大鼠心脏组织的H9c2细胞作为研究对象,探讨姜黄素对H2O2致心肌细胞损伤的抗凋亡作用。SOD活性和MDA含量可反映细胞氧化损伤水平及对氧化应激的自我调节能力,SOD活性降低、MDA含量升高,则表示心肌细胞自我修复能力降低[15]。本研究结果表明,与正常对照组比较,损伤模型组细胞存活率和SOD活性均显著降低,细胞凋亡率和MDA含量均显著升高;与损伤模型组比较,姜黄素各剂量组细胞存活率和SOD活性均显著升高,细胞凋亡率和MDA含量均显著降低。这提示姜黄素能够改善H9c2细胞氧化应激损伤,抑制细胞凋亡,提高其存活率。
有研究指出,细胞自噬与细胞凋亡之间存有复杂的交互调控关系,自噬作为一种程序性细胞死亡模式,也参与了心肌细胞损伤的发生、发展[16]。在正常的生理状态下,细胞维持低自噬状态和内环境稳态,自噬增强会导致内环境紊乱并促使细胞死亡,而细胞自噬主要依赖于自噬相关基因编码的蛋白调控[17]。LC3是自噬膜表面标记分子,其水平的改变能在一定程度上反映细胞的自噬状态及水平[16-17]。本研究结果表明,与正常对照组比较,损伤模型组细胞中LC3阳性表达的相对荧光强度显著升高;与损伤模型组比较,姜黄素各剂量组细胞中LC3阳性表达的相对荧光强度显著降低,并有一定的剂量依赖趋势。这提示H2O2诱导的心肌细胞凋亡可能与细胞自噬密切相关;姜黄素能够抑制这种自噬,进而减少细胞的凋亡。
NF-κB信号通路存在于哺乳动物体内的多种组织细胞中,能够选择性地与B细胞κ轻链增强子结合,进而调控与炎症反应和免疫应答相关基因的表达[18]。NF-κB信号通路的激活与细胞外多种信号因子的变化有关,而细胞外信号因子则与细胞膜上的受体结合,开启了一连串下游的反应,即在细胞因子、辐射、重金属、病毒等多种外界因子的刺激下,NF-κB信号通路会被激活,进而调控其上下游相关细胞通路及蛋白的表达[19]。然而,NF-κB信号通路的错误调节会引发自身免疫性疾病、慢性炎症等的发生,如系统性红斑狼疮和膝骨关节炎滑膜炎的发生机制就与NF-κB信号通路激活及相关蛋白水平异常升高有关[20-21]。NF-κB信号通路的异常激活与心肌细胞损伤的发病机制密切相关,例如韩笑等[22]的研究表明,缺血再灌注损伤模型大鼠心肌NF-κB信号通路被激活,加重了大鼠心肌组织的炎症反应及病理损伤,而抑制NF-κB信号通路的激活则能减轻其心肌细胞的损伤;宋光兰等[23]报道了花旗松素能通过抑制NF-κB信号通路来改善缺氧复氧诱导的H9c2心肌细胞损伤。由此可见,NF-κB信号通路在心肌细胞损伤的发生、发展中扮演着重要角色。有研究指出,NF-κB p65 mRNA和NF-κB p65、p-NF-κB p65蛋白的表达水平均能够直接反映NF-κB信号通路的表达状态,p-NF-κB p65/NF-κB p65比值则能够表示NF-κB p65的磷酸化水平,上述指标的异常升高均能直接反映出NF-κB信号通路的异常激活[24]。本研究结果表明,与正常对照组比较,损伤模型组细胞中NF-κB p65 mRNA和NF-κB p65、p-NF-κB p65蛋白的表达水平以及p-NF-κB p65/NF-κB p65比值均显著升高;与损伤模型组比较,姜黄素各剂量组上述指标均显著降低。这表明姜黄素改善H2O2致心肌细胞损伤的机制可能与调节NF-κB信号通路密切相关。
综上所述,姜黄素能够提高H2O2致损伤H9c2心肌细胞的存活率,降低其凋亡率,并提高SOD活性、降低MDA含量,其作用机制可能与调节心肌细胞NF-κB信号通路有关。目前,临床上还没有疗效及机制确切的用于治疗心肌细胞损伤的NF-κB信号通路抑制剂,故本研究暂未设置阳性对照组。同时,由于研究时间及资金有限,本研究未能考察姜黄素对H9c2心肌细胞NF-κB信号通路上下游其他相关蛋白及基因表达水平的影响,故在未来的研究中将对姜黄素靶向调节NF-κB通路相关蛋白表达的作用进行深入研究。
参考文献
[ 1 ] RIZZA S,ROSSINI V,CARDELLINI M,et al. Diabetes influences cancer risk in patients with increased carotid atherosclerosis burden[J]. Nutr Metab Cardiovasc Dis,2020,30(4):652-655.
[ 2 ] KOBAYASHI S,ZHAO F,KOBAYASHI T,et al. Hyperglycemia-induced cardiomyocyte death is mediated by lysosomal membrane injury and aberrant expression of cathepsin D[J]. Biochem Biophys Res Commun,2020,523(1):239-245.
[ 3 ] LIANG S,NIAN Z,SHI K. Inhibition of RIPK1/RIPK3 ameliorates osteoclastogenesis through regulating NLRP3- dependent NF-κB and MAPKs signaling pathways[J]. Biochem Biophys Res Commun,2020,526(4):1028-1035.
[ 4 ] WANG H,JIANG F,LIU W,et al. miR-595 suppresses cell proliferation and metastasis in hepatocellular carcinoma by inhibiting NF-κB signalling pathway[J]. Pathol Res Pract,2020. DOI:10.1016/j.prp.2020.152899.
[ 5 ] LEE JE,YOON SS,LEE JW,et al. Curcumin-induced cell death depends on the level of autophagic flux in A172 and U87MG human glioblastoma cells[J]. Chin J Nat Med,2020,18(2):114-122.
[ 6 ] 劉颖,于莹,张新萍,等.姜黄素对大鼠脓毒症心肌损伤线粒体基因及高迁移率族蛋白B1的影响研究[J].中华急诊医学杂志,2019,28(9):1100-1105.
[ 7 ] 孙慧娟,董玲,王嘉馨,等.黑果枸杞对H2O2诱导的H9c2心肌细胞氧化应激损伤的保护作用研究[J].北京中医药大学学报,2018,41(4):301-305.
[ 8 ] ZHOU QL,TENG F,ZHANG YS,et al. Fpr1 gene silen- cing suppresses cardiomyocyte apoptosis and ventricular remodeling in rats with ischemia/reperfusion injury through the inhibition of MAPK signaling pathway[J]. Exp Cell Res,2018. DOI:10.1016/j.yexcr.2018.07.016.
[ 9 ] 王欠欠.姜黄素及其衍生物对糖尿病及其并发症的作用及机制研究概况[J].中医药临床杂志,2018,30(8):1379-1385.
[10] 王日军,郭彦青,王敬萍.姜黄素对心肌缺血再灌注损伤大鼠糖代谢的影响[J].中国基层医药,2019,26(2):211-213.
[11] 陈雨,林振宇,谷阳,等.姜黄素对大鼠心肌缺血再灌注损伤的心肌保护作用[J].临床和实验医学杂志,2018,17(22):2374-2378.
[12] 伍龙玫,刘春艳.姜黄素对H2O2诱导H9c2心肌细胞氧化应激损伤的保护作用[J].国际中医中药杂志,2019,41(1):57-61.
[13] XIE J,POTTER A,XIE W,et al. Evaluation of a dithiocarbamate derivative as a model of thiol oxidative stress in H9c2 rat cardiomyocytes[J]. Free Radic Biol Med,2014. DOI:10.1016/j.freeradbiomed.2014.02.022.
[14] SUN G,NING Y,DAI D,et al. The protective role of the TOPK/PBK pathway in myocardial ischemia/reperfusion and H2O2-induced injury in H9c2 cardiomyocytes[J]. Int J Mol Sci,2016. DOI:10.3390/ijms17030267.
[15] LI F,GUO S,WANG H,et al. Yiqi huoxue decoction attenuates ischemia/hypoxia-induced oxidative stress injury in H9c2 cardiomyocytes[J]. J Tradit Chin Med Sci,2018,5(3):271-282.
[16] GUO W,JIN J,PAN J,et al. The change of nuclear LC3 distribution in acute myeloid leukemia cells[J]. Exp Cell Res,2018. DOI:10.1016/j.yexcr.2018.05.007.
[17] LIANG S,FIGTREE G,AIQUN M,et al. GAPDH-knockdown reduce rotenone-induced H9c2 cells death via autophagy and anti-oxidative stress pathway[J]. Toxicol Lett,2015,234(3):162-171.
[18] LIU Q,LIU Z,ZHOU LJ,et al. The long noncoding RNA NKILA protects against myocardial ischaemic injury by enhancing myocardin expression via suppressing the NF- κB signalling pathway[J]. Exp Cell Res,2020. DOI:10. 1011/j.yexcr.111774.
[19] 林潼,石礎硕,孙治中,等.基于Cav-1/NF-κB通路探讨调脾护心方抗动脉粥样硬化的作用机制[J].中国药房,2019,30(2):165-169.
[20] 陈海莲,杨晓娥.系统性红斑狼疮患者外周血单个核细胞Toll样受体9和核因子-κB水平的测定及其临床意义[J].中国现代医学杂志,2016,26(11):63-67.
[21] 张栋,王庆甫,张晓哲,等. β-catenin与NF-κB信号通路在膝骨关节炎滑膜炎症中的表达特点及意义[J].中国骨伤,2019,32(8):721-726.
[22] 韩笑,郭浩,杨斌,等.丹红滴丸抑制缺血再灌注损伤大鼠心肌NF-κB活化减轻炎症保护心肌[J].贵州中医药大学学报,2020,42(1):27-32.
[23] 宋光兰,陈俊,鲜文.花旗松素通过抑制NF-κB信号通路对缺氧复氧诱导H9c2心肌细胞损伤的保护作用[J].临床和实验医学杂志,2020,19(1):54-58.
[24] BALKA KR,LOUIS C,SAUNDERS TL,et al. TBK1 and IKKε act redundantly to mediate STING-induced NF-κB responses in myeloid cells[J]. Cell Rep,2020. DOI:10. 1016/j.celrep.2020.03.056.
(收稿日期:2020-05-21 修回日期:2020-09-28)
(编辑:张元媛)
