太阳能消毒与植物根际促生菌(PGPR)联合对黄瓜根腐病的防治效果
2020-12-28贺字典苏长青高云飞
贺字典 苏长青 高云飞


摘要 为明确太阳能土壤消毒与植物根际促生菌(PGPR)联合对黄瓜根腐病防治效果,在对温室进行太阳能土壤消毒之后,采用蘸根和灌根的方式测定了解磷、抑菌效果较好的3个菌株JPG-5、LWG-5和YB-4对黄瓜根腐病的田间防治效果及其对黄瓜根围养分的影响。结果表明:1)YB-4 300倍蘸根对黄瓜根腐病防治效果最高,病指防效为8949%,显著高于LWG-5 300倍和JPG-5 500倍的防治效果。2)LWG-5 500倍灌根对黄瓜根腐病防治效果最高,为89.47%,显著高于LWG-5 800倍和JPG-5 500倍防治效果。3)不管是灌根还是蘸根,JPG-5 500倍和YB-4 300倍均能显著提高黄瓜根围有效磷含量,分别为99.68、86.81 mg/kg和84.30、86.56 mg/kg。因此,PGPR菌株在田间促进养分转化效果和对根腐病的防治效果综合评判,用YB-4 300倍蘸根、JPG-5 500倍灌根和LWG-5 500倍灌根效果较好。
关键词 太阳能消毒; 植物根际促生菌; 黄瓜根腐病; 速效养分; 联合防治效果
中图分类号: S 432.41
文献标识码: B
DOI: 10.16688/j.zwbh.2019515
Abstract To clear the effect of soil solarization combined with plant growth promoting rhizobacteria(PGPR)on cucumber root rot, field control efficacy and the influence on available nutrients in cucumber rhizosphere soil of three strains JPG-5, LWG-5 and YB-4, which could both antagonize Fusarium solani f.sp. cucurbitae and dissolve insoluble phosphorus, were determined by cucumber root dipping and root drenching after soil solarization in the greenhouse. The results showed that the control efficacy of YB-4 300 times solution was 89.49%, significantly higher than that of LWG-5 300 times solution and JPG-5 500 times solution by root dipping. LWG-5 500 times solution by root drenching had the highest control effect, with the efficacy of 89.47%, significantly higher than that of LWG-5 800 times solution and JPG-5 500 times solution by root drenching. The content of available phosphorus in cucumber rhizosphere all increased significantly with JPG-5 500 times solution and YB-4 300 times solution by root dipping or root drenching, which were 99.68 and 86.81 mg/kg or 84.30 and 86.56 mg/kg, respectively. Therefore, based on the effect of PGPR strain on promoting nutrient transformation and controlling root rot in the field, it could be concluded that YB-4 300 times solution by root dipping, JPG-5 500 times solution by root drenching and LWG-5 500 times solution by root drenching had better effect.
Key words solarization; plant rhizosphere promoting bacteria(PGPR); cucumber root rot; available nutrient; combined control effect
黃瓜根腐病病原菌种类多样,甜瓜疫霉Phytophthora melonis是天津市区及郊区黄瓜根腐病的致病菌,而尖镰孢Fusarium oxysporum和茄腐镰孢F.solani可能加重该病的发生[1]。陈志杰等[2]认为陕北地区黄瓜根腐病病原菌为甜瓜疫霉P.melonis,关中地区则为尖镰孢F.oxysporum。刘心刚等[3]报道西藏设施西(黄)瓜根腐病原菌为茄腐镰孢F.solani。刘洋等[4]报道辽宁、山东、内蒙古等地嫁接黄瓜根腐病病原菌为茄腐镰孢瓜类专化型Fusarium solani f.sp. cucurbitae。对黄瓜根腐病的防治目前主要是用氰氨化钙、威百亩、辣根素、氯化苦等药物进行土壤消毒。这些土壤消毒剂在杀灭包括病原菌在内的有害生物的同时也会将土壤中的有益菌杀死,造成土壤真空状态[5]。生态控制技术既能控制病害发生,又能保护土壤生态平衡健康发展,是防治土传病害的一项重要措施。太阳能消毒结合生物降解塑料薄膜技术一方面可以防治由尖镰孢番茄专化型F.oxysporum f.sp. lycopersici引起的番茄枯萎病和小核盘菌Sclerotinia minor引起的菌核病,同时还可促进土壤微生物繁殖[6]。太阳能消毒结合生防菌灰绿链霉菌Streptomyces griseoviridis可防治由F.oxysporum f.sp. radicis-lycopersici引起的番茄根腐病[7]。植物根际促生菌(plant growth promoting rhizobacteria,PGPR)是根系周围土壤中的一群自生细菌,其中嗜麦芽寡养单胞菌和枯草芽胞杆菌复配组成的种衣剂对黄瓜细菌性茎软腐病的田间防治效果达到61.20%[8]。但太阳能消毒与PGPR结合防治黄瓜根腐病的研究并未见到相关报道。本文以黄瓜根腐病主要病原菌——茄腐镰孢F.solani为靶标菌,筛选出防治效果好的PGPR后,在太阳能消毒的基础上,根施PGPR,测定二者结合对黄瓜根腐病的田间防治效果及对黄瓜根围速效养分的影响。
1 材料与方法
1.1 材料
供试病原菌:茄腐镰孢瓜类专化型F.solani f.sp. cucurbitae。
供试PGPR菌株:PGPR菌来源于黄瓜根围,共32株。其中JPG-5、LWG-5和YB-4由本实验室分离鉴定为嗜麦芽寡养单胞菌Stenotrophomonas maltophilia、短短芽胞杆菌Brevibacillus brevis和甲基营养型芽胞杆菌Bacillus methylotrophicus。对照化学药剂:2.5%咯菌腈悬浮剂(SC)和62.5%精甲·咯菌腈悬浮种衣剂(FSC)。供试黄瓜品种:‘田骄7号。
供试培养基:1)DF培养基:KH2PO4 4.0 g,Na2HPO4 6.0 g,MgSO4·7H2O0.2 g,葡萄糖2.0 g,葡萄糖酸2.0 g,柠檬酸2.0 g,(NH4)2SO4 2.0 g作为唯一氮源,微量元素包含FeSO4·7H2O 1.0 mg,H3BO3 10 μg,MnSO4·H2O 11.19 μg,ZnSO4·7H2O 124.6 μg,CuSO4·5H2O 78.22 μg,MoO3 10 μg,pH 7.2,蒸馏水1 000 mL;以3.0 mmol/L ACC代替DF培养基中的(NH4)2SO4为唯一氮源后为ADF培养基。2)牛肉膏蛋白胨固体培养基(NA):牛肉膏3 g、酵母膏1 g、蛋白胨5 g、葡萄糖10 g、琼脂15 g、蒸馏水1 000 mL、pH 7.0~7.2,121℃湿热灭菌30 min,不加琼脂即为NB。3)马铃薯葡萄糖琼脂(PDA):马铃薯 200 g、葡萄糖 15~18 g、琼脂15 g、蒸馏水1 000 mL、pH自然,121℃湿热灭菌30 min。4)无机磷培养基:(NH4)2SO4 0.5 g,MgSO4·7H2O 0.3 g,KCl 0.3 g,NaCl 0.3 g,Ca3(PO4)2 5 g,葡萄糖10 g,MnSO4·H2O0.3 g,FeSO4·7H2O0.3 g,琼脂20 g,蒸馏水1 000 mL,pH 7.2。
1.2 方法
1.2.1 茄腐镰孢和PGPR活化与培养
将茄腐镰孢和32株PGPR分别转接到PDA上培养7 d和ADF上培养48 h,备用。分别用接种环蘸取PGPR接种于装有150 mL NB的300 mL三角瓶中,28℃、126 r/min振荡培养24~36 h后,测定OD650,用无菌水调整OD650为0.8,备用。
1.2.2 PGPR解磷效果及其对茄腐镰孢的抑菌效果测定
采用牛津杯法测定不同PGPR发酵液的解磷效果及其对茄腐镰孢的抑菌效果。将牛津杯置于无机磷固体培养基中央,用移液枪吸取100 μL已制备好的PGPR菌液注入到牛津杯中。28℃恒温培养箱中培养,7 d后十字交叉测量解磷透明圈直径,以空白NB培养基为对照。用打孔器(d =0.5 cm)在茄腐镰孢菌落边缘打菌饼,将菌饼放置于PDA平板的中央。并以病菌为中心,在不同方向以2.5 cm的距离放置3个牛津杯,用移液枪吸取100 μL的PGPR菌液放入牛津杯中,重复3次。以加入2.5%咯菌腈SC 1 000倍液为药剂对照,另设空白培养基对照,28℃恒温培养箱中培养,72 h后测量抑菌圈直径。
抑菌率=对照菌落直径-处理后菌落直径对照菌落直径-菌饼直径×100%。
1.2.3 太阳能土壤消毒与整地
试验在秦皇岛市丰禾农业有限公司温室内进行,选取往年黄瓜根腐病发病较严重的连作地块作为试验田,完全随机区组设计。土壤为黏土,养分含量铵态氮1.56 mg/kg、有效磷64.30 mg/kg、速效钾1.78 mg/kg、硝态氮39.42 mg/kg、有机质12.5 g/kg。上茬黄瓜于7月5日拉秧时调查黄瓜根腐病发病率,将黄瓜秧拉出棚外进行堆沤,将黑色地膜捡拾干净后换上厚度为0.05 mm的白色地膜,拉严棚膜,关闭棚门。太阳能消毒参照文献[9]并略有改动。本试验用太阳能消毒至8月7日。此段时间外界气温平均为28℃。8月3日测定温室气温为67℃,地表温度为45℃。太阳能消毒后施肥、整地。基肥施用粪肥4 m3、史丹利复合肥(18∶18∶18)50 kg。
1.2.4 PGPR对黄瓜根腐病的田间防治效果
将YB-4、JPG-5、LWG-5菌液分别稀释300、500和800倍液单独进行蘸根和灌根。处理1:在黄瓜苗(两叶一心)移栽前一天蘸根,将黄瓜苗在相应浓度的YB-4、JPG-5、LWG-5菌液中蘸10 s,使根系充分接觸菌液,自然风干后次日(8月15日)移栽至9 m×100 m的温室中,行距60 cm,株距20 cm,每畦40株。处理2:在黄瓜浇缓苗水后第2天和开花前进行灌根。在需要灌根处理的黄瓜根系左右两侧5~10 cm处打出直径3 cm、深度10 cm的孔穴,在左右两个孔穴中各缓缓倒入50 mL菌液,使菌液充分渗透到根系周围土壤中。分别设置药剂对照和清水对照。灌根和蘸根的药剂对照分别为62.5%精甲·咯菌腈FSC 500倍液和1 500倍液。各小区随机排列,5次重复,正常管理。
待拔秧前(12月18日)每个小区取10株黄瓜植株,用铁锹挖出完整根系,测量黄瓜根系变色程度,根据黄瓜根腐病分级标准计算病情指数。同时每个小区均调查黄瓜根腐病死亡数,计算死亡率。
黄瓜根腐病分级标准[10]:0级,茎基部和主根上无病斑;1级,茎基部和主根上有少量病斑,病斑面积在1/4以下;2级,茎基部和主根上病斑面积占茎基部和主根总面积的1/4~1/2;3级,茎基部和主根上病斑面积占茎基部和主根总面积的1/2以上~3/4;4级,茎基部和主根上病斑连片,形成绕茎现象,但根系并未坏死;5级,根系坏死,地上部萎蔫或死亡。
死亡率=死亡植株总数/调查总株数×100%;
防治效果=(对照组死亡率-处理组死亡率)/对照组死亡率×100%;
病情指数=∑(各级病株数×代表级值)/(调查总株数×最高病级代表值)×100;
防治效果=(对照组病情指数-处理组病情指数)/对照组病情指数×100%。
1.2.5 对黄瓜根围土壤养分的影响
PGPR蘸根和灌根后15 d采集距离黄瓜根系周围5 cm耕作层土壤,每小区随机取5点土样,混合后装入无菌自封袋中,带回实验室测定土壤养分含量。土壤碱解氮(包括硝态氮和铵态氮)测定参照李酉开碱解扩散法进行样品的处理与测定[11]。土壤有效磷和速效钾采用钼锑抗比色法测定[12]。
1.3 数据处理
采用Microsoft Excel 2010和SAS 9.1.3软件对数据进行统计分析,采用单因素方差分析、LSD法进行差异显著性检验。
2 结果与分析
2.1 PGPR对茄腐镰孢的抑菌效果
32株PGPR中有8株对黄瓜根腐病菌抑菌率高于60%。其中,CRG-2、JPG-5和YB-2对黄瓜根腐病菌抑菌率最高,均为78.82%。其次是CRG-8和YB-4,对黄瓜根腐病菌抑菌率均为71.67%(表1)。
2.2 PGPR解磷效果
能够降解难溶性磷的PGPR菌株中,解磷透明圈直径在1.37~2.45 cm之间,其中YB-4的解磷圈直径最大,为2.45 cm。其次是LWG-5,解磷圈直径为2.33 cm (表2)。综合解磷透明圈大小和对黄瓜根腐病菌抑菌率高低选择了3株PGPR,分别为YB-4、LWG-5和JPG-5。
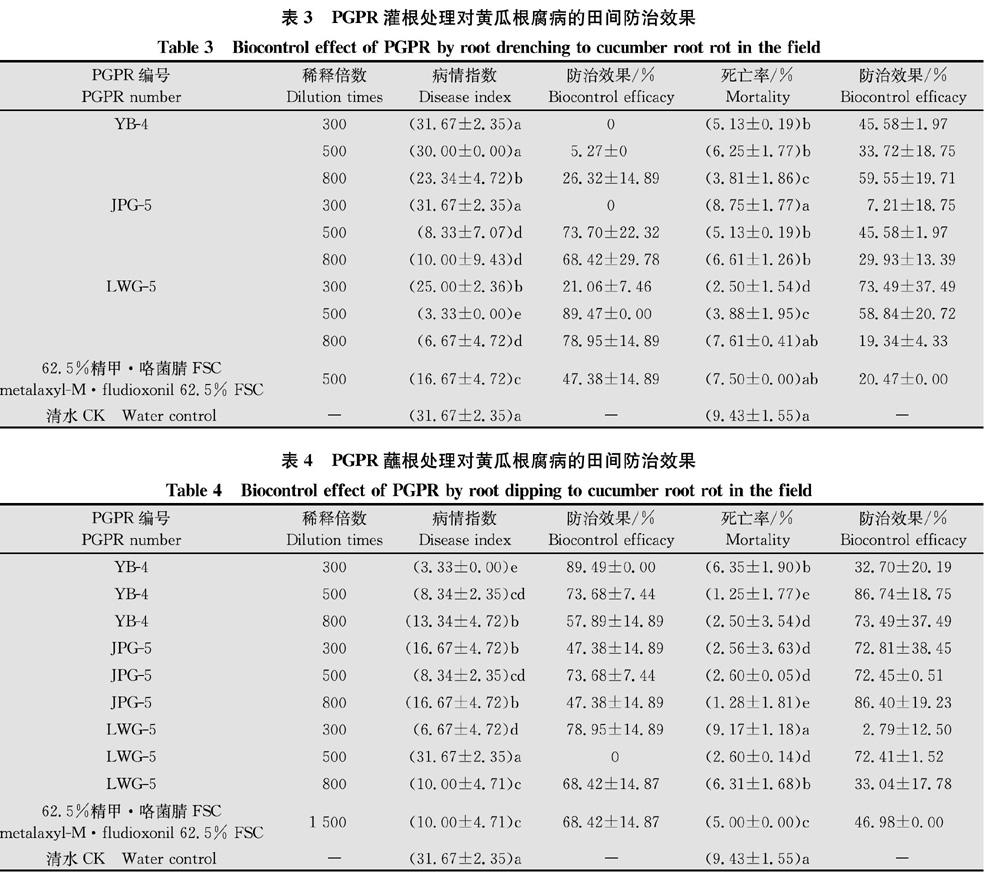
2.3 PGPR对黄瓜根腐病的田间防治效果
2.3.1 PGPR灌根对黄瓜根腐病田间防治效果
用PGPR灌根后,按照病情指数来计算PGPR对黄瓜根腐病的防治效果时,LWG-5稀释500倍液对黄瓜根腐病防治效果最高,为89.47%,其次是LWG-5 800倍液和JPG-5 500倍液,对黄瓜根腐病防治效果分别为78.95%和73.70%,均显著高于62.5%精甲·咯菌腈FSC的防治效果。按照黄瓜死亡率计算时, LWG-5 300倍液对黄瓜根腐病的防治效果最高,防效为73.49%,其次是YB-4 800倍液,防治效果为59.55%,均显著高于62.5%精甲·咯菌腈FSC的防治效果(表3)。
2.3.2 PGPR蘸根对黄瓜根腐病田间防治效果
用PGPR蘸根后按照病情指数来计算PGPR对黄瓜根腐病的防治效果,YB-4 300倍液对黄瓜根腐病防治效果最好,为89.49%,其次LWG-5 300倍液和JPG-5 500倍液,防治效果分别为78.95%和73.68%,均显著高于62.5%精甲·咯菌腈FSC的防治效果。根据黄瓜死亡率计算出的PGPR菌对黄瓜根腐病防治效果最高的是YB-4 500倍液和JPG-5 800倍液,防治效果分别为86.74%和86.40%,均显著高于药剂对照(表4)。
2.4 PGPR对黄瓜根围土壤速效养分的影响
用PGPR蘸根后,黄瓜根围铵态氮含量以施用LWG-5 300倍液和JPG-5 800倍液最高,均为6.77 mg/kg,显著高于其他处理的铵态氮含量。硝态氮含量以62.5%精甲·咯菌腈FSC对照最高,为90.77 mg/kg,其次是JPG-5 500倍液处理,其硝态氮含量为87.65 mg/kg,但二者差异不显著。有效磷含量以JPG-5 500倍液蘸根处理的最高,为99.68 mg/kg,其次是YB-4 300倍液,有效磷含量为84.30 mg/kg,二者差异显著。黄瓜根围速效钾含量以JPG-5 500倍液蘸根处理的最高,为35.48 mg/kg,显著高于YB-4 300倍液处理的速效钾含量。YB-4 300倍液蘸根、JPG-5 500倍液蘸根和药剂对照62.5%精甲·咯菌腈FSC的产量差异不显著,分别为3 82019、3 860.26 kg/667 m2和3 783.03 kg/667 m2。
用PGPR灌根后,黄瓜根围铵态氮含量以施用LWG-5 300倍液最高,为47.90 mg/kg,显著高于其他处理的铵态氮含量。硝态氮含量以62.5%精甲·咯菌腈FSC最高,为128.70 mg/kg,显著高于YB-4 500倍液处理和其他处理的黄瓜根围硝态氮含量。有效磷含量以JPG-5 500液和YB-4 300倍液灌根处理的最高,分别为86.81 mg/kg和8656 mg/kg,二者差异不显著,但显著高于其他处理的有效磷含量。黄瓜根围速效钾含量以LWG-5 300倍液灌根处理的最高,为60.11 mg/kg,显著高于其他处理的速效钾含量。LWG-5 500倍液灌根处理的黄瓜产量最高,为4 226.62 kg/667 m2,其次是JPG-5 500倍液和YB-4 300倍液,黄瓜产量分别为4 150.58 kg/667 m2和4 076.54 kg/667 m2,但三者差异不显著。
对比用PGPR各菌株蘸根和灌根处理后黄瓜根围的速效养分含量、黄瓜产量和对根腐病的防治效果,YB-4 300倍液、JPG-5 500倍液和LWG-5 300倍液处理的效果较好。
3 讨论
根腐病是典型的弱寄生性土传病害,近几年发生越来越严重。一方面病原菌在土壤中存活时间长、存在形式多样,呈逐年累积趋势[13];另一方面土壤因素比较复杂,土壤养分、土壤质地、土壤微生物及动物等多种因素均会影响病原菌的消长、寄主植物抗病能力强弱及二者间互作[14-16]。对于根腐病等土传病害的防治,在夏季高温季节进行太阳能消毒是最经济有效的方法之一。高温在抑制有害生物的同时,也减少了细菌和真菌的丰富度[6-7]。因此在太阳能消毒之后,及时补充有益菌到蔬菜根际土壤中可以弥补其缺陷。PGPR是一类生活在根际周围的有益菌,国内外已发现20多个种属的根际微生物具有防病促生的潜能,主要包括假单胞菌属Pseudomonas、芽胞杆菌属Bacillus、产碱菌属Alcaligenes、节杆菌属Arthrobacter、固氮菌属Aztobacter、肠杆菌属Enterobacter、欧文氏菌属Erwinia、黄杆菌属Flavobacterium、哈夫尼菌属Hafnia、克雷伯氏菌属Klebsiella、沙雷氏菌属Serratia、黄单胞菌属Xanthomonas和慢生根瘤菌属Bradyrhizobium等[17-19]。PGPR主要通過产生1-氨基环丙烷-1-羧酸(ACC)酶、抗生素、分泌铁蛋白来抑制病原菌的侵染[20-21]。还可以通过解磷、固氮、产生植物激素等方式直接刺激和调节植物生长[22-23]。本文筛选到的JPG-5为嗜麦芽寡养单胞菌S.maltophilia、LWG-5为短短芽胞杆菌B.brevis、YB-4为甲基营养型芽胞杆菌B.methylotrophicus。3个菌株在抑制茄腐镰孢的同时,还能降解土壤中的难溶性磷,供给黄瓜生长需要。从经PGPR各菌株蘸根和灌根处理后黄瓜根围的速效养分含量、黄瓜产量和对根腐病的防治效果综合来看,YB-4 300倍液、JPG-5 500倍液和LWG-5 300倍液效果较好。这与Wang等[24]报道的普城沙雷菌Serratia plymuthica、嗜根寡养单胞菌Stenotrophomonas rhizophila,荧光假单胞Pfluorescens和假单胞属的P.extremorientalis在防治黄瓜根腐病同时还可促进黄瓜植株生长一致。但是本文的3个菌株只测定了解磷效果,是否具有固氮作用、解钾作用及其对土壤微生物多样性的影响还需要进一步研究。此外,在试验过程中还发现用PGPR蘸根比灌根更能促进黄瓜根系的生长,黄瓜根系主根长度、数量、侧根数量等明显增多。由于黄瓜根腐病菌是一种土壤习居菌,可以在土壤中逐步积累,要想长期用有益菌PGPR对其起到抑制作用,需要多种施用方法并举。从育苗时育苗基质添加PGPR,移栽前蘸根,到缓苗后,开花前,结果期多次灌根,将黄瓜根系处于PGPR保护之中,才能达到保持黄瓜免受茄腐镰孢或尖镰孢等土传病原菌的侵染,这在利用木霉防治土传病害时已经得到验证[5,25]。但PGPR生防作用与木霉是否相同还有待于进一步研究。
参考文献
[1] 王惠哲. 黄瓜根腐病病原菌的分离鉴定及室内药剂筛选[D]. 保定: 河北农业大学, 2003.
[2] 陈志杰, 张锋, 张淑莲, 等. 陕西温室黄瓜根腐病及流行因素研究[J]. 中国生态农业学报2009, 17(4): 699-703.
[3] 刘心刚, 杨成德, 王振. 西藏设施西(黄)瓜根腐病的分离与鉴定[J]. 甘肃农业大学学报, 2018, 59(2): 82-85.
[4] 刘洋, 李宝聚, 石延霞, 等. 李宝聚博士诊病手记(二十六)引起嫁接黄瓜死秧的病害原因分析[J]. 中国蔬菜, 2010(13): 21-22.
[5] 贺字典, 吴素霞, 宋晓飞, 等. 生防菌与茄病镰刀菌在黄瓜根围动态变化[J]. 中国生物防治学报, 2016,32(3): 357-364.
[6] BONANOMI G, CHIURAZZI M, CAPORASO S, et al. Soil solarization with biodegradable materials and its impact on soil microbial communities [J]. Soil Biology & Biochemistry, 2008,40(8): 1989-1998.
[7] MINUTO A, SPADARO D, GARIBALDI A, et al. Control of soilborne pathogens of tomato using a commercial formulation of Streptomyces griseoviridis and solarization [J]. Crop Protection, 2006,25(5): 468-475.
[8] 賀字典, 闫立英, 石延霞, 等. 产生ACC脱氨酶的PGPR种衣剂对黄瓜细菌性茎软腐病防治效果研究[J]. 中国生物防治学报, 2017, 33(6): 817-825.
[9] 河北省质量技术监督局.DB 13/T 1418-2011,高温闷棚土壤消毒技术规程[S].
[10]张旭丽, 邢宝龙, 王桂梅, 等. 不同药剂对大豆根腐病的防治效果[J]. 山西农业科学, 2015, 43(8): 1006-1009.
[11]李酉开. 论费林溶液与还原糖的反应[J]. 北京农业大学学报, 1984, 10(4): 361-368.
[12]林启美, 陶水龙. 土壤肥料学自学指导及实验指导[M].北京: 中央广播电视大学出版社, 1999.
[13]SCHIPPEKS B, OLD K M. Factors affecting chlamydospore formation by Fusarium solani f.cucurbitae in pure culture [J]. Soil Biology & Biochemistry, 1974, 6(3): 153-160.
[14]FORBES R S, DICKINSON C H. Effects of temperature, pH and nitrogen on cellulolytic activity of Fusarium avenaceum [J]. Transactions of the British Mycological Society, 1977, 68(2): 229-235.
[15]ORITSEJAFOR J J, ADENIJI M O. Influence of host and non-host rhizosphere and organic amendments on survival of Fusarium oxysporum f.sp. elaeidis [J]. Mycological Research, 1990, 94(1): 57-63.
[16]HUBER D M, WATSON R D. Effect of organic amendment on soil-borne plant pathogens [J]. Phytopathology, 1970, 60(1): 22-26.
[17]DILFUZA E, ZULFIYA K, KAKHRAMON D. Bacteria able to control foot and root rot and to promote growth of cucumber in salinated soils [J]. Biology and Fertility of Soils, 2011, 47(2): 197-205.
[18]SUNDARAMOORTHY S, RAGUCHANDER T, RAGUPATHI N, et al. Combinatorial effect of endophytic and plant growth promoting rhizobacteria against wilt disease of Capsicum annum L.caused by Fusarium solani [J]. Biological Control, 2012, 60(1): 59-67.
[19]MNIF I, HAMMAMI I, ALI TRIKI M, et al. Antifungal efficiency of a lipopeptide biosurfactant derived from Bacillus subtilis SPB1 versus the phytopathogenic fungus, Fusarium solani [J]. Environmental Science & Pollution Research, 2015, 22(7): 1-11.
[20]席先梅. 促进植物生长的根围细菌筛选及ACC脱氨基酶基因的克隆[D]. 呼和浩特: 内蒙古农业大学, 2006.
[21]滕松山, 刘艳萍, 赵蕾蕾. 具ACC脱氨酶活性的碱蓬内生细菌的分离、鉴定及其生物学特性[J]. 微生物学报, 2010, 50(11): 1503-1509.
[22]DIXIT R, AGRAWAL L, GUPTA S, et al. Southern blight disease of tomato control by 1-aminocyclo-propane-1-carboxy-late (ACC) deaminase producing Paenibacillus lentimorbus B-30488 [J]. Plant Signaling & Behavior, 2016, 11(2): 1-11.
[23]MUHAMMAD Z H, FAROOQ H M, HUSSAIN M. Bacteria in combination with fertilizers promote root and shoot growth of maize in saline-sodic soil [J]. Brazilian Journal of Microbiology, 2015, 46(1): 97-102.
[24]WANG Chunjuan, YANG Wei, WANG Chao, et al. Induction of drought tolerance in cucumber plants by a consortium of three plant growth-promoting rhizobacterium strains [J/OL]. PLoS ONE, 2012, 7(12): e52565.DOI: 10.1371/journal.pone.0052565.
[25]贺字典, 武春成, 沈江洁, 等. 棘孢木霉菌肥对黄瓜枯萎病的防治效果及对连作黄瓜根际土壤微生物种群的影响[J].植物保护学报,2018,45(3):528-535.
(责任编辑:杨明丽)
