混合菌种发酵大豆饮料
2020-12-26王若瑾王昌禄
王若瑾,王昌禄
(1.华北理工大学 后勤集团总公司,河北 唐山 063210;2.天津科技大学 食品科学与工程学院,天津 300457)
中国是大豆的故乡,豆浆是我国的传统美食,也是一种老少皆宜的营养食品,豆浆含有丰富的植物蛋白,在欧美享有“植物奶”的美誉,另外豆浆中的油脂为不饱和脂肪酸(主要是亚油酸)和卵磷脂,并且不含胆固醇,可起到防止动脉硬化、脑溢血及血栓形成的作用[1]。此外,大豆磷脂中含有85%~90%的磷脂酰胆碱、磷脂酰乙醇胺和磷脂糖甙等,对人体有着良好的保健作用。
大豆通过浸泡、加热、打浆、研磨和过滤后可得到8%左右的固形物,俗称豆乳,其价格低廉且具有较高的营养价值[2]。但豆乳中同时含有大量的抗营养因子,其中抗营养因子主要包括胰蛋白酶抑制因子和尿素酶,它可影响豆乳中营养价值、生物功效和适口性,并可对人体和动物产生较大危害。胰蛋白酶抑制因子的抗营养作用主要表现在抑制胰蛋白酶活性、降低蛋质消化和造成胰腺肿大2个方面。另外,人们食用未经过煮熟的豆乳后,在胃肠道内适宜环境下将人体中的尿素酶激活,使豆乳中部分含氮化合物分解成氨,从而引起机体中氨出现代谢障碍或中毒[3]。因此,通过微生物发酵,将大豆中所含的蛋白质降解成水溶性蛋白及氨基酸,并在保留了大豆原有营养成分的同时,去除了大豆中对人体不利的溶血素、抗胰蛋白酶因素等抗营养成分,使全发酵所得豆制品的营养价值更高,并消除了豆腥味。
白地霉 ( Geotrichumcandidum) 是一种常见真菌,属于半知菌亚门、丛梗孢科、卵形孢霉族、地霉属[4],部分白地霉具有产香的特点,这一特性使得白地霉成为具有应用潜力的工业微生物,在国外广泛应用于乳酪生产[5-7],国内多采用食品工业废弃物来发酵生产白地霉,作为菌体蛋白使用。该项研究拟利用筛选的嗜温乳酸菌及能够产生胞外多糖( exopolysaccharides,EPS)的产香白地霉进行混合发酵,在实验室条件下制备富含胞外多糖的豆乳,确定混合发酵酸乳的生产工艺并对其品质进行评价。
1 材料与方法
1.1 材料
大豆:市售;菌种:乳酸乳球菌乳脂亚种(CGMCC5260)、白地霉(CGMCC5259),本实验室分离菌种,在菌种保藏中心保藏,为已授权菌种;黄原胶、果胶、瓜尔豆胶和CNC-Na均由河南千志商贸公司生产。
1.2 仪器设备
厌氧培养箱为YQS-Ⅱ型,上海新苗医疗器械制造有限公司生产;SP-722可见分光光度计,上海光谱仪器有限公司生产;YXQG02型手提式不锈钢压力蒸气灭菌锅,山东新华医疗器械股份有限公司生产;DK-S26型电热恒温水浴锅,上海桑信实验仪器有限公司生产;磁力搅拌器MS-H280-Pro,天津市政诺仪器仪表有限公司生产。
2 实验方法
2.1 大豆发酵酸乳工艺流程
实验中发酵酸乳工艺为:黄豆→清洗→浸泡→磨浆→过滤→煮制→调配→灭菌→冷却→接种→发酵→后熟→成品。实验工艺参数:发酵温度为30 ℃,后熟时间为4 h。
2.2 混合实验方案
将驯化后的乳酸菌和白地霉与两菌种按照1:1的比例混合,加入到含有8%的灭菌脱脂乳中,在温度为30 ℃,接种量为6%的条件下发酵8 h,后熟12 h。测定EPS的含量并进行感官评价。
2.3 菌种比例对豆乳发酵影响的单因素实验
将驯化后的乳酸菌和白地霉分别按照1:1、1:3、1:2、2:1和3:1的比例混合,加入到含有8%的灭菌脱脂乳中,在温度为30℃,接种量为6%的条件下发酵8 h,后熟12 h。测定EPS的含量并进行感官评价。
2.4 发酵温度对豆乳发酵的影响
将驯化后的乳酸菌和白地霉按照2:1的比例混合,分别在26 ℃、28 ℃、30 ℃、32 ℃和34 ℃下发酵,接种量为6%,发酵8 h,后熟12 h,进行感官评价,并测定EPS的量。
2.5 发酵时间对豆乳发酵的影响
将驯化后的乳酸菌和白地霉按照2:1的比例混合,在6%接种量、30℃条件下分别发酵5 h、6 h、7 h、8 h和9 h,后熟12 h,进行感官评价,并测定EPS含量。
2.6 接种量对豆乳发酵的影响
将驯化后的乳酸菌和白地霉按照2:1的比例混合,分别按2%、4%、6%、8%、10%接种量,在30 ℃下发酵8 h,后熟12 h,对其进行感官评价,并测定其EPS的含量。
2.7 响应面实验
在单因素实验的基础上,选择菌种比例A(乳酸菌/白地霉)、发酵时间B、发酵温度C、接种量D为自变量,以发酵饮料感官评分为响应值,采用响应面分析法,设计四因素三水平实验,其因素水平见表1,以此对大豆酸乳工艺参数进行优化。
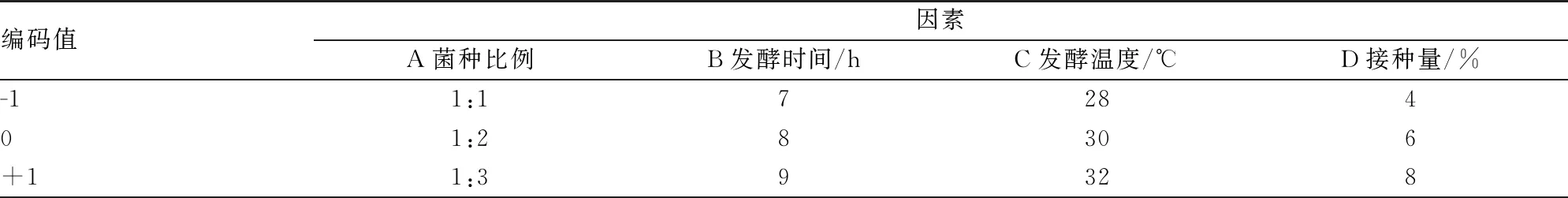
表1 实验因素水平表
2.8 稳定剂对大豆发酵酸乳的影响
2.8.1单一稳定剂对大豆发酵酸乳的影响
将实验中的4 种亲水性胶体黄原胶、瓜尔豆胶、CMC-Na、果胶分别添加到饮料中后,按照工艺条件制得饮料样品,各自静置两周后观察其稳定状态,当饮料静置分层时分别测量其上清液高度,使用上层清液厚度来表示稳定性状态:若不分层,稳定性表现记作0。而其稳定性表现分值越低,代表其稳定剂越好。
2.8.2复合稳定剂对大豆发酵酸乳的影响
在单因素的基础上,选择黄原胶(A)、果胶(B)、CMC-Na(C)为自变量,以离心沉淀率作为响应值,采用响应面分析法,设计三因素三水平实验,因素水平见表2,以此对大豆酸乳稳定剂的工艺参数进行优化。

表2 实验因素水平表
3 实验结果与分析
3.1 单一菌种与混合菌种对大豆发酵酸乳的影响
表3所示为不同菌种发酵后感官评价情况。

表3 不同菌种发酵后感官评价
由表3可知,混合菌种的最后发酵结果的感官评价较好,且其胞外多糖的含量最高。而单一菌种(乳酸菌,白地霉)的口感相对较差,其中白地霉单独的发酵味也比较淡,而乳酸菌乳清析出比较多,组织状态不均匀。
3.2 菌种比例对大豆发酵酸乳的影响
按照标题2.3中的实验方法研究菌种比例对大豆发酵酸乳的影响,其结果如图1所示。

图1 乳酸菌与白地霉添加比例对大豆发酵酸乳的影响
由图1可以看出,当乳酸菌与白地霉的比例为1:2时,胞外多糖的含量为151.3 mg/L,组织状态均匀,口感细腻,人们易于接受,感官评分最高。而当乳酸菌与白地霉的比例为1:3时,胞外多糖产量最高为160.9 mg/L,但发酵乳的发酵味道寡淡。综合考虑,选择乳酸菌与白地霉的比例为1:2。
3.3 发酵温度对大豆发酵酸乳的影响
按照标题2.4中的方法研究不同发酵温度对大豆发酵酸乳的影响,其结果如图2所示。
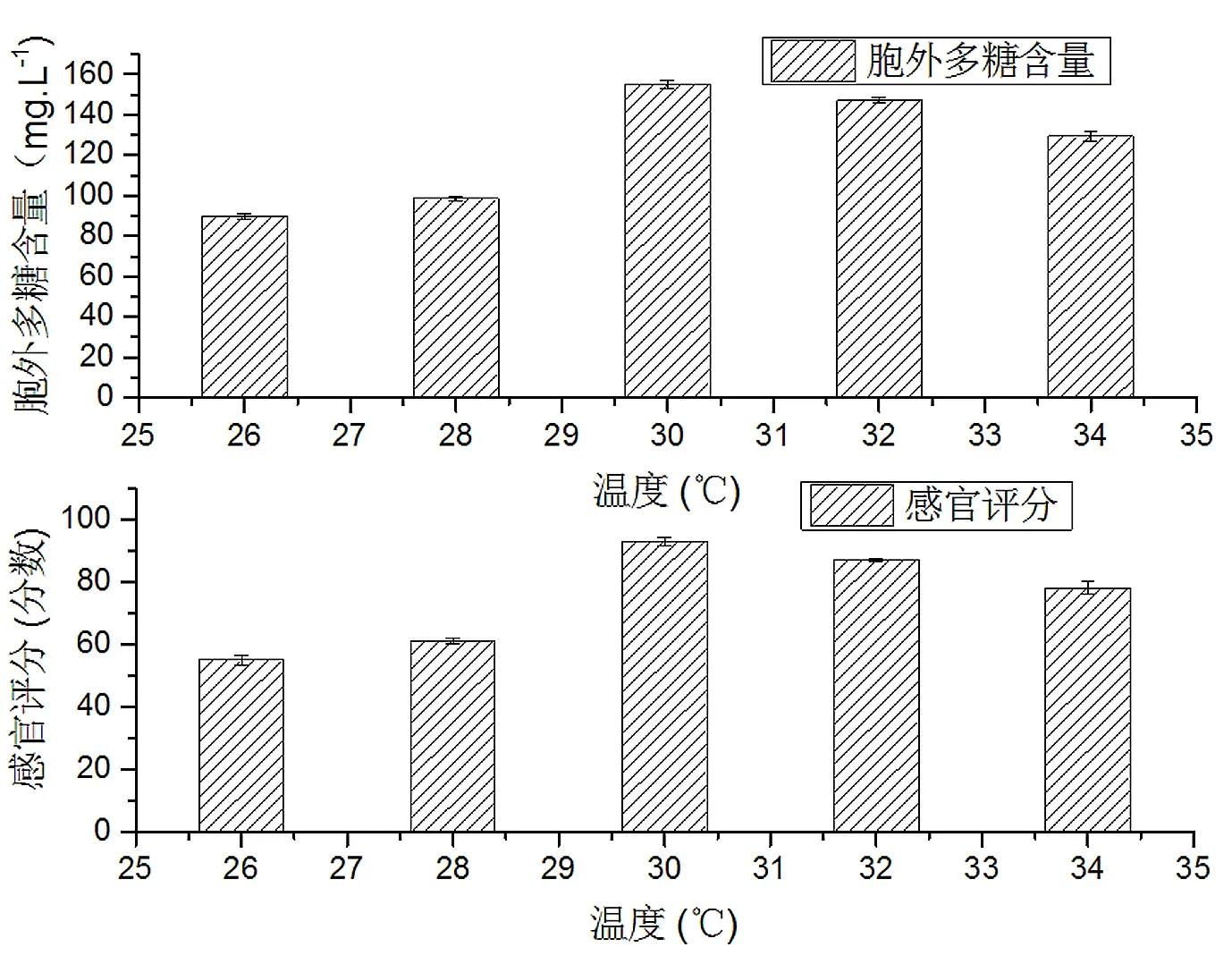
图2 发酵温度对大豆发酵酸乳的影响
由图2可以看出,当发酵温度为30 ℃时,胞外多糖的含量最高为155 mg/L,并且发酵豆乳口感细腻,有发酵香味。因此,当温度达到30 ℃时为最适宜的发酵温度。
3.4 发酵时间对大豆发酵酸乳的影响
按照标题2.5中的方法研究发酵时间对大豆发酵酸乳的影响,其结果如图3所示。
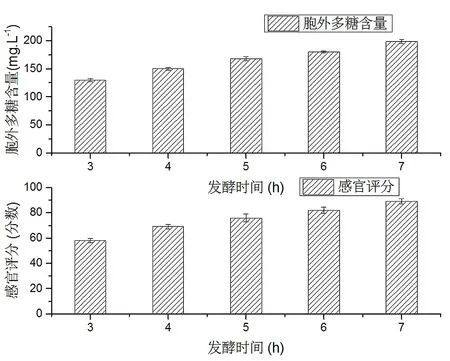
图3 发酵时间对大豆发酵酸乳的影响
由图3可以看出,随着发酵时间的延长胞外多糖的含量也越来越多。但发酵时间过长,会造成发酵过度,使得蛋白质发生变性,析出过多乳清,其组织状态不均匀,酸度过大。而发酵时间过短,会造成发酵酸味不足,口感较差,不被人们接受。当发酵时间为8h时,感官分值最高,胞外多糖的含量为183 mg/L。
3.5 接种量对大豆发酵酸乳的影响
按照标题2.6中的实验方法研究接种量对大豆发酵酸乳的影响,其结果如图4所示。

图4 接种量对大豆发酵酸乳的影响

方差来源平方和自由度均方F值P值显著性Model851.795 51460.842 5410.928 04<0.000 1显著A-菌种比例33.333 33133.333 335.987 0640.028 2显著B-发酵时间63.020 83163.020 8311.319 290.004 6显著C-发酵温度9.187 519.187 51.650 1840.219 8显著D-接种量1.333 33311.333 3330.239 4830.632 2显著AB1110.179 6120.678 1显著AC5.062 515.062 50.909 2850.356 5显著AD10.562 5110.562 51.897 1510.190 0显著BC3.062 513.062 50.550 0610.470 6显著BD491498.800 9840.010 2显著CD1.562 511.5620.280 6440.604 6显著A2169.265 31169.265 330.402 07<0.000 1显著B2126.770 41126.770 422.769 470.000 3显著C2560.513 61560.513 6100.647 9<0.000 1显著D284.454 5184.454 515.169 030.001 6显著残差77.945 83145.567 56失拟72.645 83107.264 5835.482 7040.0577不显著纯误差5.341.325总和929.741 42866.4101
(F值:2个均方比值(效应项/误差项)P值:判定假设检验的一个参数。)
由图4可以看出,随着接种量的增大,胞外多糖的含量越来越高,但当接种量为8%和10%时,发酵饮料组织状态不均匀,乳清析出较多。因此,接种量为6%时,发酵饮料产胞外多糖较多,口感极佳。
3.6 适于大豆发酵酸乳响应面实验
按照标题2.7中的方法,在单因素的基础上,进行大豆发酵酸乳的响应面实验,其结果见表4。
利用Design Expert软件对表4中的数据进行二次线性回归拟合,得到数学模型:Y=87.30+1.67A-2.29B-0.88C-0.33D-0.50AB+0.13AC-1.63AD+0.88BC+3.5BD+0.63CD-5.11A2-4.42B2-9.30C2-3.61D2。由表4回归模型方差分析结果可知,该模型F值为10.928 04,且引起误差的最大变化率为0.01%,表明该模型为极显著。确定最佳因素水平组合,得出最优条件:A=0.22,B=-0.39,C=-0.06,D=-0.29,此时Y值为88.012。利用软件将编码转变为实际参数可得:乳:白=417:1000,发酵时间为6 h,接种量为7.26%、发酵温度为30.8 ℃。结合实际条件确定最终结果为:乳:白=2:5,发酵时间为6 h,接种量为7%、发酵温度为30 ℃。
3.7 稳定剂对大豆发酵酸乳的影响
3.7.1 单一稳定剂对大豆发酵酸乳的影响
按照标题2.8.1中的实验方法,研究单一稳定剂对大豆发酵酸乳的影响,其结果见表5。
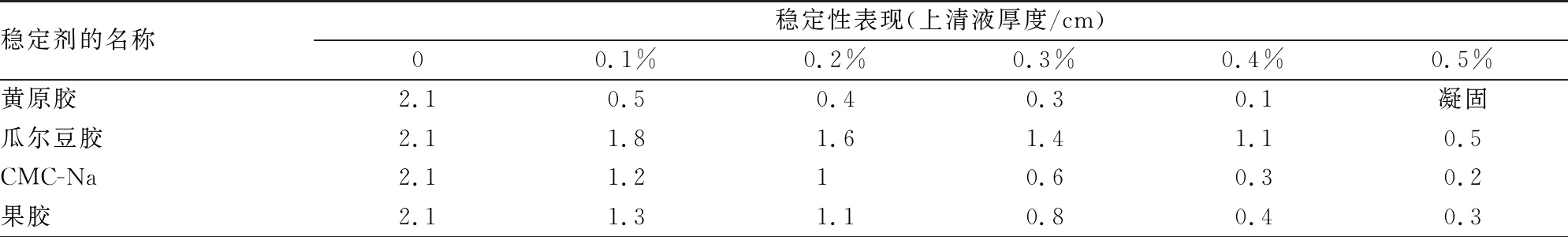
表5 单因素试验中各稳定剂的稳定性表现
将4种亲水性胶体分别加入到饮料中后,制得大豆发酵酸乳,将样品在常温下贮存,观察放置2周后的稳定性情况如表4所示。其中当单独的稳定剂的添加量达到0.5%后,添加黄原胶的大豆发酵酸乳达到稳定不分层状态;然而,瓜尔豆胶、CMC-Na、果胶始终有乳清析出,分层不稳定。按照出现不分层稳定状态的先后顺序,得出针对大豆发酵酸乳稳定剂的优劣顺序为黄原胶>CMC-Na>果胶>瓜尔豆胶;因此,将瓜尔豆胶淘汰,选择黄原胶、果胶和CMC-Na进行复配。
3.7.2 复配稳定剂对大豆发酵酸乳的影响
按照2.8.2中的实验方法,研究复合稳定剂对大豆发酵酸乳的影响,其结果见表6。

表6 回归模型的方差分析
(F值:两个均方比值(效应项/误差项)P值:判定假设检验的一个参数。)
对表6中数据进行二次线性回归拟合分析,可以得到数学模型:Y=92.48+15.58A+8.14B+22.06C-0.33D-7.25AB+9.75AC-8.02BC-6.28A2-4.70B2-12.25C2。由表5回归模型方差分析可知,该模型F值为159.19,且引起误差的最大变化率为0.01%,说明该模型为极其显著,根据因变量和自变量之间的线性关系得到R2=0.995 1(R2:回归平方和与总离差平方和比值,表示总离差平方和中可以由回归平方和解释比。),调整模型系数R2adj=0.988 9,失拟项不显著p值为0.061 1(p>0.05),说明该模型拟合程度好。AB、BC、AC、C2、AB、BC、A2、B2对大豆发酵酸乳的感官影响极显著(p<0.01),表明它们对响应值有较大影响。
根据各因素间交互作用的响应面图可以得出,因素对响应值的强弱程度影响顺序为:CMC-Na的添加量C>黄原胶的添加量A>果胶的添加量B,根据各因素间的交互作用可以看出,AB、BC、AC间的交互作用显著。以此确定最佳因素水平组合,得出最优条件:A=0.556,B=-0.333,C=0.793,此时Y值为104.919;利用软件将编码转变为实际参数:黄原胶0.23%、果胶0.1%、CMC-Na0.27%。
4 结论
(1)将白地霉作为发酵剂与乳酸菌共同豆乳。白地霉的引入,有效地促进了菌株之间的互利共生,产生功能性代谢产物EPS。由于EPS的存在,使得谷物发酵酸乳的口感细腻,并且白地霉产生的香味物质有效地掩盖了豆腥味,使得组织状态均匀,并赋予细腻粘稠的质构与凝乳稳定性,可以不加或者添加少量的稳定剂就可以使得谷物发酵饮料的质地均匀、状态稳定。
(2)白地霉和乳酸菌之所以可以进行混合发酵,达到互利共生的目的,它们具有共同的最适发酵温度,均为30 ℃。谷物发酵饮料发酵初始阶段,白地霉首先利用了发酵环境内氧气,使得乳酸菌在无氧的环境中更好的生长。
(3)根据单因素与响应面实验得出的最佳条件为:乳酸菌与白地霉配比为2:5,接种量为7%,发酵温度为30 ℃,发酵时间为8 h。并研究了黄原胶、果胶、CMC-Na、卡拉胶、瓜尔豆胶稳定剂中筛选出最佳稳定剂为黄原胶的添加量为0.23%、果胶的添加量为0.1%、CMC-Na的添加量为0.27%。通过GC-MS对发酵混合菌株所产的挥发性风味物质进行检测,通过发酵前后风味物质的对比,发酵后香气成分是发酵前的将近3倍。发酵后得到主要是酯类、烷类及酸类等挥发性物质。这些芳香物质能够使谷物发酵饮料中的香味物质质的种类和含量增加,改善谷物发酵乳的风味,使得消费者更加可以接受。
