原发性阴道腺癌合并淋巴上皮瘤样癌一例及文献复习
2020-12-25陈玉莹崔满华刘子玮贾妍
陈玉莹,崔满华,刘子玮,贾妍
淋巴上皮瘤样癌(lymphoepithelioma-like carcinoma,LELC)是一种以合胞体方式生长的未分化型肿瘤,在组织学上与未分化的鼻咽癌相似,肿瘤上皮细胞巢周围有明显的淋巴细胞、浆细胞和嗜酸性粒细胞浸润的强烈炎症反应。LELC可发生在不同的部位,包括胃、唾液腺、胸腺、子宫颈、子宫内膜、乳房、皮肤、膀胱和肺。阴道LELC极其少见,国内仅见个案报道。本研究描述1例阴道原发性腺癌合并LELC患者的病例,并进行相关文献复习,以期提高临床医生对该病的认识。
1 病例报告
患者 女,38岁,孕1产1,因检查发现阴道病变8 d,于2018年12月26日收入院。患者7个月前出现接触性阴道出血,持续至今,遂就诊于吉林大学第二医院门诊。妇科检查:外阴发育正常,阴道通畅,黏膜分泌物血性,量少,于阴道前壁近穹窿处可见大小约2.0 cm×1.0 cm溃疡样组织,质脆。宫颈表面光滑,未见明显异常。子宫前位,正常大,双侧附件区未触及明显异常。人乳头瘤病毒(HPV)-DNA检查提示:HPV-16阳性(+)。宫颈液基细胞学检查提示:非典型鳞状细胞。鳞状细胞癌抗原(SCC)0.8 ng/mL。妇科彩色超声示:子宫前位,正常大,宫腔线清,双附件区未见明显异常。遂行阴道镜下宫颈及阴道壁活检,病理回报:慢性宫颈炎、前穹窿组织考虑为阴道腺癌。盆腔核磁清扫+增强示:阴道前穹隆区见斑片状等T1稍长T2信号影,边界不清,弥散成像呈高信号,范围约21 mm×6 mm,增强扫描不均匀强化,子宫及宫颈形态、信号未见明显异常,增强后未见明显异常强化。影像学提示:阴道前穹窿区恶性占位。临床诊断:阴道腺癌Ⅰ期。经与病人及家属沟通后,遂行腹腔镜下全子宫双侧输卵管切除术+双侧卵巢悬吊术+盆腔淋巴结清扫术+部分阴道切除术+阴道延长术,术中探查:子宫正常大,表面光滑,双附件区未见明显异常,盆腔淋巴结无明显肿大,术后病理回报:阴道腺癌,部分区域分化差,见图1(见封三),有多量淋巴细胞浆细胞浸润,呈 LELC 特征,见图 2(见封三),左侧盆腔(0/14)、右侧盆腔(0/16)淋巴结未见癌转移。免疫组织化学染色结果:细胞角蛋白 CK7(+)、CK5/6(灶+)、雌激素受体(ER)阴性(-)、增殖细胞相关抗原 Ki67(阳性率 90%)、P16(+)、P40(-)、孕激素受体(PR)(-)、P53(散在+)、p63(-)、B 细胞分化抗原 CD20(-)、CK(AE1/AE3)(+)、转录因子(GATA3)(-)、EB 病毒(EBER)(-)、淋巴细胞共同抗原(LCA)(-)、波形蛋白(Vimentin)(-)、核转录因子 8(PAX8)(-)、人类婆罗双树样基因 4(SALL-4)(-)、Wilms瘤转录因子 1(WT1)(-)、CD10(-)、同源盒转录因子 2(CDX2)(-)、胃酶样天冬氨酸蛋白酶 A(NapsinA)(-)。术后行6个疗程紫杉醇+顺铂静脉化疗。治疗结束至今12个月,未见局部复发和远处转移迹象,继续随访中。
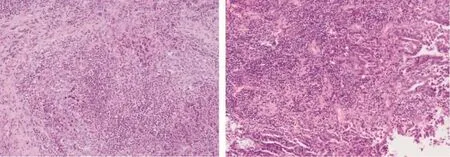
图1 阴道腺癌病理图(HE×100)

图2 阴道淋巴上皮瘤样癌病理图(HE×100)
2 讨论
2.1 病因及临床表现 LELC是一种罕见疾病,发病率约为0.7%~5.5%[1],多见于鼻咽癌,在女性生殖系统,LELC可发生在外阴、阴道、子宫颈和子宫内膜等部位,发病机制尚不清楚且存在争议。发生在鼻咽、胃、肺等部位的LELC通常与EB病毒感染有关,但发生在子宫颈、阴道的LELC,EB病毒常为阴性,但HPV为阳性,其中HPV-16最常见[2]。目前报道的5例阴道LELC患者均为EB病毒阴性,HPV阳性或无法检测(可能是由于患者年龄大、固定不好或炎症细胞数量多)[2-5]。Pinto等[6]报道的8例宫颈LELC患者全部为EB病毒阴性,其中7例HPV阳性。而中国一篇文献报道,对21例LELC患者的回顾性分析发现,大部分病例存在EB病毒感染,原位杂交EB病毒编码的小 RNA(EBER)阳性率 76.2%(16/21)[7]。有研究表明,EB病毒在宫颈LELC中不作为致癌因子,但在浸润基质的淋巴细胞中可能发现EB病毒DNA序列[8]。本例中也存在HPV-16的感染,但EB病毒阴性。典型的阴道LELC表现为阴道出血或异常排液。妇科内诊检查时,可于阴道壁触及病灶,包括溃疡型、菜花状。患者平均发病年龄为49.6岁(32~67 岁)[9]。
2.2 诊断及鉴别诊断 在组织学上,LELC是在大量淋巴细胞浸润的背景下由未分化细胞构成的界限不清的岛状细胞组成的。肿瘤细胞有均匀的泡状核,有明显的核仁和适量的微嗜酸性细胞质。细胞边缘不明显,常使细胞群出现类似合胞体的外观[2]。上皮和淋巴样标记物的典型镜下表现和免疫组织化学检测有助于将宫颈LELC与低分化的鳞状细胞癌、玻璃状细胞癌和淋巴增生性病变区分开,其中低分化鳞癌预后更差。周围淋巴细胞密度高的鳞癌与LELC的不同之处在于其没有囊泡核和LELC的合胞外观,另外鳞癌常有明显的边界及角化作用[6]。该病例中肿瘤组织在镜下分为两种形态;一种是分化低的腺癌,由非典型腺体浸润间质组成;另一种是未分化的癌灶,肿瘤细胞呈合胞排列,细胞核大,核仁突出,有明显的炎症浸润,在局部区域可见密集的淋巴细胞浸润于肿瘤细胞周围。
由于病变高度炎性化,明确诊断是比较困难的,使用广谱的免疫组织化学方法是更为可取的,同时角蛋白免疫组织化学阳性有助于诊断LELC。肿瘤组织表现为对细胞角蛋白AE1、AE3、CK7强免疫反应性[2]。密集的淋巴细胞浸润由T淋巴细胞(CD3阳性)和少量 B 细胞(CD20阳性)组成[5],P16弥漫性阳性[2,6]。本例中免疫组织化学结果显示:CK7(+)、P16(+)、CD20(-)、CK(AE1/AE3)(+)。
2.3 治疗及预后 宿主的防御反应可引起淋巴细胞浸润到基质,但由于微卫星不稳定的肿瘤也可表现为明显的肿瘤周围炎性浸润。Pinto等[6]研究LELC错配修复(mismatch repair,MMR)基因状态,发现所有肿瘤均表达完整的蛋白,提示微卫星稳定性。同时大多数患者肿瘤细胞中PD-L1过表达,这表明使用检查点抑制剂(如Pembrolizumab)治疗LELC可能具有潜在益处。Kumar等[10]的研究也支持这一结果,2例晚期LELC患者在多次化疗后复发,最终对PD-L1抑制剂Nivolumab治疗反应良好。Nivolumab治疗晚期LELC表现出较好的耐受性和较小的不良反应。血液中神经元特异性烯醇化酶(NSE)水平可用于衡量检查点抑制剂治疗LELC的效果[11]。
因阴道LELC病例太少,治疗上并无特异性,但从宫颈LELC的治疗上看,宫颈LELC区域淋巴结转移率低于同期别的鳞癌[12],对放化疗反应好,预后优于宫颈鳞癌,所以不能单纯将LELC归类未分化癌,预后差。在鼻咽、肺、胃和乳房的LELC也有良好的预后[3]。有报道认为预后良好可能与肿瘤相关抗原引起的免疫反应有关,在基质中发现浸润的淋巴细胞反映了体液和细胞介导的对肿瘤的免疫反应[9]。这种反应似乎可以减少淋巴结转移,提高总体生存率。
LELC是一种罕见的鳞癌亚型,发病率很低,诊断困难,对于其生物学特征有许多未知的方面。对于病理医生和临床医师来说,认识这种罕见的组织类型,了解其与EB病毒、HPV的关系,通过长期随访现有病例研究有效治疗方法和影响其预后的因素是非常重要的。
