免疫炎症反应在心力衰竭心肌纤维化中的研究进展①
2020-12-25陈纪烨马度芳王永成周国锋张永健
陈纪烨 马度芳 王永成 周国锋 张永健 李 晓
(山东中医药大学,济南250011)
心力衰竭是指由于各种器质性或功能性的心脏疾病导致心室充盈或者射血功能受损的一种疾病,是多种心血管疾病进展的终末阶段,具有较高的发病率和死亡率,日益成为危及人类健康的重大公共卫生问题[1]。心肌纤维化是心力衰竭的主要病理改变,是心室重构的主要原因,可导致心肌顺应性降低、心脏舒缩功能受损,长期的容积或压力过负荷最终可引起心力衰竭[2]。有研究显示,改善心肌纤维化可以延缓心力衰竭进程、改善心功能,已经成为治疗心力衰竭的新靶标[3]。
越来越多的证据显示,免疫炎症反应在心肌纤维化的过程中发挥重要作用,通过调节异常的免疫炎症反应可能是改善心肌纤维化的新途径[4,5]。炎症是心肌纤维化的重要诱发因素,在多种心血管疾病中,炎症反应与心肌纤维化常常并存于同一病变部位。当心脏急性或慢性损伤时,免疫系统激活,释放多种炎症因子,激活心肌成纤维细胞,导致胶原代谢异常,心肌细胞坏死、变性,从而引起心肌纤维化等病理变化。1990年Leslie等[6]首次提出炎症细胞与左室纤维化密切相关,该实验发现在早期的急性炎症期,CVB3感染的A/J小鼠出现低程度的心肌纤维化,但随着炎症反应的扩大,出现大量的淋巴细胞浸润在整个心肌组织以及病变损伤部位。 近些年,随着研究的不断深入,各种临床和实验研究不断有证据证明免疫炎症反应与心肌纤维化具有密切的关系。因此,心力衰竭的短期治疗目标是通过改善患者的临床症状从而缓解病情,而长期治疗目标则是通过逆转由免疫炎症反应等多种不利因素导致的心肌纤维化等靶器官损伤,进而改善心力衰竭患者的生存预后。现已明确获得性免疫系统和固有免疫系统介导的慢性炎症反应参与心肌纤维化进展,因此本文将对免疫炎症对心肌纤维化的作用及其机制和最新研究进展加以综述,旨在从免疫学角度更好地理解炎症过程,有助于早期改善心肌纤维化以预防心力衰竭的发生。
1 获得性免疫系统与心肌纤维化
获得性免疫系统主要由T细胞和B细胞介导,T细胞表面存在多种重要的膜蛋白,参与T细胞的活化、增殖、分化及免疫效应功能,如CD4 和CD8 分子。成熟B细胞主要存在于外周淋巴器官(如脾脏)内,其表面膜分子主要参与活化、增殖、抗原提呈与产生抗体。
1.1T淋巴细胞与心肌纤维化 T细胞是淋巴细胞中数量最多、功能最复杂的一类细胞,主要分为CD4+和CD8+T淋巴细胞2大亚群。研究发现,T细胞在多种心脏疾病中被募集到心脏的局部,参与多种原因所导致的心肌纤维化。有研究指出,CD8+T细胞、CD4+T细胞亚群(包括Th1、Th2、Th17、Treg)的局部和全身适应性免疫激活可导致小鼠慢性缺血性心力衰竭[7]。T 淋巴细胞可直接激活心肌成纤维细胞,也可通过释放炎症因子和趋化因子间接作用于心肌成纤维细胞。
CD4+T淋巴细胞也称为辅助T(Th)细胞,传统上是根据细胞因子的产生特征分类的,最常见的分类包括Th1、Th2 、Th17和调节性T细胞(regulatory T cells,Treg),这些亚群对免疫系统的整体功能具有重要调节作用,尤其是Th1/Th2和Th17/Treg之间的平衡对维持机体内在的免疫调节的稳定具有重要作用,见图1。Laroumanie等[8]研究显示在压力超负荷所致的心衰小鼠模型中,缺乏CD4+T细胞的小鼠通过减少胶原的沉积可显著改善心肌纤维化程度,并发现巨噬细胞浸润减少。 因此,CD4+T细胞的免疫调节治疗可能是改善心力衰竭心肌纤维化的一种新的治疗策略。
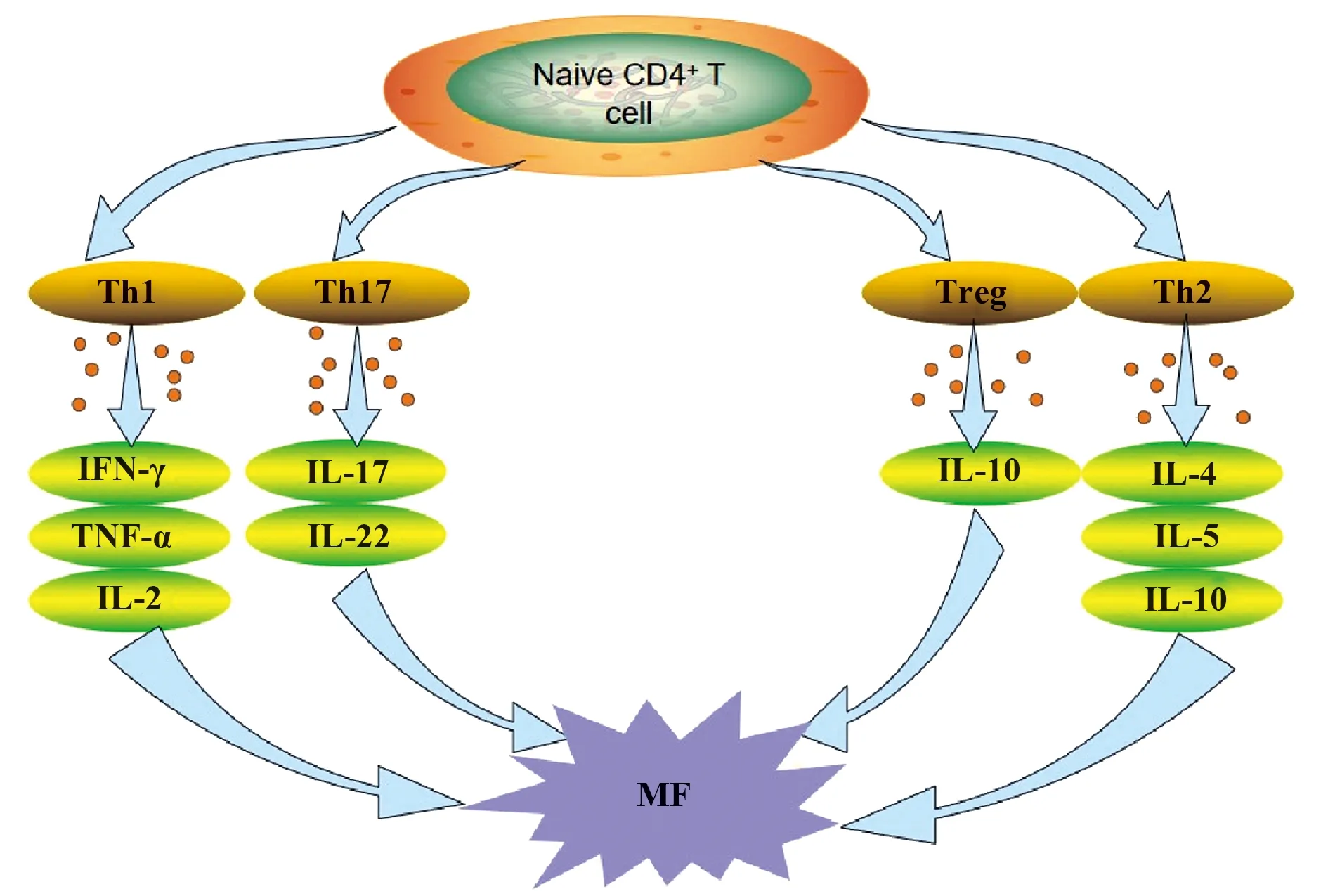
图1 CD4+T细胞亚群诱导心肌纤维化的示意图Fig.1 Schematic diagram of CD4+T cell subsets inducing myocardial fibrosis
CD8+T淋巴细胞具有细胞毒性作用,在心肌纤维化过程中作用复杂,主要通过以下3种途径参与心肌纤维化的过程:①CD8+T淋巴细胞活化后可通过介导穿孔素依赖机制诱发严重的炎症反应,导致心肌纤维化;②CD8+T淋巴细胞可通过触发细胞凋亡机制引起心肌纤维化;③活化的CD8+T细胞与巨噬细胞的直接接触是巨噬细胞活化和炎症启动的关键,从而使心肌成纤维细胞表型发生转变,激活免疫应激反应,最终导致心肌纤维化[9,10]。目前,针对CD8+T淋巴细胞在心肌纤维化形成过程中作用的研究较少,CD8+T淋巴细胞诱发炎症反应导致心肌纤维化的具体机制尚需进一步研究。
1.2Th1和Th2细胞与心肌纤维化 在正常人体中,Th1 和 Th2 细胞功能保持动态平衡,分别通过不同方式调节心脏成纤维细胞活性,打破这种平衡会导致免疫功能的紊乱,从而诱发心肌纤维化。Th1 细胞主要分泌干扰素-γ(IFN-γ) 、IL-2 和TNF-α等,介导细胞免疫应答调控,参与激活巨噬细胞和介导迟发性超敏反应;Th2 细胞主要分泌 IL-4、IL-10、IL-5等,介导体液免疫应答的调控[7]。Th1型细胞因子是促炎细胞因子,可促进心肌纤维化的发生发展,而Th2 型细胞因子是抗炎细胞因子,具有改善心肌纤维化的作用。Nevers等[11]研究显示,在左心室压力超负荷模型中,活化的Th1细胞与成纤维细胞之间的直接黏附作用可促进TGF-β合成,从而导致成纤维细胞转化为肌成纤维细胞。Th1细胞表达的增加可使心肌胶原数量增加,并增强胶原交联性,最终导致心肌僵硬度增加,Th2细胞表达的增加则可减少心肌胶原的数量,改善心肌纤维化[12]。Yu等[13]研究发现Th1型细胞因子主要参与心肌纤维化的早期阶段,而Th2型细胞因子主要参与心肌纤维化的晚期阶段。
Th1/Th2 细胞的免疫功能失衡可能是导致心力衰竭病理性自身免疫应答的重要机制之一,并在心肌纤维化的过程中发挥重要作用。T细胞可通过调解巨噬细胞活性影响心肌纤维化,Th1细胞可通过释放促炎细胞因子激活巨噬细胞,Th2细胞则可释放抑炎细胞因子从而抑制巨噬细胞活性[14]。在心力衰竭的心肌细胞中,与Th1细胞和Tregs相比,Th2和Th17细胞较有优势。近年来通过对心力衰竭的抗炎治疗发现,β受体阻滞剂、他汀类药物和胸腺五肽等药物可通过调节Th1/Th2 细胞免疫平衡发挥改善心力衰竭的作用[15]。但Th1/Th2 细胞功能失衡在心肌纤维化中的具体生物学机制及其在不同病因引起的心衰中的作用尚不明确,因此,如何通过调节Th1/Th2细胞免疫功能平衡改善心肌纤维化还有待进一步的研究。
1.3Th17和Treg细胞与心肌纤维化 Th17细胞和 Treg细胞均来源于CD4+T细胞亚群,但其作用却相反,在特定的免疫微环境下,二者可以相互转化、相互制衡,它们之间的平衡可能对控制炎症和改善心肌纤维化具有重要作用。
Th17细胞是一类以大量分泌IL-17为主要特征的一种新型辅助T细胞。IL-17是一种具有多种促炎功能的多效细胞因子,可通过促进中性粒细胞和巨噬细胞在T细胞活化部位的持续浸润加重炎症损伤。并且Th17细胞还会扩大体内多种免疫细胞(如Th1和Th2淋巴细胞)产生的局部炎症反应。Cortez等[16]研究证明Th17细胞与胶原代谢和心肌纤维化密切相关。Feng等[17]研究表明,在异丙肾上腺素诱导的心衰大鼠模型中,IL-17可通过 RANKL/OPG和 MMP/TIMP 信号通路诱导心肌纤维化,最终导致心力衰竭,而阻断IL-17可抑制心肌纤维化,促进炎症消退,降低Ⅰ型胶原和Ⅲ型胶原水平。苏兆亮等[18]研究发现IL-17可能通过PKCβ-ERK1/2-NF-кB通路促进心肌成纤维细胞Ⅰ型和Ⅲ型胶原表达。Treg细胞是具有免疫抑制功能的CD4+T细胞亚群,其调控免疫应答的一个重要机制是通过分泌IL-10控制炎症反应、维持免疫稳态,并且IL-10可能通过调节Treg细胞和CD4+T细胞在ERK、PI3K/AKT和Stat3通路中的反应缓解心脏纤维化进程[19]。有研究发现,在体外实验中,Tregs 能抑制 α-SMA和MMP-3表达,从而抑制心肌纤维化,且其可能通过调节成纤维细胞的表型和功能抑制心室重构[20]。Kanellakis 等[21]研究证明Tregs转移是改善心肌纤维化的有效治疗策略。
当组织损伤持续存在时,损伤修复迁延不愈会诱导慢性炎症发生,慢性炎症持续存在是导致心肌纤维化的主要原因,提示炎症局部的免疫微环境与心肌纤维化的预后密切相关。Th17型免疫成分主导的免疫微环境促进心肌纤维化,而Treg型免疫成分主导的免疫微环境抑制心肌纤维化。尽管针对在心力衰竭患者体内Th17和Treg细胞之间失衡的研究得到了广泛关注,并且通过调节Th17和Treg细胞之间的平衡对改善心肌纤维化起到了积极作用,但心肌纤维化与Th17/Treg失衡的具体机制和相互关系仍不明确。
1.4B淋巴细胞与心肌纤维化 B淋巴细胞来源于造血干细胞,通过提呈抗原并分泌抗体、提供协同刺激信号及分泌细胞因子等方式调节免疫反应。Cordero-Reyes等[22]通过AngⅡ诱导的心衰模型小鼠发现,B细胞缺失可导致促炎因子表达降低和心肌肥大、胶原沉积及心肌细胞凋亡减轻,此外,体外研究表明,活化的B细胞能够刺激心肌成纤维细胞产生胶原,促进心肌纤维化。提示在心力衰竭心肌纤维化发展过程中,除T细胞外,B细胞也发挥重要作用。B淋巴细胞主要通过3种途径参与心肌纤维化进程:①与T细胞相互作用,尤其是Th1细胞,可刺激循环中产生炎症细胞因子(如IL-6和TNF-α等),这些炎症细胞因子的激活会抑制心肌的舒缩功能,导致心肌纤维化,且B细胞会直接产生IL-6、IL-1β和 TNF-α等炎症细胞因子,从而扩大炎症反应[23];②活化后的B细胞可通过补体介导的细胞毒性反应或诱导心肌细胞凋亡等机制损伤心肌[24];③B细胞活化后,TOLL样受体(TLR)介导的免疫炎症途径被大量激活,从而促进炎症反应和心肌纤维化等多种病理过程[25]。此外,还有研究发现B细胞会刺激MMP-9的分泌,促进细胞外基质沉积[26]。这些重要的研究表明导致B细胞激活的通路在心力衰竭心肌纤维化的发生发展中起着重要作用。
2 天然免疫系统与心肌纤维化
天然免疫系统是机体抵御病原微生物入侵的第一道防线,单核巨噬细胞、树突状细胞、自然杀伤细胞、补体、细胞因子和黏附分子等均为天然免疫系统的重要组成部分。其中由中性粒细胞和单核巨噬细胞介导的炎症级联反应是导致心肌纤维化的常见机制之一,可分泌 IFN-γ、IL-6和TNF-α等多种促炎细胞因子,进而导致心肌纤维化。
2.1肥大细胞 在心脏容量超负荷或心肌组织受损等病理状态下,心脏中的大量肥大细胞会浸润聚集,并通过释放促进血管周围及心肌间质纤维化的刺激因子和生长因子导致心脏胶原纤维沉积、心肌顺应性降低,促进心室重构,最终引起心力衰竭[27]。Mclarty等[28]研究表明,在左心室压力超负荷模型小鼠中,肥大细胞缺失的小鼠血管周围纤维化程度减弱,心力衰竭的进展得以延缓。体外实验表明,肥大细胞可直接作用于心肌成纤维细胞,诱导心肌成纤维细胞的活化和增殖,促进胶原沉积[29]。此外,肥大细胞脱颗粒物质在心肌纤维化中发挥重要作用,其释放的组胺、炎症介质、细胞因子、生长因子、糜蛋白酶、类胰蛋白酶等物质共同形成局部纤维化的免疫微环境,促进肌成纤维细胞分化和胶原合成[30]。近年来,由肥大细胞分泌的糜蛋白酶、类胰蛋白酶在心肌纤维化中的重要性得到广泛关注,它们通过激活TGF-β1信号通路促进成纤维细胞的活化和分化[27]。但也有一些研究表明,肥大细胞具有抑制心肌纤维化的作用,这可能与巨噬细胞相似,肥大细胞通过改变生长因子和蛋白酶表达谱对局部免疫微环境因素做出反应。总之,肥大细胞在心肌纤维化中的作用仍未充分明确,其如何促进心肌纤维化及如何在体内与成纤维细胞相互作用尚不清楚,是深刻挖掘肥大细胞在心肌纤维化中潜在作用需要明确的问题。
2.2中性粒细胞 中性粒细胞在促进心脏炎症反应和调节心肌纤维化中具有重要作用。Horckmans等[31]研究发现中性粒细胞可通过调控巨噬细胞表型减轻炎症反应、改善心肌纤维化。Wu等[32]研究发现CD11b+Gr1+中性粒细胞通过释放的S100a8/a9促进炎症细胞浸润,激活心肌成纤维细胞,导致心肌纤维化,抗s100a9抗体可减轻AngⅡ诱导的炎症反应,并可减轻炎症引起的血管周围间质纤维化,提示S100a8/a9在炎症和心肌纤维化的发生中发挥重要作用。以上研究均表明中性粒细胞参与心肌纤维化的过程,因此,深入研究中性粒细胞在心肌纤维化中的免疫调节机制对心肌纤维化的靶向治疗药物研究至关重要。
2.3巨噬细胞 心脏中的大量巨噬细胞浸润是导致心肌纤维化的重要原因。巨噬细胞主要可分为2种表型,包括M1型巨噬细胞和M2型巨噬细胞,在局部免疫微环境因素(如细胞因子等)与参与反应的细胞亚型影响下,二者在炎症的不同阶段发挥不同作用,且M1/M2型巨噬细胞比例的动态变化与炎症、心肌纤维化和血管生成的调节有关[33]。IFN-γ诱导活化的M1型巨噬细胞通过与TNF-α结合介导Th1方向的极化免疫反应;相反,由IL-4或IL-13诱导的M2型巨噬细胞表达大量IL-10,通常介导Th2方向的极化免疫反应[34]。Falkenham等[35]通过耗竭循环的单核细胞防止损伤部位心肌巨噬细胞的浸润导致表达活化成纤维细胞表型的细胞显著减少,从而导致胶原沉积减少,心肌纤维化改善。Frangogiannis等[36]研究发现,在心肌纤维化的小鼠模型中,趋化因子介导的巨噬细胞募集对纤维化的发展至关重要。巨噬细胞通过与成纤维细胞的相互作用是改善心肌纤维化的潜在机制。巨噬细胞主要通过以下3种途径参与心肌纤维化过程:①巨噬细胞分泌多种细胞因子(如IL-1和TNF-α等)和生长因子(如FGFs和PDGFs等)调控成纤维细胞的活化和增殖;②巨噬细胞可通过分泌使成纤维细胞失活的介质或清除凋亡的肌成纤维细胞抑制成纤维细胞活化;③巨噬细胞通过调节MMP/TIMP间的平衡调控ECM重塑,参与心肌纤维化的过程[37]。此外也有多项研究证明,通过抑制MCP-1可显著减少巨噬细胞浸润,改善心肌纤维化[33]。MCP-1的趋化作用通过CCR2完成,CCR2作为MCP-1的特异受体,与炎症反应和心肌纤维化密切相关,Epelman等[38]研究指出,通过敲除骨髓细胞中的CCR2,阻断MCP-1与CCR2的信号传导可显著缓解AngⅡ诱导的炎症和纤维化。总之,越来越多的证据证明巨噬细胞在心肌纤维化中具有重要作用,但未来的研究应是结合蛋白组学、转录组学和表观遗传学的方法通过调节心脏巨噬细胞表型探索心肌纤维化的治疗策略。
2.4TOLL样受体 TOLL样受体是固有免疫系统中的重要细胞表面跨膜蛋白受体,目前认为,TLR2、TLR4和TLR5可能在心肌纤维化的发生发展中发挥重要作用。TLR4可通过髓样分化因子88(MyD88)依赖性或非MyD88依赖性2条细胞信号转导通路启动心肌细胞免疫反应,释放炎症因子,引发细胞外基质沉积,促进心肌纤维化发展[39]。TLR4的活性与心肌纤维化密切相关,应用TLR4抑制剂或TLR4信号下游分子抑制剂,以及在TLR4基因敲除的小鼠中,均出现炎症因子表达较少,心肌纤维化程度减轻,心功能改善等现象[40,41]。Liu 等[42]研究发现,TLR4可通过调节Th1/Th2平衡发挥对心脏的保护作用。TLR5的敲除可改善压力负荷诱导的小鼠巨噬细胞浸润,抑制炎症反应,改善心肌纤维化,提高心功能[43]。Spurthi等[44]研究指出TLR2敲除小鼠的心肌成纤维细胞数量明显高于野生型小鼠,并指出TLR2的缺失会诱发心肌纤维化,这可能是心脏不良重构和收缩功能障碍的原因。上述研究提示TOLL样受体与心肌纤维化密切相关,但其参与心肌纤维化的具体靶点和过程还需要进一步研究。
2.5补体 补体作为炎症反应过程中的重要介质,其介导的炎症反应在多种心血管疾病中发挥重要作用。 C3作为补体系统的核心组分,可通过调控巨噬细胞极化参与炎症反应和心肌纤维化过程[45]。Wu等[46]研究发现补体C1Q肿瘤坏死因子相关蛋白(C1QTNF1)通过激活AMPKA抑制心肌肥厚和纤维化,改善心脏功能,且C1QTNF1可抑制心肌成纤维细胞的活化和功能,提示靶向C1QTNF1可能是逆转病理性心肌肥厚和心肌纤维化的有效策略。Zhang等[47]研究表明,补体激活和补体因子5a(C5a)介导的巨噬细胞浸润在AngⅡ诱导的炎症和纤维化重塑过程中发挥重要作用。Iyer等[49]研究证实,过度的补体激活可导致C5a与其G蛋白偶联受体(C5aR)结合,从而出现损伤部位炎症细胞的募集及炎症细胞因子的释放,而使用C5aR受体拮抗剂PMX53能够通过抑制炎症细胞浸润减少间质和血管周围纤维化,改善心功能。因此,未来的研究应该探索新型的补体抑制剂,通过靶向抑制特定蛋白和特异性受体改善炎症与心肌纤维化,以期进一步改善心力衰竭的预后。
3 展望
本文主要阐述了天然免疫系统和获得性免疫系统介导的慢性炎症反应与心肌纤维化之间的相互关系及可能的影响机制。调节先天性和获得性免疫反应的失调可能会成为心肌纤维化研究的重要方向,但该研究还处于初级阶段,未来对重要的炎症因子、促纤维细胞因子、表观遗传和免疫细胞之间内在关系的探索研究可帮助研究人员通过调节病变局部的免疫微环境改变炎症性质,改善心肌纤维化,达到改善心力衰竭患者临床预后和降低死亡率的最终目标。
