lncRNA UCA1靶向miR-145调节卵巢癌细胞SK-OV-3增殖和迁移行为①
2020-12-25董志红古力加汗艾尔肯铁丽萍沈谷群
董志红 古力加汗·艾尔肯 铁丽萍 沈谷群
(新疆医科大学附属肿瘤医院,乌鲁木齐830000)
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,严重影响女性健康,预后较差且复发率较高[1,2]。因此,寻找新的诊断指标和治疗方法是改善卵巢癌患者预后的关键。长链非编码RNA(long non-coding RNA,lncRNA) 是RNA聚合酶Ⅱ转录产物,是一类不编码蛋白质的RNA[3]。研究表明,lncRNA与肿瘤的发生发展密切相关,其中,lncRNA UCA1参与卵巢癌的发生发展,在卵巢癌组织中异常表达,通过上调MMP2、MMP9促进卵巢癌细胞侵袭转移[4-8]。短链非编码RNA miR-145过表达可明显抑制卵巢癌细胞增殖并降低其运动能力[9-11]。生物信息学预测发现UCA1和miR-145可能存在靶向关系,但UCA1和miR-145在卵巢癌细胞增殖和迁移过程中是否存在靶向调控关系尚未见报道。因此,本文将探究沉默和过表达UCA1对卵巢癌细胞增殖与迁移的作用及其与miR-145的关系。
1 材料与方法
1.1材料 人卵巢癌细胞株A2780、SK-OV-3购自中国科学院细胞库,人正常卵巢上皮细胞HOSEpiC由本院实验室保存;shUCA1、miR-145 inhibitor购自广州锐博生物公司;DMEM培养液、RPMI1640培养液、胰酶、双抗和胎牛血清购自Gibco公司;pcDNA3.1质粒、lipo3000、TRIzol试剂购自赛默飞世尔公司;psiCHECK质粒、Dual Luciferase报告基因试剂盒、逆转录试剂盒、荧光定量试剂盒购自Promega 公司;CCK8试剂盒购自同仁公司;UCA1全序列合成及引物合成由上海生工完成;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、基质金属蛋白酶-15/-28 (matrix metalloproteinase-15/28,MMP-15/28)、CyclinD1、周期素依赖性激酶2(cdc2 related protein kinase,CDK2)、活化蛋白激酶B (jun B protooncogene,JunB)、GAPDH一抗及HRP 标记的羊抗鼠、羊抗兔二抗均购自北京博奥森生物公司。
1.2方法
1.2.1细胞培养 人正常卵巢上皮细胞HOSEpiC、人卵巢癌细胞A2780培养于含10%胎牛血清的RPMI1640培养基,SK-OV-3细胞培养于含10%胎牛血清的DMEM培养基,37℃、5% CO2,隔天观察换液,细胞融合率达到90%时传代。
1.2.2细胞转染 取对数生长期细胞接种于6孔板,培养24 h后按照操作手册采用lipo3000将shUCA1、pcDNA3.1-UCA1重组质粒、pcDNA3.1空质粒转染入SK-OV-3细胞,并根据实验需要采用lipo3000分别或同时转染shUCA1、miR-145 inhibitor,转染48 h后进行实验。
1.2.3CCK8检测细胞活性 取生长状态良好的SK-OV-3细胞进行增殖实验。胰酶消化细胞,计数并调整细胞浓度为5 000个/孔,接种于96孔板,150 μl/孔加入培养基,37℃、5%CO2培养,随机分为miR-145 mock组、shUCA1组、miR-145 inhibitor组和shUCA1+miR-145 inhibitor组,用miR-145 inhi-bitor 和shUCA1分别或同时转染培养24、48、72、96 h后,100 μl/孔加入培养基与20 μl CCK8试剂,避光孵育2 h;酶标仪测定450 nm处吸光度(OD),OD值越大,细胞活力越强,细胞增殖越多。每个实验设置3个复孔。
1.2.4迁移实验 将细胞用无血清培养基培养24 h后,以2×105个/ml接种于24孔Transwell小室中,用无血清培养基培养,小室下层加入含血清的正常培养基,培养48 h后用棉签擦去上层细胞,用结晶紫对下层细胞进行染色并统计。每个实验设置3个复孔。
1.2.5荧光素酶报告实验 通过starBase数据库的miRNA-lncRNA interactions模块预测分析UCA1与miR-145的结合位点。基因合成UCA1中含有miR-145结合位点的片段,并将该片段插入psiCHECK载体。用野生型UCA1质粒、突变型UCA1质粒和miR-145分别或同时转染细胞后,根据Dual Luciferase报告基因试剂盒说明书测定荧光强度。
1.2.6RT-qPCR 根据试剂说明书用Trizol试剂从细胞中提取总RNA,逆转录试剂盒合成cDNA,RT-qPCR检测UCA1和miR-145表达,UCA1以β-actin为对照,miR-145以U6为对照。引物序列见表1,2-ΔΔCt法计算。
1.2.7Western blot实验 收集培养的细胞,加入适量RIPA裂解液(含蛋白酶抑制剂),冰上充分裂解15 min,收集裂解液超声裂解后于4℃、12 000 r/min离心10 min,取上清煮沸10 min,测定蛋白浓度,-80℃保存。取40 μg蛋白行SDS-PAGE电泳(60、90 V恒压),电泳结束后恒流200 mA,湿法转膜 2 h,TBST洗膜3次、每次5 min,5%脱脂奶粉封闭1 h。TBST洗3次、每次5 min,加入一抗4℃孵育过夜。TBST洗膜3次、每次5 min,加入相应二抗37℃孵育1 h,TBST洗3次,每次5 min,ECL显影。
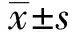
2 结果
2.1UCA1和miR-145在卵巢癌细胞系中的表达 通过在线数据库GEPIA分析卵巢癌及癌旁组织中差异表达的lncRNAs。结果发现,UCA1在425例卵巢癌组织中的表达中位数为6.25,在88例癌旁组织中的表达中位数为0.02,提示UCA1在卵巢癌组织中表示升高(P<0.01,图1)。与人正常卵巢上皮细胞HOSEpiC相比,UCA1在卵巢癌细胞SK-OV-3和A2780中表达显著升高(P<0.05),SK-OV-3细胞表达升高更为显著(P<0.01),miR-145表达明显降低(P<0.01,图2),SK-OV-3细胞变化最为显著。因此,选择SK-OV-3进行后续实验。

表1 RT-qPCR引物序列
2.2UCA1对miR-145表达的影响 UCA1过表达可显著降低卵巢癌细胞SK-OV-3 miR-145表达(P<0.01,图3A)。下调UCA1表达可显著促进SK-OV-3细胞miR-145表达(P<0.01,图3B),表明UCA1可影响卵巢癌细胞SK-OV-3 miR-145表达。
2.3下调UCA1对卵巢癌细胞增殖的影响 CCK8实验结果表明,与miR-145 mock组相比,miR-145 inhibitor组细胞活性明显提高,表明miR-145可抑制卵巢癌细胞增殖,而shUCA1组细胞活性明显降低(P<0.05),可能是UCA1低表达可促进miR-145表达,进而抑制卵巢癌细胞增殖;与shUCA1组相比,shUCA1+miR-145 inhibitor组细胞活性明显升高(P<0.05) ,进一步证实下调UCA1可促进miR-145升高,而miR-145 inhibitor抑制miR-145表达可促进卵巢癌细胞增殖,见图4。
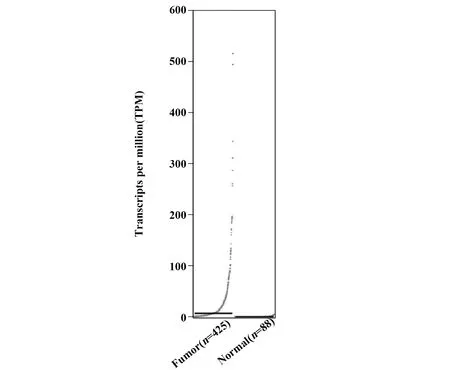
图1 GEPIA数据库预测UCA1表达模式Fig.1 UCA1 expression pattern was predicted by GEPIA databank

图2 UCA1和miR-145在卵巢癌细胞系中的表达Fig.2 Expressions of UCA1 and miR-145 in ovarian cancer cell linesNote:*.P<0.05,**.P<0.01 vs HOSEpiC group.
2.4沉默UCA1对卵巢癌细胞迁移的影响 Trans-well小室实验结果表明,与miR-145 mock组相比,miR-145 inhibitor组细胞迁移数显著增多(P<0.05),表明miR-145可抑制卵巢癌细胞迁移,而shUCA1组细胞迁移较明显减少(P<0.05),可能与UCA1低表达促进miR-145升高,进而抑制卵巢癌细胞迁移有关;与shUCA1组相比,shUCA1+miR-145 inhibitor组细胞迁移数增多(P<0.05) ,进一步证实下调UCA1可促进miR-145升高,而miR-145 inhibitor抑制miR-145表达,促进卵巢癌细胞迁移,见图5。
2.5UCA1靶向结合miR-145 UCA1基因序列上存在miR-145的结合位点。双荧光素酶报告实验进一步表明,同时转染miR-145和野生型UCA1质粒可显著减弱带有UCA1片段的野生型质粒的荧光素酶活性(P<0.05),UCA1结合位点突变后,同时转染miR-145和野突变型UCA1质粒荧光素酶活性升高。表明UCA1和miR-145间存在靶向调控关系,见图6。
2.6沉默UCA1对卵巢癌细胞增殖和迁移相关蛋白表达的影响 与NC组相比,shUCA1组卵巢癌细胞迁移侵袭相关蛋白MMP-15和MMP-28表达显著降低,与miR-145 mock组及shUCA1组相比,miR-145 inhibitor 组MMP-15和MMP-28表达明显升高,与shUCA1组相比,shUCA1+miR-145 inhibitor组MMP-15和MMP-28表达明显升高。在SK-OV-3细胞株中,敲低UCA1后,PCNA和JunB表达显著降低,而miR-145 inhibitor 组PCNA和JunB表达明显升高,与shUCA1组相比,shUCA1+miR-145 inhibitor组PCNA和JunB表达明显升高。但CyclinD1和CDK2蛋白检测结果却与预期相反,shUCA1 CyclinD1和CDK2组升高,miR-145 inhibitor组显著降低,shUCA1+miR-145 inhibitor组显著升高,提示存在其他信号通路参与UCA1/miR-145调节卵巢癌细胞增殖的过程,有待进一步研究。

图3 UCA1对SK-OV-3细胞miR-145表达的影响Fig.3 Effects of UCA1 on expression of miR-145 of SK-OV-3 cellsNote:A.Overexpression UCA1;B.Silencing UCA1;**.P<0.01 vs pcDNA3.1 group;##.P<0.01 vs shNC group.
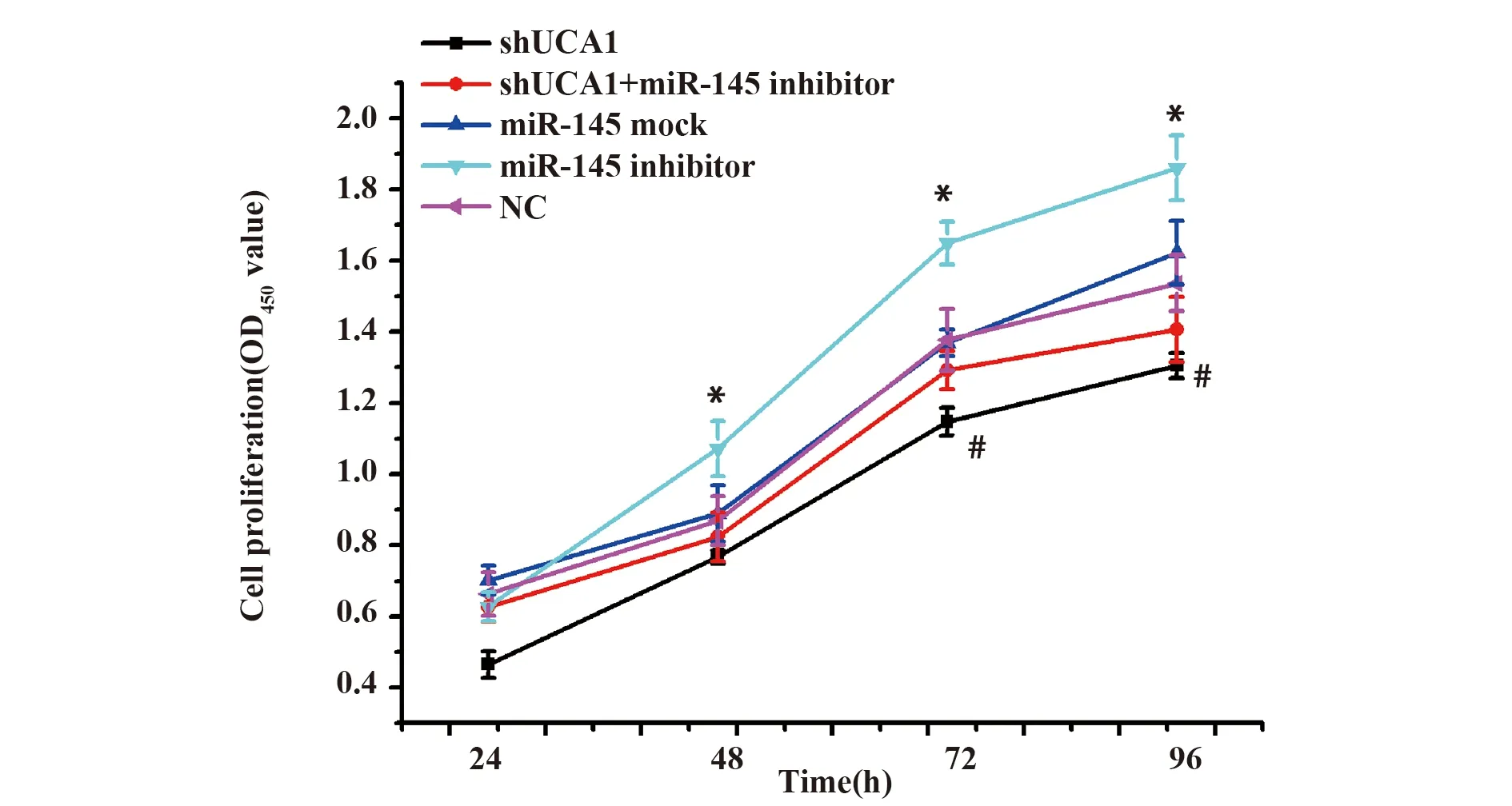
图4 沉默UCA1对卵巢癌细胞增殖的影响Fig.4 Effects of silencing UCA1 on cell proliferation of ovarian cancer cellsNote:*.P<0.05 vs miR-145 mock group;#.P<0.05 vs NC group.

图5 沉默UCA1对卵巢癌细胞迁移的影响
3 讨论
卵巢癌是女性生殖系统发病率、病死率较高的恶性肿瘤,临床治疗方式主要为肿瘤减灭术合并铂类、紫杉醇联合化疗[12,13]。目前肿瘤复发与化疗耐药是卵巢癌临床治疗的重大难题,因此,探究卵巢癌的发生发展机制,寻找新的防治靶点,对改善卵巢癌患者治疗效果及预后至关重要。
朱静等[14]及瞿秋红等[15]研究发现,抑制或过表达编码基因PinX1、B7-H1等可显著影响卵巢癌细胞增殖迁移,为卵巢癌的诊疗提供了重要的分子生物学依据,而非编码RNA是一类不参与蛋白质编码的RNA,根据剪切长度可分为长链非编码RNA和短链非编码RNA。非编码RNA具有多种生物学功能,参与调节基因、蛋白质表达和营养物质代谢,同时参与癌症的发生发展[16-18]。尿路上皮癌相关因子(urothelial carcinoma associated antigen 1,UCA1)位于人染色体19p13.12区域,是膀胱癌中特异性高表达的lncRNA,UCA1在多种癌症中呈高表达,与癌症患者预后呈负相关[19,20]。异常表达的UCA1参与癌症的发生、发展、恶化及药物耐受等病理过程,发挥原癌基因或抑癌基因功能[21]。非编码RNA中的miRNA是lncRNA发挥作用的重要环节,lncRNA可作为结合miRNA的“海绵”,下调miRNA表达发挥作用[22]。研究发现,lncRNA UCA1在卵巢癌中高表达,上调UCA1可在体内外促进卵巢癌细胞增殖、侵袭和远端转移;而miR-145在卵巢癌中呈低表达[7,23]。尚无文献报道UCA1和miR-145在卵巢癌中的靶向关系和具体作用。本研究检测了UCA1和miR-145在多种卵巢癌细胞系中的表达情况,结果提示UCA1在卵巢癌细胞系中的表达水平高于正常卵巢上皮细胞,miR-145的表达水平低于正常卵巢上皮细胞,以SK-OV-3细胞UCA1和miR-145的表达变化最为显著,因此选择SK-OV-3细胞进行后续实验。

图6 UCA1靶向结合miR-145Fig.6 UCA1 targeted combinates with miR-145Note:*.P<0.05 vs UCA1-mut group.
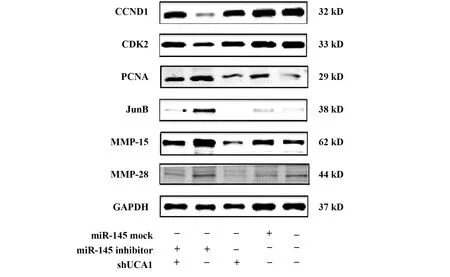
图7 沉默UCA1对卵巢癌细胞增殖和迁移相关蛋白表达的影响Fig.7 Effects of silencing UCA1 on cell proliferation and migration related proteins expressions of ovarian cancer cell
lncRNA UCA1可通过调控多种非编码RNA的表达影响癌症发生发展。UCA1可通过靶向调节miR-193a的表达诱发非小细胞肺癌,还可通过抑制miR-143下调mTOR/STAT3信号通路调节己糖激酶2表达,进而调控膀胱癌细胞的糖代谢[24,25]。研究表明,UCA1还可通过下调miR-193诱导迁移蛋白HMGB1表达,从而促进肺癌细胞和膀胱癌细胞增殖、迁移,促进癌症发生发展[26]。miR-145是抑癌基因,其过表达可降低卵巢癌细胞的增殖和侵袭能力[23]。本研究发现,UCA1在卵巢癌细胞中表达上调,miR-145在卵巢癌细胞中表达下调,UCA1过表达可显著抑制卵巢癌细胞miR-145表达。沉默UCA1可上调卵巢癌细胞miR-145表达,减弱miR-145 inhibitor对miR-145表达的抑制作用,提示UCA1和miR-145可能存在靶向调控关系。为进一步验证UCA1和miR-145的关系,本研究采用starBase网站预测UCA1和miR-145的靶向关系。结果表明,UCA1基因序列上存在miR-145结合位点,且荧光素酶报告实验结果也表明UCA1和miR-145间存在靶向调控关系,提示UCA1可能通过调节miR-145表达影响卵巢癌的发生发展。UCA1过表达可增强卵巢癌细胞的增殖和运动能力,miR-145可通过调节UCA1表达抑制卵巢癌细胞增殖、促进细胞凋亡,UCA1也可能通过ceRNA机制调节miR-145表达,进而调控下游与细胞增殖迁移相关基因表达,影响卵巢癌细胞增殖迁移。研究表明,下调miR-145表达可提高卵巢癌细胞活性,促进FSCN1、CDK6表达[27,28]。课题组将深入探究UCA1是否与miR-145形成ceRNA,进而影响卵巢癌细胞增殖迁移。本实验仅研究了1种miRNA和lncRNA UCA1的关系,UCA1是否和其他miRNA有直接或间接的调控关系,是否共同影响卵巢癌的生物学过程,课题组将进一步研究。
综上所述,本研究提示UCA1 可靶向调节卵巢癌细胞miR-145 表达,沉默 UCA1 可通过诱导 miR-145表达减弱癌细胞增殖和侵袭能力,调控卵巢癌发生发展过程和恶性行为,有可能成为预测卵巢癌进展、预后和监测治疗效果的分子标志物,为阐明卵巢癌的发病机制和防治提供新的思路。
