术前乳腺MRI对乳腺癌保乳手术切缘评估的回顾性分析
2020-12-25凌煜玮王亚军戎冬冬
杨 阳 康 骅 赵 菁 凌煜玮 赵 烨 王亚军 戎冬冬
(1.首都医科大学宣武医院普外科,北京 100053;2.首都医科大学密云教学医院普外一科,北京101500;3.首都医科大学宣武医院放射科,北京 100053)
乳腺癌是女性最常见的恶性肿瘤之一,近年来其发病率逐年上升,发病人群趋于年轻化[1]。手术联合化学药物治疗(以下简称化疗)、放射治疗(以下简称放疗)、内分泌治疗、分子靶向治疗等综合治疗是治疗乳腺癌的主要措施。临床研究[2]显示,接受保乳手术(breast conserving surgery,BCS)+放疗的患者与全乳切除术的患者,在肿瘤复发率和生存率方面差异无统计学意义。因此,保乳手术已成为早期乳腺癌的标准治疗选择之一。然而,按照国内外乳腺癌诊治指南所述标准,并非所有选择保乳手术的患者均能获得保乳手术成功。如何通过术前影像学检查,筛选出适合进行保乳手术的患者,并为其制定更加合理的手术方案,是目前研究的重点。本研究对经临床评估后制定保乳手术治疗方案的患者的资料进行回顾性研究,分析其术前乳腺磁共振成像(magnetic resonance imaging,MRI)、B超(ultrasound,US)、乳腺钼靶(molybdenum target X-ray,MT-X)检查等影像信息与术中和术后病理学信息间的关系,探寻乳腺MRI表现特征与保乳手术切缘的关系,以提高术前评估的准确性,提高保乳手术成功率。
1 资料与方法
1.1 研究对象
回顾性分析2014年1月至2019年9月期间,经粗针穿刺确诊为乳腺癌并于首都医科大学宣武医院普外科住院,按照我国《乳腺癌诊治指南(2013版)》[3]中乳腺癌保乳手术标准和患者意愿确定为保乳手术的乳腺癌患者。收集患者的一般资料、乳腺MRI、乳腺B超、乳腺钼靶、手术中保乳手术冰冻病理切缘的状态、术后病理、临床分期等信息。
1.2 MRI检查方法与影像分析
使用3.0T MRI扫描仪(Verio,Siemens公司,德国)。4通道乳腺专用线圈。患者俯卧位,头先进,双乳自然悬垂于线圈孔内进行扫描。各序列均为轴位,层厚均为4 mm。余参数如下:T2WI采用快速自旋回波序列,并采用频率饱和法脂肪抑制,FOV=340 mm,TR=3 650 ms,TE=61 ms,矩阵=314×320,带宽319 Hz。T1WI采用梯度回波序列,FOV=340 mm,TR=150 ms,TE=2.6 ms,矩阵=269×448,带宽530 Hz。扩散加权成像采用自旋回波-回波平面成像序列,FOV=340 mm,TR=9 700 ms,TE=68 ms,矩阵=64×132,带宽2 104 Hz,扩散弥散系数b值取400 s/mm2和800 s/mm2。动态增强扫描采用三维容积式内插法。FOV=360 mm,TR=4.67 ms,TE=1.66 ms,矩阵=296×384,层厚1.2 mm,带宽=320 Hz,扫描时间59 s,共计扫描6期,总时间5 min 54 s。扫描完成后应用Mean-Curve软件进行图像处理。经两名诊断医师联合阅片,在平扫及增强影像上,对病灶的数量、形态、大小、边缘情况、位置进行分析,并对病灶强化特点、周围组织强化、病灶周围血管征象等情况进行观察。
MRI检查参考《磁共振成像乳腺影像报告与数据系统(第5版,2013年)》[4](Breast imaging-reporting and data system-MRI,BI-RADS MRI)根据主病灶形态[肿块型(MASS);非肿块型(NME)],肿块型病灶周围是否存在其他病变情况[未见其他病灶(MASS &absent);存在其他病灶(MASS &present)],肿块型病灶形态(不规则;类圆形),肿块型病灶边缘状态(清晰、分叶;模糊、毛刺),肿块型病灶强化特点(边缘强化、环形强化;均匀强化;不均匀强化)以及时间-强度(time-intensity curve,TIC)曲线(流入型Type I;平台型Type II;流出型Type III)进行分组,并记录主病灶最大直径(MRImd)。在最大密度投影(maximal intensity projection,MIP)中对病灶周围血管征象(双侧未见;双侧对称;仅患侧线样;仅患侧多发点状)进行分组,参考图1示例。

图1 MIP序列中病灶周围血管征象分组示例Fig.1 Examples of grouping adjacent vessel signs on MIPA: none;B: symmetric;C:linear;D: multiple punctate;MIP:maximal intensity projection.
1.3 超声检查方法与影像分析
采用Philip IU 22超声诊断仪,探头频率7~10 MHz,设置为乳腺条件,深度设置为3.5~5.0 cm,取仰卧位,双臂上举,充分暴露乳腺及腋窝。超声检查内容包括大小、形态,边缘,有无明显肿大腋窝淋巴结等。
乳腺B超检出根据病灶数量(单灶;多灶),病变边缘(清晰;欠清晰;毛刺,伪足)进行分组,并记录B超测量的主病灶最大直径(USmd)。
1.4 钼靶检查方法与影像分析
采用全数字化乳腺DR系统(Mammomat Novation DR,Siemens公司,德国)进行乳腺摄影检查。采用全自动曝光方式。其探测器大小为35 cm×52 cm×11 cm,成像区大小为24 cm×29 cm,图像最大矩阵为3 328×4 096 像素,像素深度为14 bit。重点观察病灶位置、形态、大小、边缘、钙化等特征。
乳腺钼靶摄影检查依据形态(肿块型;不规则密度增高影;高密度结节影;无征象),边缘(模糊、清晰、毛刺)进行分组,记录钼靶下病灶最大直径(MT-Xmd)。
1.5 保乳手术方法与病理学检查
参照2013年《NCCN指南》[5]及中国抗癌协会《乳腺癌诊治指南与规范》[3],本组保乳手术的适应证及禁忌证分别如下:
保乳适应证:①原发肿瘤,最大径<5.0 cm。②切除肿瘤与乳房体积比≤20%,无多病灶。③钼靶显示无弥漫钙化病灶。④腋窝无明显肿大淋巴结,或仅有孤立、最大径<2.0 cm的肿大淋巴结。⑤患者有保乳意愿。
保乳禁忌证:①小型乳房(乳房体积<200 mL),手术切除后无法保证良好外观者。②腋窝多发淋巴结转移。③有胶原血管疾病、系统性红斑狼疮等疾病。④妊娠期或哺乳期。⑤患侧乳房胸壁曾接受过放疗。
术中行肿瘤局部扩大切除后,取残腔四周组织送手术切缘冰冻病理,手术切除肿瘤标本用缝线标记四个切缘。如冰冻病理切缘两次阳性,则改行乳房切除术。临床评估腋窝淋巴结阴性者,用美蓝染色法和荧光法行腋窝前哨淋巴结活检,前哨淋巴结活检阳性者行腋窝淋巴结清扫。所有标本均行石蜡病理检查,由病理科主治医师和高级职称医师进行阅片,做出报告。术后根据临床病理分型,遵照2013年《NCCN指南》和中国《乳腺癌诊治指南与规范》予以化疗和放疗;激素受体阳性患者给予内分泌治疗;Her-2阳性患者建议赫赛汀靶向治疗。
1.6 统计学方法
采用SPSS 22.0软件,计量资料组间比较应用t检验及秩和检验。计数资料组间比较采用χ2检验。多因素Logistics回归分析研究影像学、病理学特征对手术切缘状态的影响。所有统计学结果,均以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
本研究共入组病例236例。均为女性。年龄31~86岁,平均年龄(57.60±11.70)岁。切缘阳性组(n=39)年龄(57.62±15.14)岁,切缘阴性组(n=197)年龄(57.59±10.95)岁,组间差异无统计学意义(t=-0.010,P=0.992)。
所有患者术前均进行乳腺动态增强MRI检查及乳腺B超检查,207名患者术前于首都医科大学宣武医院行乳腺钼靶检查(其余29例为外院检查,资料缺失)。根据保乳成功与否分为保乳成功组(BCS)与保乳失败组(MT)。保乳成功共计211例,失败25例,保乳成功率为89.41%。
根据术中切缘冰冻病理及术后病理结果,将所有患者分为切缘阳性组(M+)与切缘阴性组(M-)。分组情况如图2。切缘阳性组共计39例,其中,首次切缘冰冻病理阴性但术后石蜡病理证实切缘阳性者8例;首次切缘冰冻病理阳性,二次切缘冰冻病理阳性者17例,阴性者14例。
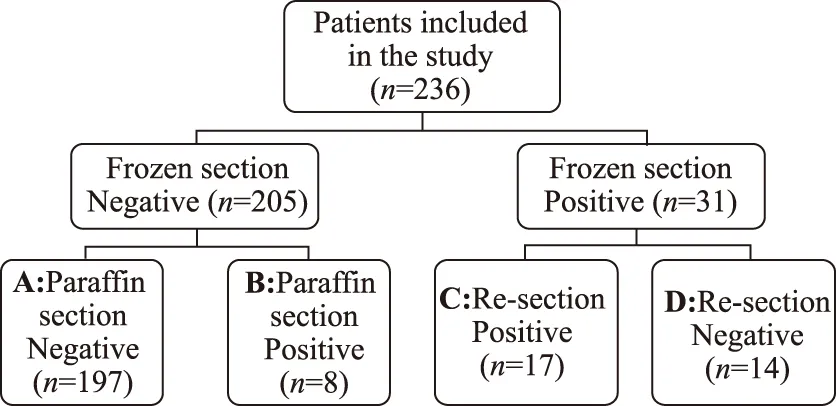
图2 患者分组情况Fig.2 Grouping of patientsA: M-group,n=197;B+C+D: M+ group,n=39;B+C: MT group,n=25;A+D: BCS group,n=211;BCS:breast conserving surgery.
2.2 不同影像学方法的检出情况
236例患者均因超声发现病灶行穿刺证实为乳腺癌。故仅对MRI与钼靶的检出率进行比较。所有病例均于术前行MRI检查,均发现病灶,检出率为100%。术前于首都医科大学宣武医院行钼靶检查共计207例,其中检出181例,检出率为87.44%。
2.3 不同影像学方法对病灶大小的评估
对肿瘤大小的测量值行正态性检验,发现其属于偏态分布,故对采用不同影像学方法测得的肿瘤大小的值分别与病理测量值进行Spearman相关分析。各影像学方法与病理之间均呈现出中等程度的相关性。乳腺MRI与病理测量值的相关系数为0.577,略高于超声和钼靶的相关系数(分别为0.529、0460)。但相关系数95%可信区间存在重叠,差异无统计学意义。详见表1。
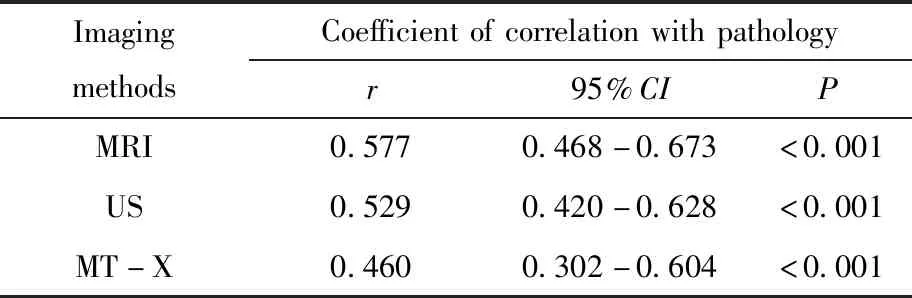
表1 不同影像学方法与病理测量结果间相关性比较Tab.1 Comparison of correlation between different imaging methods and pathological measurement results
以病理测量值的最大径(Pathmd)作为标准,分为T1组(≤2 cm)和T2组(>2 cm),对各种影像学方法测量的病灶最大径分别与病理测量结果进行比较。因钼靶检查中有明确测量结果者138例,故仅对此138例进行分析。经秩和检验,T1组(n=91)中MRI组及钼靶组的P值分别为P<0.001,P=0.015。同时T2组(n=47)中的B超及钼靶组的P值分别为P<0.001,P=0.001。详见表2。

表2 MRI、B超、钼靶对乳腺癌大小测量与病理结果的比较Tab.2 Comparison of lesion size measured with different imaging methods and pathology cm
2.4 手术切缘状态与MRI、超声及钼靶影像学检查征象的关系
保乳手术切缘状态与乳腺MRI中病灶形态、病灶周围血管征象有关(P<0.001)。与肿块型病灶形态、肿块型病灶边缘、肿块型病灶强化特点、TIC曲线类型无关(P>0.05)。在病灶形态分组中,NME亚组的切缘阳性率为60.0%,MASS &present亚组的切缘阳性率为45.5%,高于MASS &absent亚组的1.9%。在病灶周围血管征象分组中,患侧多发点状亚组的切缘阳性率为73.9%,高于其他亚组(双侧未见8.6%,双侧对称18.2%,仅病灶侧线样9.2%)。详见表3。
表3 MRI影像学特点与保乳手术切缘状态分析Tab.3 Analysis of MRI characteristics and BCS margin status
保乳手术切缘状态与乳腺B超检查中的病灶数量(单发、多发)有关(P=0.028),与病灶边缘类型(清晰,欠清晰,毛刺、伪足)无关,各亚组间差异无统计学意义(P>0.05)。详见表4。
表4 B超影像学特点与保乳手术切缘状态分析Tab.4 Analysis of US characteristics and BCS margin status
通过对乳腺钼靶影像研究,发现保乳手术切缘状态与钼靶影像中病灶形态(肿块、不规则高密度影、高密度结节影、无征象)、病灶边缘(模糊、清晰、毛刺)无关。各亚组间差异无统计学意义(P>0.05)。详见表5。
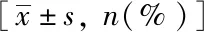
表5 钼靶影像学特点与保乳手术切缘状态分析Tab.5 Analysis of MT-X characteristics and BCS margin status
2.5 病理学信息与手术切缘状态的关系
术后石蜡病理证实:原位癌23例。非特殊型浸润性癌174例。其他类型浸润性乳腺癌39例(黏液癌8例,髓样癌9例,乳头状癌7例,混合型癌2例,大汗腺癌1例,小管癌2例,神经内分泌癌1例,小叶癌8例,化生性癌1例)。分子分型:Luminal A型(Ki-67≤14%):48例(20.34%);Luminal B型(HER-2阴性):132例(55.93%);Luminal B型(HER-2阳性):32例(13.56%);HER-2过表达型(HR阴性):9例(3.81%);三阴性乳腺癌(triple negative breast cancer,TNBC):15例(6.36%)。
Luminal A型、Luminal B型(HER-2阴性)、Luminal B型(HER-2阳性)、HER-2过表达型(HR阴性)、三阴性乳腺癌(TNBC)的手术切缘阳性率分别为:12.5%(6/48),14.4%(19/132),21.9%(7/32),66.7%(6/9),6.7%(1/15)。组间差异存在统计学意义(P=0.001)。在HER-2状态分组中,HER-2阴性与HER-2阳性,组间差异有统计学意义(P=0.004)。
此外,切缘阴性组与阳性组病理测量值最大径分别为(1.888±0.792)cm,(2.305±1.062)cm。经t检验,组间差异存在统计学意义(P=0.005)。详见表6。余病理学信息差异无统计学意义。
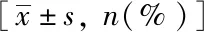
表6 病理学信息与保乳手术切缘状态分析Tab.6 Analysis of pathology and BCS margin status
2.6 导致手术切缘阳性的多因素分析
将上述差异有统计学意义的因素(MRI的病灶形态、MRI病灶周围血管征象、B超病灶数量、病灶大小、分子分型、HER-2状态),进行多因素Logistic回归分析。结果显示,对于Luminal A型乳腺癌,HER-2过表达型(HR阴性)乳腺癌保乳手术中手术切缘阳性的发生概率是前者的23.170倍,(95%CI:1.823~294.504)。相对于MRI上MASS &absent型,MASS &present型其保乳手术切缘阳性率的发生概率是前者的39.472倍(95%CI:9.835~158.421);而NME型,其手术切缘阳性率的发生概率是MASS &absent型者的56.722倍(95%CI:7.908~406.838)。相对于双侧未见明显血管征象患者。仅患侧存在多发点状征象者,其手术切缘阳性率的发生概率是前者的24.076倍(95%CI:4.979~116.413);详见表7。

表7 保乳手术切缘阳性危险因素的多因素Logistic回归分析Tab.7 Multivariate Logistic regression analysis for factors associated with positive margins of BCS
多因素分析的曲线下面积(area under the curve ,AUC)值为0.914(95%CI:0.845~0.984)。手术切缘阳性预测值为59.32%(35/59),阴性预测值为97.74%(173/177)。ROC曲线见图3。
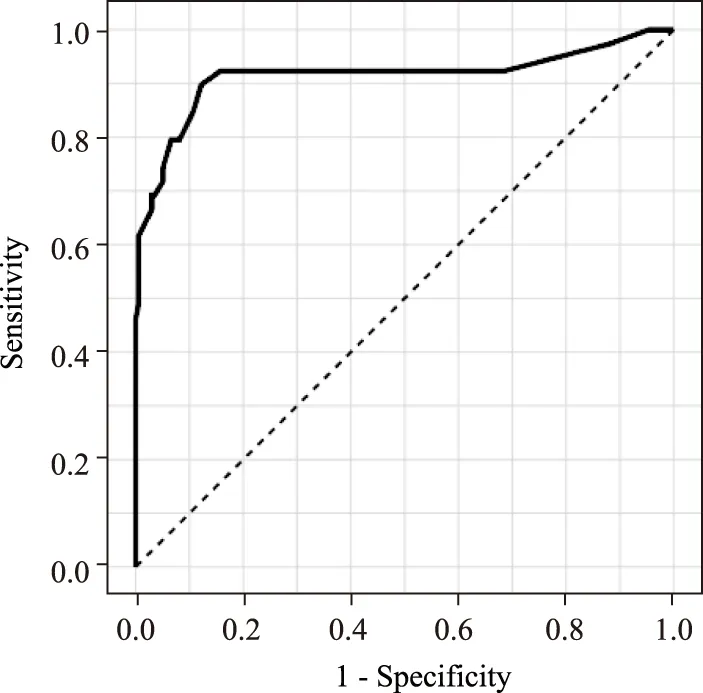
图3 多因素模型ROC曲线图Fig.3 The ROC curve for the multivariate modelROC:receiver operating characteristic.
2.7 MRI影像特征与保乳手术成功与否的关系
依照上述MRI影像上的切缘阳性危险因素,对患者进行分组。无危险因素的手术为低危组(图4A)。存在任一危险因素及以上者(即MASS &present或NME或仅患侧病灶周围存在多发点状血管征象)为高危组(图4B)。与保乳手术是否成功进行卡方检验。发现低危组患者的保乳手术成功率为98.7%。其保乳手术成功率显著高于高危组患者(P<0.001)。详见表8。

图4 低危组与高危组的MRI表现示例Fig.4 Examples of MRI images in low-risk and high-risk groupsA: examples of MRI images in low-risk patients;B: examples of MRI images in high-risk patients (Including any of the following risk factors:“MASS &present” type,“NME” type,the present of adjacent multiple punctate vessel signs on breast MRI).The patient was “MASS &present” type,and there were multiple punctate vessel signs. MRI: magnetic resonance imaging; NME:non-mass enhancement.

表8 MRI影像上切缘阳性危险因素与保乳手术成功与否的分析Tab.8 Analysis of risk factors of positive margin on MRI and breast conserving n(%)
3 讨论
3.1 乳腺MRI的特点及优势
乳腺癌是一类激素依赖性疾病,并且与血管生成密切相关。随肿瘤生长,其血管通透性明显升高。乳腺增强MRI检查对软组织有较高的分辨能力[6]。检查中应用的顺磁性对比剂钆喷酸葡胺(gadopentetic acid,Gd-DTPA)可快速扩散至血管外-细胞外间隙,通过肿瘤内部大量存在的动静脉瘘,迅速地从肿瘤内流出,达到分布平衡。继而增加了病灶与周围组织的对比度,清晰的显示肿瘤的形态、边缘。并且显示出病灶的血管灌注情况、血管生成程度[7]。
保乳手术术中切缘阳性是术后局部复发的主要因素[8]。保乳手术能否成功实施,关键因素就是如何确保切缘阴性。因此,术前的影像学评估至关重要。乳腺B超及乳腺钼靶检查已经成为乳腺癌常规的检查及筛查手段[9]。但是,超声检查受检查医师个人经验及操作手法的影响,对病变的筛查、结果的判读存在较大误差,且对微小钙化的诊断不如乳腺钼靶检查敏感[10]。而在钼靶检查时,需要对乳房进行压迫变形,以便获得乳腺组织的二维重叠影像,这导致了钼靶受到腺体致密程度影响较大,部分微小病灶可能因影像的重叠而被掩盖。研究[11]表明,我国女性乳腺腺体相对于欧美女性更为致密。因此根据我国乳腺癌流行病学的特点,在《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[12]中,建议40岁以上致密型乳腺,应行多种检查联合进行筛查。已有报道[13-14]显示,乳腺MRI对浸润性乳腺癌的检出率灵敏度可高达90%以上。
3.2 乳腺MRI在保乳手术中的价值
已有研究[15]表明,常规超声及钼靶检查,对多灶性或多中心性乳腺癌诊断的准确性较低,其保乳手术切缘阳性率及保乳失败率也较高。通过MRI检查,可以细致观察病灶的形态、强化特点、血供情况,同时还可以观察整个乳腺内部其他部位的情况。在病灶周围组织是否受到肿瘤侵犯的评估上,乳腺MRI可以提供一定的参考价值。美国放射学院在BI-RADS MRI系统中对病灶形态、特点进行了较为详细的分类[16]。在这一基础上,笔者对病灶形态进行了简化分类。研究显示,在MRI检查中,肿块型病灶且周围存在其他病变(MASS &present)以及病灶呈非肿块型强化(NME)的类型,比肿块型且周围不存在其他病变的类型(MASS &absent)的手术切缘阳性率要高。这表明对于MASS &absent型的乳腺癌,可能更适合进行保乳手术。对于前2种类型的患者在选择保乳手术时应更加慎重,因为这些类型的乳腺癌病灶可能呈多灶性或多中心性。同时在MRI的MIP成像中,患侧病灶周围存在多发点状征象,是保乳手术切缘阳性的危险因素。众所周知,乳腺肿瘤生长依赖新血管生成为其提供营养。在Dietzel等[17]的研究中证实,周围血管征象(adjacent vessel sign,AVS)在恶性病变中比良性病变更常见,其特异度为88%,阳性预测值为85%。此外,相比浸润性导管癌,AVS在原位癌中出现的频率更低(27%vs54%)。这也表明AVS征象与肿瘤周围组织浸润有关。同时在本研究中还发现,在切缘阴性组与切缘阳性组中,病理测量值的最大径存在差异。但在后续Logistics回归检验中,肿瘤大小不是切缘阳性的独立危险因素。但在Kang等[18]的研究中发现,乳腺肿瘤的大小,对保乳手术的成功率、手术切缘状态有显著影响。这可能与本研究中样本量较小、纳入较大肿瘤的病例数少、测量方法及测量误差有关。无论肿瘤大小是否是保乳手术切缘阳性的危险因素,术前准确的评估肿瘤大小都是十分必要的。经对比研究发现,在不同大小的肿瘤测量上,乳腺MRI、乳腺超声、乳腺钼靶与病理测量结果间的一致性存在差异。对于病理≤2cm的乳腺癌,乳腺B超的测量值与病理测量值之间差异无统计学意义(P=0.361),而MRI、钼靶的测量值与病理测量值之间差异存在统计学意义(P<0.001,P=0.015)。但对于病理大小>2cm的乳腺癌,乳腺MRI的测量值与病理测量值之间的差异无统计学意义(P=0.227),而B超及钼靶差异均存在统计学意义(P<0.001,P=0.001)。这表明在较大的肿瘤的评估上,相对于乳腺B超及乳腺钼靶,乳腺MRI的测量可能更加准确。而B超、钼靶检查,均低估了肿瘤的大小(2.100,2.100vs2.500)。这与Gruber等[19]和Shoma等[20]的研究结果相一致。而在较小的肿瘤评估上,MRI可能会高估肿瘤大小(1.700vs1.500)。这可能与测量时包含了肿瘤周围的血管影像有关。
在本研究中,在B超及钼靶影像中的病灶形态与边缘情况与手术切缘阳性无关。这可能是因为,这些影像学特点描述的是紧邻肿物周围组织的情况。而保乳手术并非紧邻病灶进行切除,故这些影像学特点对手术切缘影响较小。但在既往的研究[21]中发现,一些远离病灶的影像学特点,如腋窝淋巴结转移、存在弥漫性或微小钙化是影响切缘阳性的因素。
总之,术前联合乳腺MRI检查,可以有助于发现微小病灶,准确评估病灶侵犯范围,为制定更为合理的手术切除范围或手术方案提供了一定的参考价值,进而降低术中切缘阳性率、保乳失败率、二次手术等风险,可能在降低术后局部复发率方面起到有益作用。
3.3 乳腺MRI在指导保乳手术方面的优势、不足及前景
乳腺MRI可以提供良好的软组织分辨能力,检查时更接近自然下垂状态,避免挤压而导致病灶位置、大小改变[22-23]。多种序列影像联合评估,可更准确预测病灶周围是否受到肿瘤侵犯,提高保乳成功率。然而MRI仪器及检查费用昂贵,可能会增加患者的经济负担。同时检查时间长,需患者屏气配合,成像质量容易受到呼吸的影响。此外,影像学特征主要为肿瘤的宏观结构的表现。而宏观结构的特点与微观结构、生物学特性等因素相关[24]。已有研究[25-26]表明,不同分子分型之间存在不同的生物学特性,但肿瘤组织内存在着异质性,因此不同的亚型间在影像上可能有着相同或类似的表现。这可能是MRI检查灵敏度虽然高,但特异度较低的原因。
本研究存在一定的局限性。首先,本研究是一项回顾性研究。无法控制对病例选择上的潜在偏倚。其次,按现有指南进行保乳手术时,其手术切缘阴性率及成功率已经较高,导致分组间的样本含量差距较大。同时部分类别的样本量较小。如HER-2过表达型(HR阴性)病例数仅9例。因此需要更多的数据来进一步证实。这也是在对保乳手术成功与否进行分析时,未加入病理因素的原因之一。在手术切缘预测模型中,其阳性预测值为59.32%,结果并不理想。但切缘阴性预测值为97.74%。同时通过对MRI影像上的危险因素与保乳手术是否成功进行分析,发现低危组患者的保乳手术成功率明显高于高危组患者,两组保乳手术成功率分别为98.7%和71.6%。这一结果将给予临床医师一定的帮助及参考价值,以筛选出适合进行保乳手术的乳腺癌患者。
MRI检查可以提供大量的关于病灶的数据和多种不同的影像[27]。利用后期软件进行数据计算[28],也许能帮助我们更加细致的了解乳腺肿瘤的微小结构。今后有必要进行进一步、大样本研究,以探究不同肿瘤生物学特性与影像表现间的关系。此外,伴随着MRI检查简化序列的探索,结合图像数字化处理、人工智能的发展及应用,能进一步发挥其优势,扩展MRI的应用范围[29]。同时联合其他检查,应用大数据支持,可以进一步减低人为因素影响,更加准确的评估病灶情况,从而帮助临床医师为患者制定更为合理的治疗方案。
