马立克氏病病毒贵州株meq基因的克隆及遗传进化分析
2020-12-25张喜懿温贵兰欧德渊张小波汪德生刘蔓蔓
张喜懿, 温贵兰*, 欧德渊, 陈 广, 张小波, 汪德生, 文 明, 胡 璇, 孙 芸, 刘蔓蔓
(1. 贵州大学动物科学学院,贵州 贵阳 550025; 2. 贵州省动物生物制品工程技术研究中心,贵州 贵阳 550016)
马立克病(Marek’s disease,MD)是由马立克病病毒 (Marek’s disease virus,MDV)引起鸡的1种淋巴组织增生性疾病,其特征是病鸡的外周神经、虹膜、各内脏器官形成肿瘤病灶[1]。Josebp Marek于1907年首次报道该病,Campbell J G等1961年正式将该病命名为鸡马立克氏病[2]。Churchill A E等[3]1967年首次从接种病鸡细胞的培养物中分离出MDV。此后世界各地相继报道有马立克病的发生和流行,给养禽业造成严重的经济损失[4]。MDV共有3种血清型,即血清1型(MDV-1)、血清2型 (MDV-2)、血清3型 (MDV-3),但只有MDV-1可致瘤或致病[5]。根据MDV-1致病性的强弱,又可将其分为温和型(mild MDV,mMDV)、强毒型(virulent MDV,vMDV)、超强毒型(very virulent MDV,vvMDV)、特超强毒MDV(very virulent plus MDV,vv+MDV)[6]。相关研究表明,与MDV致肿瘤相关的基因有meq、132-bpr、pp38/pp24、v-IL8等,而132-bpr基因与Meq基因是MDV-1所特有的,其中meq基因是公认的主要致瘤基因,与MDV-1强弱毒株致瘤性的不同有关[7,8]。本试验从疑似MD贵州矮脚黄鸡的肝脏病料中扩增出MDVmeq基因片段,并对该片段进行克隆及遗传进化分析,为丰富贵州省MDV毒株信息库及防控MD提供参考。
1 材料
1.1 检测病料肝脏病料采自贵阳市某养殖场饲养的疑似MD矮脚黄鸡,保存于贵州大学预防兽医学实验室(-80 ℃冰箱)。
1.2 主要试剂琼脂糖凝胶DNA回收试剂盒、病毒基因组DNA/RNA 提取试剂盒[购自天根生化科技(北京)有限公司],HiFi-Script cDNA第一链合成试剂盒(购自康为世纪生物科技有限公司),质粒提取试剂盒、2×ESTaqDNA Mix、pMD19-T Vector、DL 2 000 DNA Marker、DL 5 000 DNA Marker[购自宝生物工程(大连)有限公司],大肠杆菌DH5α感受态细胞(购自上海碧云天生物技术有限公司)。
1.3 主要仪器电泳槽(DYCZ-HOB型)、电泳仪电源(DYCZ-8C型)(购自北京市六一仪器厂),SYGENE电泳凝胶成像仪(购自GENE公司),多功能梯度PCR仪(VeritiTm 96-Well Thermal Cycler)(购自ABI公司),37 ℃隔水式电热恒温培养箱(BD53)(购自BINDER公司)。
2 方法
2.1 引物信息参考GXY2株meq基因(GenBank登录号:EF546430)设计MDVmeq,引物由生工生物工程(上海)股份有限公司合成。引物信息见表1。
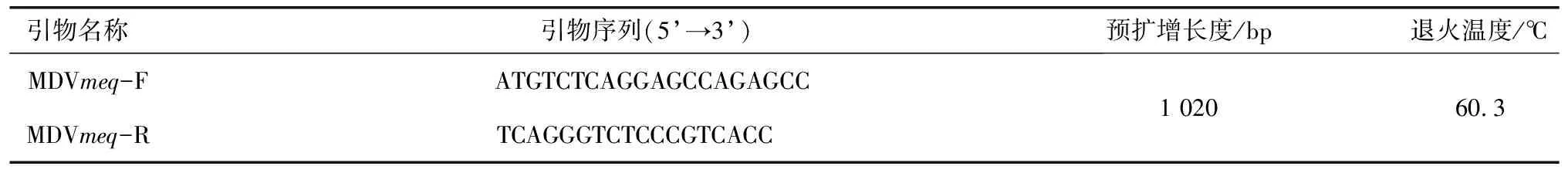
表1 引物信息
2.2 MDV核酸PCR检测根据病毒基因组DNA/RNA提取试剂盒说明书分别提取总DNA和总RNA,再根据HiFi-Script cDNA第一链合成试剂盒将总RNA反转录为cDNA备用。使用MDVmeq特异引物对核酸样品进行PCR扩增。总反应体系20 μL:上、下游引物(10 mol/μL)各1.0 μL,2×ESTaqDNA聚合酶10 μL,核酸2 μL,ddH2O 6 μL。反应条件:94 ℃ 预变性2 min;94 ℃ 变性45 s,60.3 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃再延伸10 min。PCR产物于1.0%琼脂糖凝胶中电泳检测。
2.3 MDVmeq基因克隆将MDVmeq的PCR产物进行胶回收,连接到pMD19-T载体,转化至大肠杆菌DH5α感受态细胞,转化细胞接种于LB固体培养基,37 ℃培养箱中倒置培养16~24 h至长出菌落,挑取6个单菌落接种于含氨苄青霉素(50 mg/mL)的LB液体培养基,于37 ℃ 170 r/min培养12~16 h。取培养的克隆菌液2 μL进行PCR鉴定(反应体系及条件同2.2),提取阳性克隆菌液质粒送华大基因测序。
2.4 MDVmeq基因遗传进化分析将测序结果与GenBank中已有序列进行比对,利用MegAlign软件分析其同源性、氨基酸缺失位点,并构建遗传进化树。参考毒株信息见表2。

表2 MDV meq基因参考毒株信息
3 结果
3.1 MDV核酸检测结果由图1可见:经PCR扩增,于1 020 bp处出现MDVmeq基因特异扩增条带,长度与预扩增片段相符,表明病鸡存在MDV感染,将该片段命名为MDV GZ 2019meq。
3.2 MDVmeq基因克隆菌液PCR鉴定结果由图2可见:各克隆菌液在1 020 bp处均出现特异扩增条带,与目的基因大小相符。
3.3 MDV GZ 2019meq基因同源性分析测序结果显示MDV GZ 2019meq基因全长1 020 bp,共编码339个氨基酸,将其与GenBank登录的10株MDV参考株的meq基因进行核苷酸序列、推导氨基酸序列同源性比对。由图3可见:MDV GZ 2019meq基因与参考毒株的核苷酸同源性为98.7%~99.8%。其与国内特超强毒MDV分离株GXY2株的同源性最高(99.8%),与国内强毒MDV分离株J-1株、美国特超强毒MDV分离株648A株的同源性最低(98.7%)。由图4可见:MDV GZ 2019meq基因与参考毒株的推导氨基酸同源性为96.7%~99.4%。其与国内特超强毒MDV分离株GXY2株的同源性最高(99.4%),与荷兰温和型MDV分离株CVI988株的同源性最低(96.7%)。
3.4 MDV GZ 2019meq基因核苷酸序列遗传进化树分析由图5可见:MDV GZ 2019meq基因与国内特超强毒MDV分离株GXY2株的亲缘关系最近,与美国特超强毒MDV分离株TK株、N株、648A株的亲缘关系最远。
3.5 MDV GZ 2019meq基因推导氨基酸序列分析将MDV GZ 2019meq基因推导氨基酸序列与GXY2等10株参考毒株进行比对,发现共有5个突变位点,分别为第63位(R→G)、第80位(D→Y)、第139位(T→A)、第176位(P→R)、第217位(P→A)(见图6)。除第63位氨基酸突变是MDV GZ 2019meq基因所独有以外,其余突变位点与国内特超强毒MDV分离株GXY2株完全一致。
4 讨论
4.1meq基因是MDV-1中特有的主要致肿瘤基因,关于该基因的国内外报道较多,但其致瘤机制目前仍不清楚[9]。meq基因相对保守,在不同致病力毒株之间其核苷酸和氨基酸序列的同源性均较高。本试验中MDV GZ 2019meq基因的核苷酸、推导氨基酸同源性分析结果表明,其与10株不同致病力MDV参考毒株的核苷酸序列和推导氨基酸序列同源性分别为98.7%~99.8%、96.7%~99.4%。强毒株MDVmeq基因全长1 020 bp,编码339个氨基酸;而疫苗弱毒株(如CVI988株、814株)的meq基因在第575~577位有3个碱基缺失(即CAC),导致了1个脯氨酸的缺失[10]。本试验分离的MDV GZ 2019meq基因长度为1 020 bp,在第575~577位不存在碱基缺失,与大部分强毒株的特性一致,说明其具有强毒株的特征。
4.2相关文献报道,低致病力MDV毒株具有脯氨酸重复区,而强毒株第153位、176位、217位的脯氨酸存在突变,破坏了meq基因原有的脯氨酸重复区,导致了致病力的变化[11]。本试验中MDV GZ 2019meq基因共有5个氨基酸突变位点,分别在第63位(R→G)、第80位(D→Y)、第139位(T→A)、第176位(P→R)、第217位(P→A),其中第176位和217位氨基酸的突变破坏了脯氨酸重复区,具有强毒株特性;此外,除第63位氨基酸突变是MDV GZ 2019meq基因所独有以外,其余突变位点均与国内特超强毒MDV分离株GXY2株完全一致,故推测其为强毒株。
5 结论
本试验从疑似MD贵州矮脚黄鸡的肝脏病料中扩增出MDVmeq基因,并进行克隆及序列分析,发现该基因长度为1 020 bp,可编码339个氨基酸;与国内特超强毒MDV分离株GXY2株的核苷酸序列同源性高达99.8%;存在5个氨基酸突变位点,除第63位突变是MDV GZ 2019meq基因所独有以外,其余突变位点均与国内特超强毒MDV分离株GXY2株完全一致,推测其为强毒株,具体致病性强弱还需进一步研究。
