射波刀治疗周围型非小细胞肺癌中金标位移统计分析
2020-12-24于旭耀王煜雯袁智勇宋勇春
于旭耀,王煜雯,袁智勇,宋勇春,张 华,董 洋,王 平
(1.天津医科大学肿瘤医院放疗科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,天津300060;2.天津医科大学肿瘤医院空港医院放疗科,天津300300;3.天津医科大学肿瘤医院肺部肿瘤科,天津300060)
0 引言
立体定向体部放疗(stereotactic body radiation therapy,SBRT)可使肿瘤患者病灶区域接受高辐射剂量,同时降低其周围正常组织、器官的受照射剂量,提高肿瘤的局部控制率及疗效,已成为早期非小细胞肺癌(non-small cell lung cancer,NSCLC)的主要临床治疗手段之一[1-2]。而NSCLC 患者肺部肿瘤及其周围正常组织、器官随呼吸具有一定运动特性,因此,在进行NSCLC 患者SBRT 靶区勾画及治疗计划设计时,需重点关注肺部肿瘤及其周围正常组织、器官呼吸运动对临床治疗的影响[3]。采用射波刀(Cyberknife,CK)系统进行NSCLC 患者SBRT 治疗时,一般需要在治疗前对患者肺部肿瘤植入金标,且在治疗过程中通过双平面正交投影X 射线成像系统获取金标位置(即肿瘤位置),并结合患者体表红外发生器检测所得呼吸信号进行呼吸同步动态照射,以提高治疗精度,降低肺部正常组织、器官的受照损伤[4-7]。
本研究回顾性分析天津医科大学肿瘤医院射波刀中心收治的300 例周围型NSCLC 患者治疗过程中采集所得金标位置信息的日志文件,提取并分类统计分析患者呼吸引起金标在三维方向上的平移数据,为周围型NSCLC 患者SBRT 靶区范围的确定及其临床呼吸运动追踪治疗参数设定提供参考。
1 资料与方法
1.1 临床资料
选取2017 年1 月至2019 年12 月于天津医科大学肿瘤医院接受射波刀SBRT 治疗的200 例周围型NSCLC 患者,其中男性106 例、女性94 例;年龄40~79 岁,中位年龄54.6 岁。纳入标准:(1)首次经临床影像和病理确诊为原发周围型NSCLC;(2)KPS 评分≥70 分;(3)三级支气管以下。排除标准:(1)患者患有其他躯体性疾病;(2)出现其他远端转移病灶。患者均在CT 引导下进行肺部肿瘤的金标植入及病变组织活检,其中鳞癌45 例(22.50%)、腺癌138 例(69.00%)、腺鳞癌17 例(8.50%)。采用射波刀SBRT在3~7 次(中位5 次)内给予靶区4 200~6 000 cGy 剂量(中位5 500 cGy)。本研究经天津医科大学肿瘤医院伦理委员会批准,已取得患者的知情同意并签署知情同意书。
1.2 金标植入及确认
在CT 引导下采用18G 穿刺针对患者肺部肿瘤植入1~3 粒金标,金标采用纯度为99.9%的黄金制成,圆柱直径为0.7~0.9 mm,长度为5 mm。200 例患者植入金标1 周后,进行CT 扫描确认金标位置及患者是否发生气胸现象。
1.3 治疗曝光条件
如图1 所示,采用射波刀系统对周围型NSCLC患者进行SBRT 治疗时,射波刀靶区定位系统(target location system,TLS)采用实时正交X 射线成像获取金标影像并与治疗计划生成的数字重建图像(digitally reconstructed radiograph,DRR)进行比对,从而得到金标位置信息,实现对患者呼吸过程中肿瘤位置的实时追踪。

图1 射波刀靶区定位系统采用正交X 射线成像进行患者肺部肿瘤内金标实时定位
由于每个周围型NSCLC 患者的肿瘤及其内部金标位置不同,采用射波刀系统进行呼吸运动(Sychony)追踪治疗时正交X 射线成像所选取的曝光条件差异较大,所以本研究中X 射线成像参数选择电压40~125 kV、电流50~250 mA、曝光时间30~50 ms[6]。
1.4 数据获取
射波刀系统通过正交X 射线成像获得金标头脚(I/S)方向、左右(L/R)方向和前后(A/P)方向位置数据并保存治疗日志文件[8]。
1.5 统计学方法
根据肿瘤靶区在患者肺部分布情况及其体积大小(<100 mL、100~200 mL 和>200 mL)对200 例周围型NSCLC 患者金标动度进行分类研究。金标位移数据用均值±标准差(±s)表示,采用SPSS 19.0 软件进行配对样本t 检验,P<0.05 为差异有统计学意义。
2 结果
根据肿瘤在肺部分布位置不同及其体积大小,对300 例患者的肺部金标位移信息进行分类统计,结果见表1。由表1 可以看出,射波刀SBRT 治疗过程中肿瘤内部金标位移幅度总体上I/S 方向>A/P 方向>L/R 方向。金标位移与其所在肿瘤位置及体积相关,且肿瘤位置是决定金标位移幅度大小的主要因素,位于肺下叶肿瘤内部的金标位移幅度要大于肺上叶和肺中叶的2 倍以上,其中位于肺下叶且体积<100 mL 的肿瘤内的金标在L/R 方向上的位移幅度[(26.29±9.89)mm]最大,是位于肺上叶且体积<100 mL的肿瘤内的金标位移幅度[(6.55±1.63)mm]的4 倍左右。
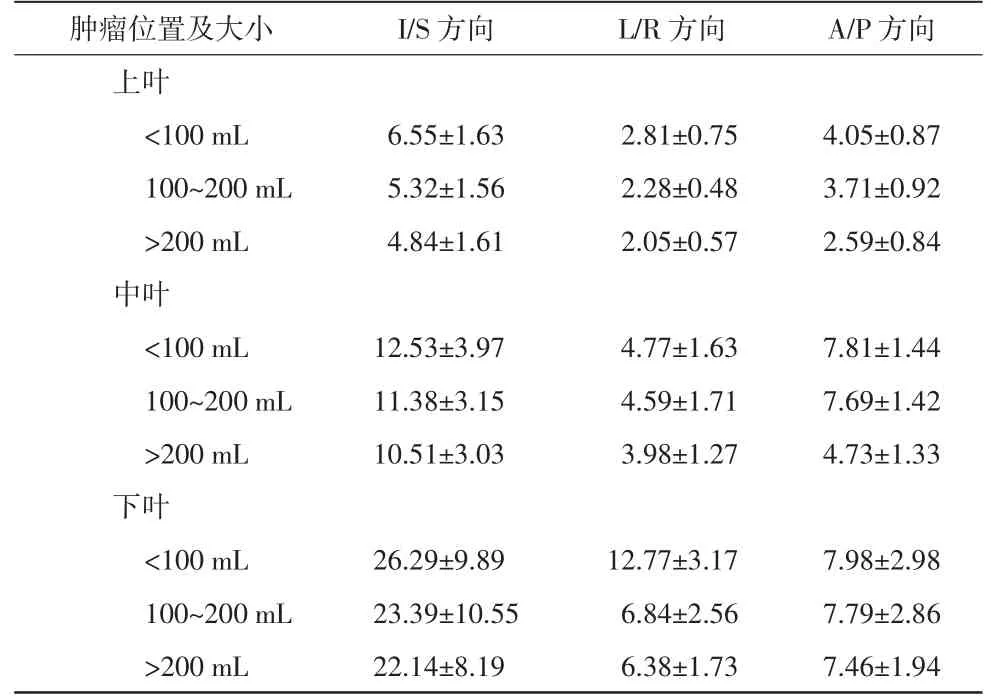
表1 200 例周围型NSCLC 患者金标位移幅度单位:mm
对肿瘤内金标在I/S、L/R 和A/P 3 个方向上的位移信息进行两两配对t 检验,统计分析二者之间的差异,结果见表2。从表2 中可以看出,肿瘤内金标位移在I/S 方向与L/R 方向、A/P 方向之间具有统计学差异(P<0.05),而在L/R 和A/P 方向之间没有明显统计学差异。
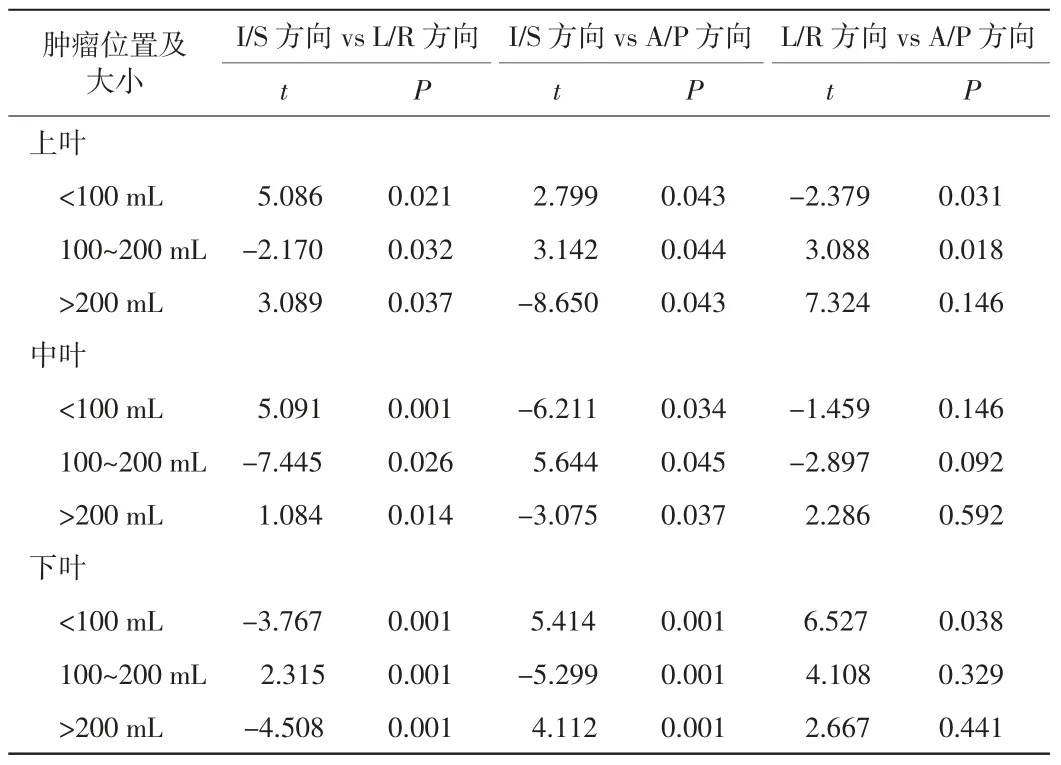
表2 200 例周围型NSCLC 患者肿瘤内金标各方向位移差异性分析结果
3 讨论
与常规放疗相比,SBRT 具有高剂量、高精度、高治疗增益比且低分次、靶区周围正常组织受照剂量低的优势,已成为临床治疗NSCLC 患者的重要手段之一。董妍等[9]对118 例早期NSCLC 患者分别行常规分割放疗(59 例)和SBRT 治疗(59 例),比较2 组的疗效及对患者肺功能的影响,结果表明SBRT 能够提高患者近期疗效,改善患者肺功能,从而明显改善了患者的生存率。RTOG 0618 的2018 年临床试验报告和JCOG0403 研究均表明采用SBRT 治疗早期可手术肺癌患者具有较高的局部控制率和总生存期,可以作为老年或心肺功能差的患者的手术替代首选治疗方式[10-11]。
已有多项研究表明患者局部复发与放射剂量密切相关,肿瘤靶区接受辐射剂量越高,肿瘤局部控制率越高,疗效越好[12-13]。高辐射剂量意味着靶区周围正常组织具有较高的损伤风险,因此放射精度要高。患者呼吸运动引起肺部肿瘤(靶区)及其周围正常组织、器官发生位移,从而导致SBRT 的治疗精度降低[14]。射波刀系统进行肺癌患者SBRT 治疗时,采用靶区定位系统获得实时采集的X 射线影像与治疗计划生成的DRR 图像之间金标位置差异,获取肿瘤内部植入金标的呼吸位移情况,从而实现患者肿瘤呼吸运动的追踪治疗[15]。丁俊强等[16]研究表明,射波刀金标追踪仰卧位与俯卧位治疗精度分别为(0.398±0.112 12)和(0.266±0.114 37)mm,均小于射波刀安全治疗要求的0.90 mm。
本研究通过对200 例接受射波刀SBRT 治疗的周围型NSCLC 患者的临床治疗日志文件进行统计分析,结果表明,在肿瘤内金标在I/S方向上位移幅度较大,且位移大小与肿瘤位置及体积有关。位于肺下叶且体积<100 mL 的肿瘤,其内部金标呼吸位移最大为(26.29±9.89)mm,是位于肺上叶体积相近肿物的4 倍左右。这是由于患者吸气时膈肌收缩,呼气时膈肌松弛,而位于膈肌顶的下肺肿瘤会由于膈肌状态牵引向左右扩张或弹回。此外,由于病灶体积越大,患者肺功能越差,肿瘤组织受患者呼吸时肺组织扩张牵引作用引起的位移越小。
对肿瘤内金标在不同方向上的呼吸位移情况统计分析可以看出,I/S 方向位移与L/R 方向、A/P 方向位移具有明显的统计学差异(P<0.05),而L/R 方向和A/P 方向之间没有明显的统计学差异。
综上所述,在对周围型NSCLC 患者进行SBRT靶区范围确定及临床治疗时,应重点关注患者呼吸所引起的肺部肿瘤在I/S 方向上发生的位移情况,特别是针对位于肺下叶且体积<100 mL 的肿瘤病灶,应当适当扩大临床治疗的靶区范围,以减小患者呼吸引起病灶位移对放疗的影响,提高治疗增益比。
