A型肉毒素对带状疱疹后神经痛小鼠炎性神经递质表达的影响
2020-12-24李国松汤样华徐灿达沈志恩林成英
李国松,汤样华,徐灿达,沈志恩,林成英
(杭州市萧山区中医院 疼痛科,浙江 杭州 311200)
带状疱疹后神经痛(postherpetic neuralgia,PHN)是带状疱疹皮损愈合后遗留的顽固性神经病理性疼痛,是带状疱疹最常见的并发症之一[1]。流行病学调查显示,约有20%的带状疱疹患者在发病后3个月有PHN发生,且发生率随年龄而增长,60岁以上老年患者发生率高达50%~75%[2-3]。PHN一旦形成,由于疼痛较为剧烈,且病程长,患者多伴有焦虑和抑郁等精神症状,严重影响患者生活质量。目前临床上治疗PHN的方法主要分为药物疗法和非药物疗法。治疗药物主要有抗抑郁药、抗癫痫药、镇痛药等,需要长期甚至终身服药,且不良反应较多。非药物疗法如脊髓电刺激、神经阻滞与毁损、皮内注药疗法等有严重并发症的可能,且部分疗法因临床患者个体差异而导致安全性和有效性不尽人意。近几年来,有研究报道[4]应用A型肉毒毒素(botulinum toxin A,BTX-A)皮下注射可有效地治疗PHN。BTX-A是肉毒杆菌在繁殖中分泌的一种有毒性的蛋白质,可通过阻断神经递质在突触前膜的释放,以减轻神经病理性痛[5-6]。但关于BTX-A治疗PHN的作用机制尚不明确。前期研究中我们已通过微量加样器皮下接种注射I型单纯疱疹病毒成功建立了PHN小鼠模型,本研究旨在通过观察BTX-A对PHN小鼠模型炎性神经递质表达的影响,探讨BTX-A对PHN的作用机制。
1 材料和方法
1.1 主要试剂和仪器 BTX-A(兰州生物制品研究所,国药准字号S10970037,生产批号20170928),RNeasy Mini RNA抽提试剂盒(德国Qiagen公司),Quant Reverse Transcriptase反转录试剂盒(美国Bio-Rad公司),SYBR Green荧光素酶(美国Thermo Scientific公司),小鼠TNF-α、IL-1β、NKA(英国Abcam公司),NE-PER蛋白提取试剂盒(美国Thermo Scientific公司),抗Na1.3 鼠单克隆抗体(英国Abcam公司),抗Na1.8鼠单克隆抗体(英国Abcam公司),抗β-Actin鼠单克隆抗体(美国Sigma公司)。BECKMANDU800紫外分光光度计(美国Beckman公司),GIS凝胶图像处理系统(日本Olympus公司),Rotor Gene 3000荧光PCR仪(美国Rotor Gene公司),DENLEY DRAGON Wellscan MK 3酶标仪(美国Thermo Scientific公司),Wellwash 4 MK2洗板机(美国Thermo Scientific公司),PYX-DHS恒温培养箱型(上海跃进医疗器械厂),TGL-168离心机(上海安亭科学仪器厂),移液枪(美国Thermo labsystems公司),Odyssey红外成像系统(日本Olympus公司)。
1.2 方法
1.2.1 PHN动物模型的制作:选择SPF级8周龄雄性C57小鼠,体质量18~22 g[由上海中医药大学实验动物中心提供,实验动物许可证号SCXK(沪)2003-0003],腹腔内注射1%戊巴比妥钠溶液50 mg/kg麻醉后,将左下肢和背部用化学脱毛剂脱毛并用清水冲洗脱毛部位。3 d后,选取脱毛区光滑无损伤动物进入以下实验,皮肤损伤的动物剔除。分别于每只动物左下肢胫骨局部处用微量加样器皮下接种I型单纯疱疹病毒(HSV-1)10 μL(浓度1×106PFU/mL),于接种前和接种后第1、第3、第5、第7天测定后爪机械痛阈和热痛痛阈反应评分,鉴定PHN动物模型是否造模成功。
1.2.2 动物分组与药物干预:选择造模成功的PHN小鼠36只,随机分成A、B、C 3组,每组12只。A组在疱疹部位注射0.9%氯化钠溶液;B组在疱疹部位注射BTX-A(2 U/kg);C组在L5背根神经节(dorsal root ganglion,DRG)处注射BTX-A(2 U/kg)。每天1次,连续干预7 d。
1.2.3 实验标本取材:注射BTX-A后第7天,所有小鼠全部腹腔注射50 mg/kg戊巴比妥钠麻醉后,剪开胸腔,暴露心脏,从心尖插入灌注针至左心室,用止血钳固定针尖,并剪开右心耳形成灌注液排出管道,从左心室快速灌注37 ℃ 0.9%氯化钠溶液,直到从右心耳流出的液体为无色,同时小鼠肝脏色淡,肠管肿胀为止,停止灌流。迅速暴露左侧坐骨神经,然后剪开骨质,逆行找到相应的L5 DRG并取出,立即置于液氮中备用。再逆行找到相应的发出神经的术侧脊髓节段并取出,立即置于液氮中备用。
1.2.4 RT-qPCR反应检测小鼠DRG和脊髓中炎性神经递质TNF-α、IL-1β、神经激肽A(neurokinin A,NKA)的mRNA表达:从液氮中取出DRG和脊髓标本,分别按照试剂盒说明书抽提总RNA。用紫外分光光度计选择波长260 nm和280 nm分别检测OD值,测得样本OD260/280为1.6~2.0后进行反转录和扩增。按照反转录试剂盒说明书将总RNA反转录成cDNA,然后进行Real-time PCR反应。引物由大连宝生物公司设计、合成。引物序列见表1。
1.2.5 ELISA法检测小鼠DRG和脊髓中炎性神经递质TNF-α、IL-1β、NKA的蛋白表达:具体操作步骤分别按照试剂盒说明书进行,用酶标仪在450 nm下,测定显色物的OD值,OD值反映了底物被水解的量。根据试剂盒提供的标准品(已知浓度)对应的酶含量绘制标准曲线,计算获得测试样品中相应抗体的浓度。
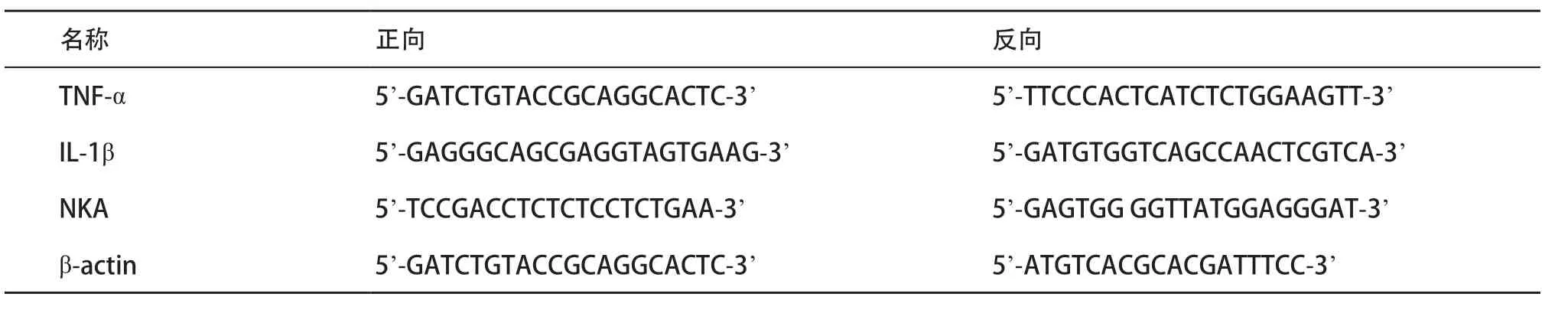
表1 Real-time PCR反应引物序列
1.2.6 Western blot检测各组小鼠DRG和脊髓中Na1.3、Na1.8 通道蛋白表达:蛋白裂解液裂解组织,离心后,取上清液。收集完蛋白样品后,用蛋白浓度测定试剂盒测定每个蛋白样品的蛋白浓度,以含30 μg蛋白计算需要的上样体积,确保每个蛋白样品的上样量一致。加入适量上样缓冲液,沸水中蛋白变性5 min,4 ℃冷却。安装好电泳槽,按照蛋白分子量不同,预制5%浓缩胶和8%分离胶,加入蛋白样品及蛋白marker 5 μL左右。先80 V电压跑浓缩胶,然后110 V电压跑分离胶。电泳至蛋白marker目的条带区域分离开,停止电泳。300 mA恒流,80 min转膜。将PVDF膜放入封闭液中冰上摇1 h。后加入稀释好的β-actin(1:5 000)及Na1.3(1:1 000,5%奶粉/TBST配制)、Na1.8抗体(1:1 000,5%奶粉/TBST配制)冰上摇1~2 h,再转入4 ℃冰箱过夜。TBST洗膜2次,冰上摇10 min。加入1:10 000的二抗,孵育1 h。将二抗倒去,用PBS清洗3遍,Odyssey红外成像系统采集目的条带图像。
1.3 统计学处理方法 采用SPSS19.0软件对数据进行分析处理。计量资料以表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠DRG和脊髓中炎性神经递质RT-qPCR检测结果 与A组比,B组和C组炎性神经递质TNF-α、IL-1β、NKA的mRNA相对表达水平显著降低,差异有统计学意义(P<0.05),但B和C组间比较差异无统计学意义(P>0.05)。见表2。
2.2 小鼠DRG和脊髓中炎性神经递质ELISA法检测结果 与A组比,B组和C组TNF-α、IL-1β、NKA的蛋白含量显著降低,差异有统计学意义(P <0.05),但B和C组间比较差异无统计学意义(P>0.05)。见表3。
2.3 小鼠DRG和脊髓中Na1.3、Na1.8通道蛋白的Western blot检测结果 与A组比较,B组和C组Na1.3、Na1.8通道蛋白表达显著降低,差异有统计学意义(P<0.05),但B和C组间比较差异无统计学意义(P>0.05)。见表4和图1。
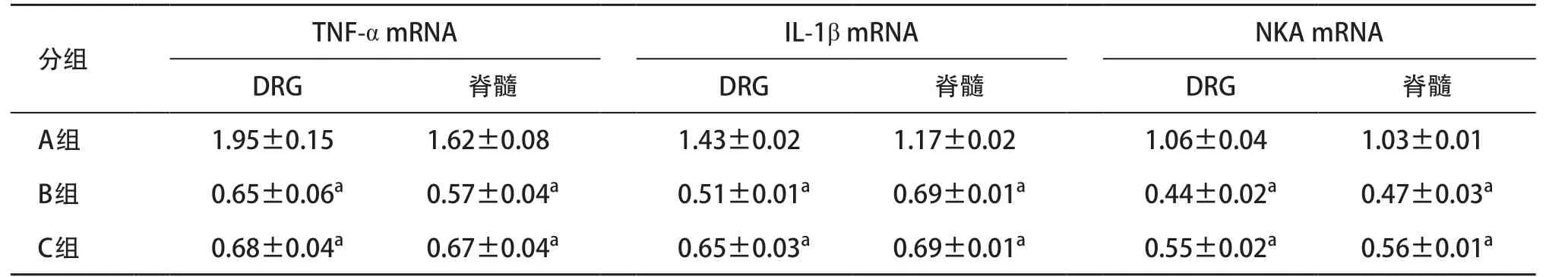
表2 各组小鼠DRG和脊髓中炎性神经递质RT-qPCR检测结果(每组n=12)

表3 各组小鼠DRG和脊髓中炎性神经递质ELISA法检测结果(每组n=12)
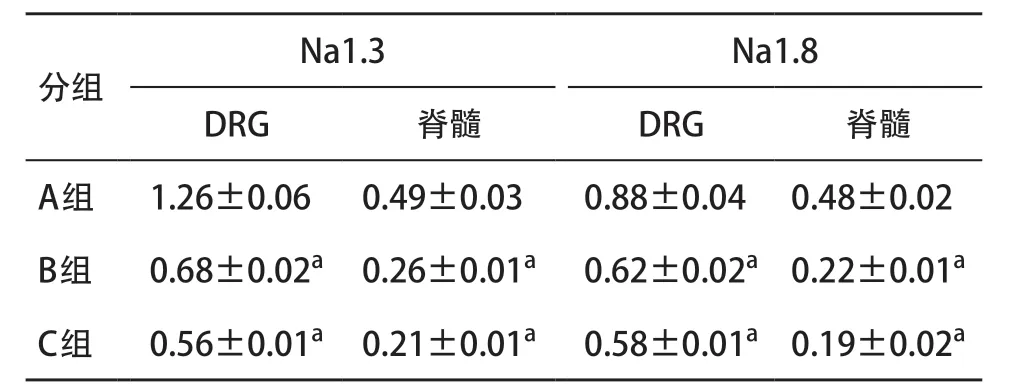
表4 各组小鼠DRG和脊髓中Na1.3、Na1.8通道蛋白相对表达量(每组n=12)

图1 各组小鼠DRG和脊髓中Na1.3、Na1.8通道蛋白Western blot检测结果
3 讨论
国内外研究[7-9]发现,目前临床上应用BTX-A治疗PHN,镇痛效果明显,是一种潜在的可能用于治疗PHN的可靠方法,但是作为一种运动神经的特异性阻滞剂,BTX-A治疗PHN的内在机制仍不清楚,因此,仍需要大量的基础及临床研究来揭示BTX-A治疗PHN的作用机制,以更准确和更有效地指导临床治疗。研究[10-11]表明,带状疱疹患者发生PHN的一个重要原因为其周围神经干发生炎症,神经末梢释放大量的P物质、NKA、炎性因子等介质,使患者对伤害性刺激更加敏感,引起周围神经敏化,产生疼痛症状。本研究采用RT-qPCR和ELISA法检测了小鼠DRG和脊髓中相关炎性神经递质TNF-α、IL-1β、NKA的mRNA和蛋白表达量。结果表明,于疱疹局部注射BTX-A和L5 DRG注射BTX-A(2 U/kg)均可显著降低TNF-α、IL-1β、NKA的mRNA和蛋白表达水平,与局部注射0.9%氯化钠溶液组比较,差异有统计学意义,提示BTX-A治疗PHN的作用与抑制炎性神经递质TNF-α、IL-1β、NKA的mRNA和蛋白表达水平相关。
另外,有研究通过检测水痘带状疱疹病毒感染后的大鼠DRG,发现神经肽表达显著增加,钙通道、钠通道1.3和1.8蛋白显著激活[12]。本研究中通过Western blot检测小鼠DRG和脊髓中Na1.3、Na1.8通道的蛋白表达发现,BTX-A可显著降低Na1.3、Na1.8通道的蛋白表达,且与0.9%氯化钠溶液对照组比较差异有统计学意义,也进一步提示,BTX-A治疗PHN的作用可能与降低通道蛋白Na1.3、Na1.8的表达相关。
综上所述,结合本研究结果表明,BTX-A能有效抑制PHN,其作用机制可能是通过降低通道蛋白Na1.3、Na1.8 的表达,抑制炎性神经递质TNF-α、IL-1β、NKA的mRNA和蛋白表达水平。但在本研究中实验结果发现局部注射BTX-A和L5 DRG注射BTX-A,对PHA小鼠炎性神经递质表达的影响差异无统计学意义,从而表明注射部位对于BTX-A治疗PHA的机制影响不大,其可操作性方面及临床应用方面尚需进一步研究。
