miR-148b参与调控弥漫性大B细胞淋巴瘤药物敏感性的机制
2020-12-24林晓骥方玮玥董玉青孙妮苏童杨向绸郭文坚何牧卿姚荣欣
林晓骥,方玮玥,董玉青,孙妮,苏童,杨向绸,郭文坚,何牧卿,姚荣欣
(温州医科大学附属第二医院育英儿童医院 血液肿瘤科,浙江 温州 325027)
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)中最常见的类型,占成人NHL的30%~40%[1-2]。环磷酰胺(cyclophosphamide,CTX)、阿霉素(adriamycin,ADM)、长春新碱(vincristine VCR)与强的松(prednisolone,Pred)组成的CHOP方案是目前被证实的治疗DLBCL的最经典治疗方案,然而超过50%患者出现耐药或复发的现象[3]。众所周知,DLBCL难治的主要原因是肿瘤细胞产生了多药耐药,故研究DLBCL耐药机制是提高DLBCL患者疗效的关键。
miR-148b位于人染色体12q13.13上,目前研究证实miR-148b与肿瘤细胞的耐药性关系密切。SUI等[4]研究发现上调miR-148b可以逆转非小细胞肺癌细胞株对顺铂的耐药性。WU等[5]也证实,miR-148b上调同样可以增加人Burkitt淋巴瘤Raji细胞株对放疗的敏感性。然而,miR-148b在DLBCL药物敏感性中的作用还没有相关报道。有学者将DLBCL分为2类,一类是对CHOP方案具有较低敏感性,另一类是对CHOP方案具有较高敏感性。LIU等[6]对两类DLBCL中蛋白进行2D电泳联合质谱分析发现Ezrin蛋白在低敏感组中表达水平明显高于高敏感组,表明Ezrin与DLBCL的耐药性存在关联。我们采用生物信息学软件(RAID v2.0)预测分析发现,Ezrin是miR-148b的靶基因之一。所以,本研究探讨miR-148b是否调控Ezrin继而影响DLBCL细胞对药物的敏感性,从而探究miR-148b/Ezrin轴成为DLBCL治疗的靶向分子的潜能。
1 材料和方法
1.1 实验材料和试剂 人DLBCL细胞株CRL2631购自中国科学院上海细胞库,CTX、ADM、VCR和Pred购自美国Sigma公司,miR-148b mimic、miR-148b inhibitor以及阴性对照物由广州锐博生物科技有限公司构建合成,SYBR green和实时荧光定量PCR试剂盒购自美国Applied Biosystems公司,LipofectamineTM2000转染试剂购自美国Invitrogen公司,CCK-8试剂盒购自日本同仁公司,Ezrin单抗购自美国Cell Signaling Technology公司,β-actin单抗和MDR-1 单抗购自美国Santa Cruz Biotechnology公司。
1.2 方法
1.2.1 诱导培养耐药细胞株CRL2631/CHOP:根据参考文献[7],用CHOP方案四药联合(CTX、ADM、VCR和Pred的比率为80:5:0.16:11.1)把DLBCL细胞系CRL2631诱导产生稳定的耐药株CRL2631/CHOP,细胞在诱导耐药的初期极易死亡,选择5 ng/mL的低浓度CHOP作为诱导起始浓度,逐渐提高CHOP浓度(10、20、40、80、160、320、640、1 280 ng/mL),最终获得能够在CHOP浓度为640 ng/mL的培养液中持续存活5 d并稳定增殖的耐药细胞株。
1.2.2 细胞转染:取对数生长期的细胞接种于24孔板(2×104细胞/孔),使细胞汇合达到70%~80%,采用LipofectamineTM2000转染试剂介导转染。将CRL2631分别转染miR-148b inhibitor和阴性对照物,CRL2631/CHOP细胞分别转染miR-148b mimic和阴性对照物,见表1。转染后放入培养箱培养8 h,更换双倍血清的培养基,继续培养48 h,收集细胞。

表1 miR-148b mimic、miR-148b inhibitor和阴性对照物的序列
1.2.3 CCK-8 检测细胞活力:取对数生长期的细胞接种于96孔板中,每孔加入2×103个细胞,每次实验设3个复孔,与不同CHOP浓度(40、80、160和320 ng/mL)共同孵育72 h。每孔加入新鲜配制的含10 µL的毒性检测液CCK-8溶液,在细胞培养箱内继续孵育4 h,分别用酶标仪在450 nm测定吸光度(OD值)。实验重复3次。取实验结果的平均值作为最终实验结果。按公式计算生长抑制率=[(对照组OD-实验组OD)]/对照组OD×100%,以浓度为横坐标,生长抑制率为纵坐标。
1.2.4 双荧光素酶实验:根据参考文献[8],将含miR-148b作用靶点的Ezrin 3’UTR和作用靶点突变的mutant-Ezrin-3’UTR连接到荧光素酶报告载体上,分别命名为野生型Ezrin-3’UTR(WT)和突变型Ezrin-3’UTR(Mut)报告质粒(此项工作由南京金斯瑞生物科技公司完成)。将构建的载体分别与miR-148b mimic和miR-148b inhibitor共转染至CRL2631细胞。按照双荧光素酶报告基因检测试剂盒说明书,分别检测各组细胞萤火虫荧光素酶和海肾荧光素酶活信号,计算相对荧光值=荧光素酶活性值/海肾荧光素酶活性值。
1.2.5 实时荧光定量PCR:TRIzol试剂提取细胞总RNA,紫外分光光度计对提取的RNA进行浓度检测,反转录成cDNA,加入特异引物、SYBR Premix ExTaq和PCR所需试剂,于实时定量PCR仪(ABI 7500)上进行反应,制作熔解曲线判断引物特异性,分别以U6为内参基因,采用2-ΔΔCT方法计算基因的相对表达量。各基因的引物序列如下:①miR-148b上游引物:5’-GCGGACACGGAGCCAGAACA-3’;miR-148b下游引物:5’-ATCACGGTCGAGGCTCAGGG-3’;②U6上游引物:5’-GCCGTTGCAGCACATATACAATAAT-3’;U6下游引物:5’-CGCTACGTTAATGCTCGTGTCAT-3’。反应条件:95 ℃1 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环;终延伸68 ℃ 40 s。
1.2.6 Western blot:使用RIPA裂解液提取肿瘤组织细胞或细胞株的总蛋白,BCA蛋白定量试剂盒检测总蛋白含量。将等量蛋白样本以十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳进行分离,分离后的蛋白转移至PVDF膜,经PBST清洗后,使用含5%脱脂奶粉PBST溶液室温封闭2 h,将膜与稀释到一定浓度的对应一抗在4 ℃下孵育过夜,第2天将膜再与二抗室温孵育2 h,使用ECL化学发光显色液对条带进行显色,其中以β-actin作为对照蛋白。
1.3 统计学处理方法 采用SPSS18.0软件进行统计分析,每次试验重复3次,数据以表示;2组间比较采用两独立样本t检验,2组间不同时间比较采用重复测量资料的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 诱导培养耐药细胞株CRL2631/CHOP 采用CCK-8方法检测CRL2631和CRL2631/CHOP细胞对不同浓度CHOP(40、80、160和320 ng/mL)的敏感性影响。结果显示,在CHOP浓度为80 ng/mL开始,CRL2631/CHOP细胞在不同浓度的CHOP下细胞存活率均较CRL2631细胞显著升高(P<0.05),表明CRL2631/CHOP细胞较CRL2631细胞的药物敏感性下降。Western blot检测结果显示在CRL2631/CHOP细胞中MDR-1蛋白表达水平也显著高于CRL2631细胞,其蛋白相对表达量分别为(1.34±0.14)和(0.35±0.08)(P<0.001)。见图1。
2.2 miR-148b和Ezrin在CRL2631和CRL2631/CHOP细胞株中的表达情况 实时荧光定量PCR法检测比较CRL2631和CRL2631/CHOP细胞的miR-148b mRNA表达水平,结果显示CRL2631/CHOP细胞的miR-148b mRNA表达水平显著低于CRL2631细胞(P=0.001)。Western blot结果显示,CRL2631/CHOP细胞的Ezrin蛋白表达水平显著高于CRL2631细胞,其蛋白相对表达量分别为(1.14±0.18)和(0.45±0.06)(P<0.05),见图2。
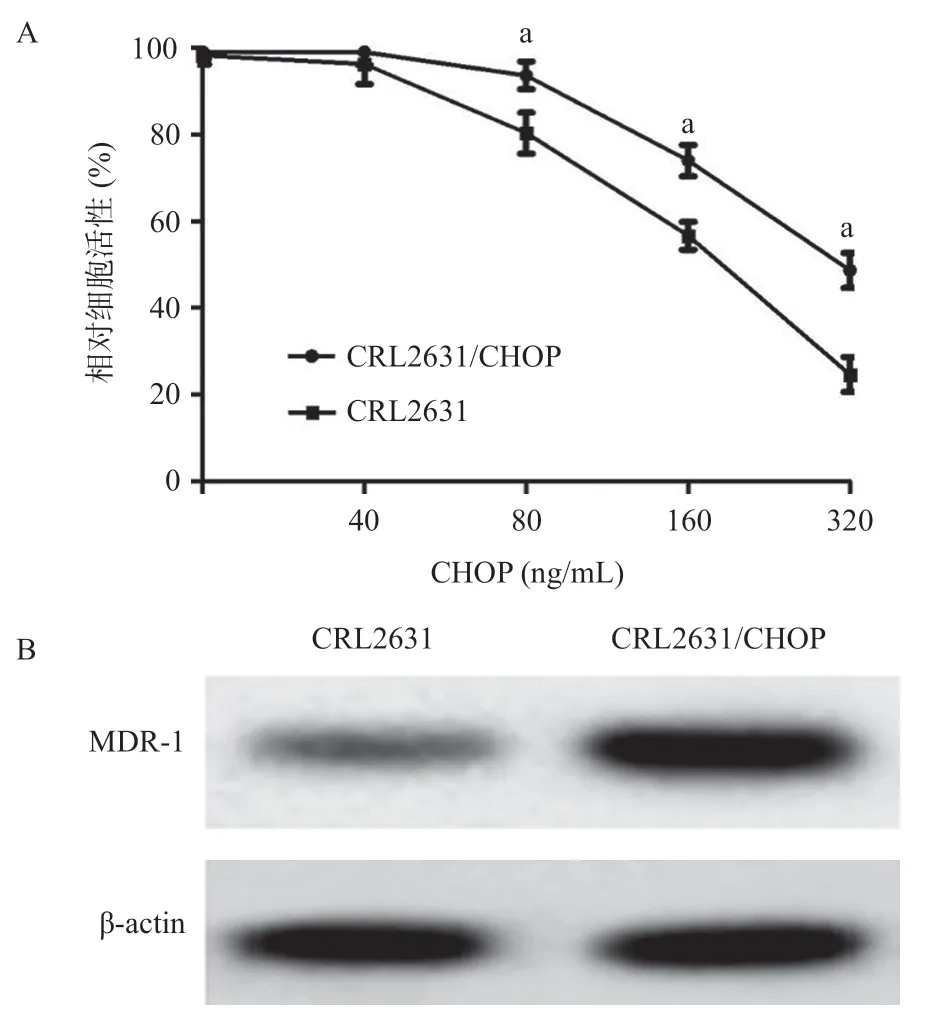
图1 CRL2631/CHOP细胞与CRL2631细胞的药物敏感性和MDR-1表达的情况
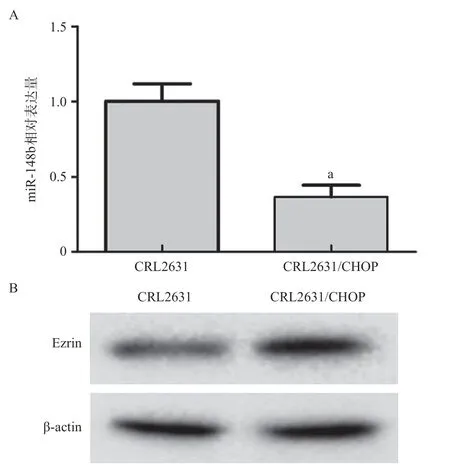
图2 miR-148b和Ezrin在CRL2631和CRL2631/CHOP细胞中的表达情况
2.3 Ezrin是miR-148b靶基因的预测及验证 通过生物信息学软件(RAID v2.0)预测分析发现,Ezrin 3’UTR存在潜在的miR-148b结合位点(见图3),我们推测Ezrin是miR-148b的直接靶基因。为了验证这一推测,我们采用经典的双荧光素酶报告基因实验。结果显示相对于阴性对照组,上调miR-148b的表达后,miR-148b mimic+野生型Ezrin 3’UTR载体(WT)组荧光素酶活性明显降低(P<0.05),而miR-148b mimic+突变型Ezrin 3’UTR载体(MUT)组荧光素酶活性无明显改变。相反,在miR-148b inhibitor+WT组,下调miR-148b的表达后,荧光素酶活性较阴性对照组显著提升(P<0.05),而miR-148b inhibitor+MUT组的荧光素酶活性改变与阴性对照组比较,差异无统计学意义(P>0.05),见图4。
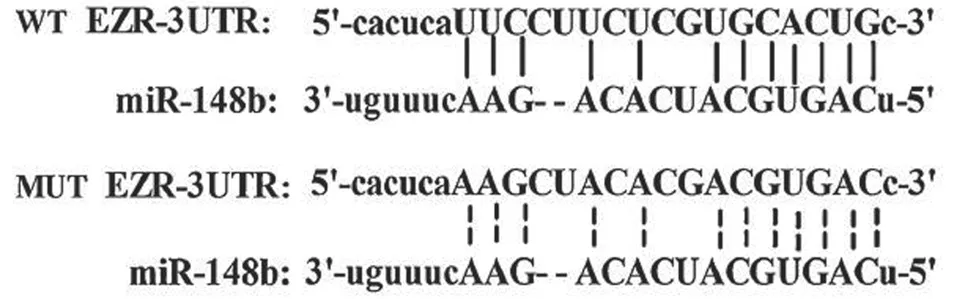
图3 Ezrin 3’ UTR与miR-148b的结合位点及其点突变
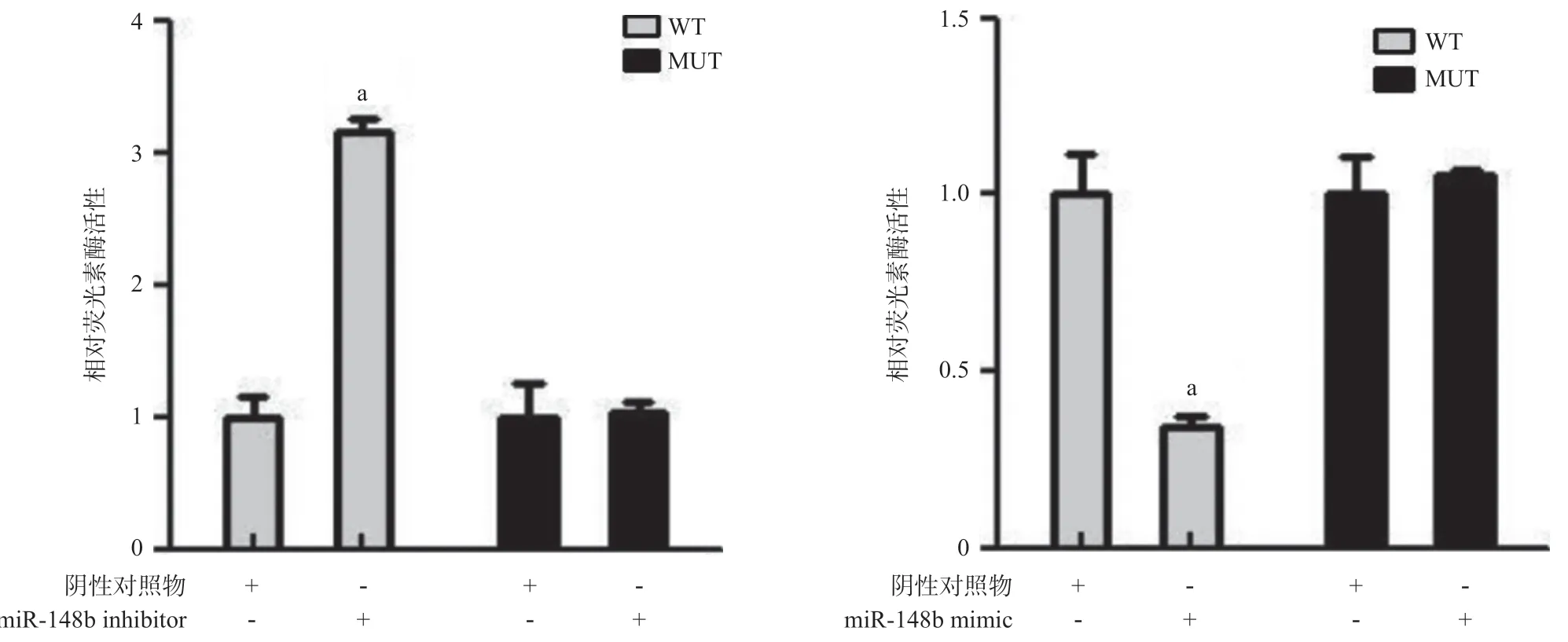
图4 野生型/突变型Ezrin 3’ UTR载体和miR-148b mimic/inhibitor共转染CRL2631细胞的荧光素酶活性情况
2.4 下调miR-148b的表达对CRL2631细胞Ezrin蛋白和CHOP敏感性的影响 我们分别将miR-148b inhibitor和阴性对照物转染至CRL2631细胞。CCK-8实验结果显示,miR-148b inhibitor组CRL2631细胞对在不同浓度CHOP下细胞存活率均较阴性对照组显著上升(P<0.05),表明下调miR-148b的表达使CRL2631细胞的药物敏感性下降。Western blot结果表明,miR-148b inhibitor组MDR-1和Ezrin的表达较阴性对照组显著上升,其MDR-1相对表达量分别为(1.45±0.23)和(0.31±0.09)(P<0.001),Ezrin相对表达量分别为(1.53±0.14)和(1.01±0.11)(P<0.05),见图5。
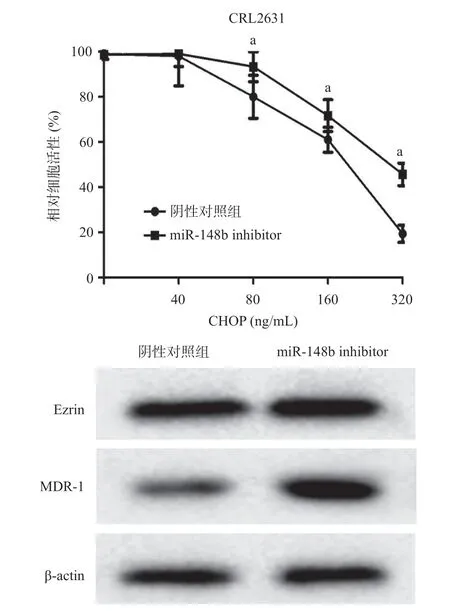
图5 下调miR-148b对CRL2631细胞的药物敏感性、Ezrin和MDR-1蛋白表达的影响
2.5 上调miR-148b的表达对CRL2631/CHOP细胞Ezrin蛋白和CHOP敏感性的影响 我们分别将miR-148b mimic和阴性对照物转染至CRL2631/CHOP细胞。CCK-8 实验结果显示,miR-148b mimic组CRL2631/CHOP细胞对不同浓度CHOP下细胞存活率较阴性对照组显著下降(P<0.05),表明上调miR-148b的表达使CRL2631/CHOP细胞的药物敏感性上升。Western blot结果表明,miR-148b mimic组MDR-1和Ezrin的表达较阴性对照组显著下降,其MDR-1相对表达量分别为(0.47±0.12)和(1.52±0.24)(P <0.001),而Ezrin相对表达量分别为(0.62±0.16)和(1.51±0.25)(P<0.001),见图6。
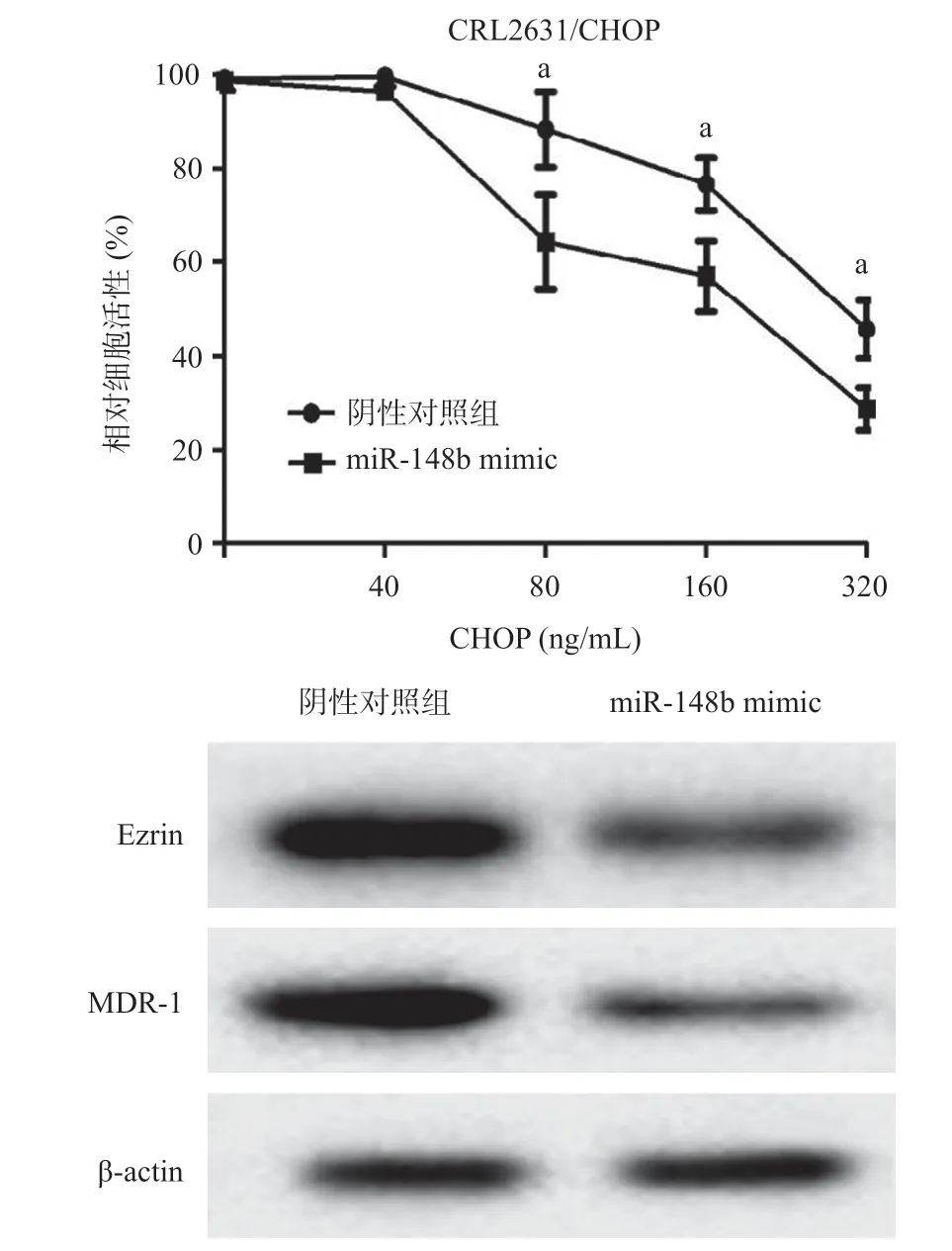
图6 上调miR-148b对CRL2631/CHOP细胞的药物敏感性、Ezrin和MDR-1蛋白表达的影响
3 讨论
DLBCL是为一组异质性很强的B细胞性淋巴瘤,病理上以弥漫性分布的恶性大B淋巴细胞为特征,临床上表现为侵袭性的病程[9]。随着利妥昔单抗的引入,R-CHOP化疗方案大大改善了DLBCL患者的预后,但仍有相当一部分患者出现无效或复发的现象。众所周知,DLBCL难治的原因主要是肿瘤细胞对化疗药物产生了耐药,尤其产生的多药耐药是治疗DLBCL的主要障碍。因此,研究DLBCL耐药机制是提高DLBCL患者疗效的关键。
miRNAs是一类长度为二十几个核苷酸的内源性非编码调控RNA,参与细胞发育、增殖、分化、凋亡等一系列重要生物学过程。有研究表明,miRNAs与DLBCL耐药性存在关系密切。BAI等[10]研究发现,miR-21在参与调控DLBCL细胞株CRL2631对CHOP的敏感性,敲除miR-21可显著靶向下调PTEN蛋白表达水平并且通过影响PI3K/AKT信号通路提高DLBCL细胞株对CHOP方案化疗的敏感性。KIM等[11]也发现稳定表达miR-124可以靶向下调PDE4B蛋白,并改善DLBCL细胞对糖皮质激素的耐药性。MARQUES等[12]证实在15 例DLBCL细胞株中对蒽环类药物敏感性的细胞株均存在miR-34a高表达,而miR-34a可以靶向下调FOXP1从而增加DLBCL细胞对蒽环类药物的敏感性。YUAN等[13]从56例DLBCL患者和20例健康对照组的血清中应用RT-PCR分析,在对R-CHOP化疗方案耐药的DLBCL患者中存在血清miR-125b和miR-130a存在更高的表达,进一步研究发现,miR-125b和miR-130a的动态变化可以用作监测DLBCL患者的复发、进展或耐药的一个有效指标。LEIVONEN等[14]发现在复发DLBCL患者中普遍存在miR-370-3p、miR-381-3p和miR-409-3p的低表达;进一步研究结果显示在人DLBCL细胞株SU-DHL-4细胞中上调miR-370-3p、miR-381-3p和miR-409-3p均可以增加细胞对利妥昔和蒽环类药物的敏感性。而本研究发现耐药株CRL2631/CHOP的miR-148b的表达量明显低于CRL2631细胞。由此可见,miR-148b可能在与DLBCL产生CHOP耐药的过程中发挥调控作用。
miR-148b位于人染色体12q13.13上,目前研究证实miR-148b在结肠癌、胃癌、乳腺癌、肺癌和黑色素瘤等多种肿瘤组织中普遍存在表达异常[15-17]。甚至多个研究表明,miR-148b与肿瘤细胞的耐药性也存在关系密切。WANG等[18]发现miR-148b的表达量在放疗耐药的非小细胞肺癌患者中较放疗敏感的患者显著减少。而SUI等[4]研究结果证实miR-148b的过表达可以负向调控靶基因DNMT1,从而逆转非小细胞肺癌细胞株A549/DDP和SPC-A1/DDP对顺铂的耐药性。HUMMEL等[19]发现miR-148a的上调可以增加食管腺癌和鳞状细胞癌细胞株对顺铂和5-氟尿嘧啶的敏感性。WU等[5]也证实,MiR-148b上调同样可以增加人Burkitt淋巴瘤Raji细胞株对放疗的敏感性。然而,miR-148b在DLBCL耐药中的作用还没有相关报道。因此本研究重点研究miR-148b在DLBCL产生耐药性过程中所发挥的作用及机制。我们采用了miRNA模拟/干扰技术和CCK-8方法研究DLBCL的CRL2631和CRL2631/CHOP细胞株进行对CHOP的药物敏感性试验。在我们的研究结果中,上调miR-148b的表达可以增加CRL2631/CHOP细胞对CHOP的敏感性,而下调miR-148b表达增加了CRL2631细胞的耐药性。因此我们的研究进一步证明了DLBCL对CHOP的耐药性与miR-148b的异常表达密切相关。
目前研究证实,miRNAs通过碱基互补配对原则特异性的与相关靶基因mRNA 3’UTR的启动序列相结合从而发挥肿瘤的增殖、转移和浸润等多种生物学功能。因此,本研究旨在探究miR-148b在参与调控DLBCL耐药性的靶基因。我们通过microrna.org网上预测发现Ezrin是miR-148b的靶基因之一。Ezrin蛋白是ERM(Ezrin、Radixin、Moesin)蛋白家族成员之一,作为酪氨酸激酶的底物,Ezrin蛋白能在细胞膜蛋白与肌动蛋白骨架之间起到桥梁的作用,参与细胞形态的形成、黏附、运动以及细胞的增殖和生存等功能。目前研究表明Ezrin蛋白与许多肿瘤的发生、侵袭和转移有密切关系,如前列腺癌、乳腺癌、胰腺癌和结肠癌等[20-21]。甚至有研究结果显示,Ezrin基因还参与调控肿瘤的耐药性。LV等[22]报道,Ezrin参与了一种蛋白质复合物EBP50组成,该复合物赋予胃癌细胞具有对5-氟尿嘧啶的化学敏感性。此外,在非小细胞肺癌中,Ezrin与EGFR的相互作用增强了EGFR致癌功能,增加非小细胞肺癌对埃罗替尼的耐药性[23]。CHEN等[24]发现沉默Ezrin使人类肺癌细胞株95D细胞增加对抗肿瘤药物的敏感性。PORE等[25]发现抑制Ezrin表达后能减少DLBCL细胞株OCI-LY-10、OCI-LY-3和SU-DHL-6细胞的增殖和生长,同时在动物实验中也进一步证明Ezrin抑制剂的使用显著减少DLBCL皮下移植瘤的生长。根据化疗的敏感性DLBCL被分为2类:一类是对CHOP方案具有较低敏感性,另一类是对CHOP方案具有较高敏感性。LIU等[6]对两类DLBCL中蛋白进行2D电泳联合质谱分析发现,有19个蛋白在两类DLBCL中表达有2倍差异。其中Ezrin蛋白在CHOP高敏感性的DLBCL组中表达水平明显低于CHOP低敏感的DLBCL组。MAXWELL等[26]研究发现在CHOP耐药的DLBCL细胞株中存在Ezrin蛋白的高表达。由此表明Ezrin与DLBCL的耐药性可能存在密切关联。我们通过Western blot检测显示耐药株CRL2631/CHOP细胞Ezrin的表达量明显高于CRL2631细胞。这些实验结果也进一步揭示Ezrin与DLBCL的耐药性密切相关。
为了证明miR-148b和Ezrin两者在DLBCL中存在实质性联系,我们采用经典的双荧光素酶报告基因实验,将Ezrin 3’UTR荧光素酶报告载体和miR-148b inhibitor/miR-148b mimic共转染CRL2631细胞。我们的结果发现miR-148b mimic与野生型Ezrin 3’UTR载体共转染后细胞的荧光素酶活性明显降低,而miR-148b inhibitor与野生型Ezrin 3’UTR载体共转染后细胞的荧光素酶活性显著提升。进一步Western blot结果显示,在CRL2631细胞中miR-148b能调控Ezrin蛋白的表达,miR-148b的过表达可以下调Ezrin的表达,而下调miR-148b可以增加Ezrin蛋白的表达。由此证明Ezrin是miR-148b的直接靶基因。我们还发现,上调miR-148b的表达不仅增加CRL2631/CHOP细胞的药物敏感性,还下调了Ezrin蛋白的表达。另外,下调miR-148b的表达使CRL2631细胞对CHOP敏感性的同时上调了Ezrin蛋白的表达。因此,我们的研究结果证实,miR-148b通过调控Ezrin调节DLBCL对CHOP的耐药性。
综上所述,我们的研究显示miR-148b在耐药性DLBCL细胞株中呈现相对低表达,上调miR-148b可显著下调Ezrin蛋白表达水平而提高DLBCL细胞株对CHOP方案化疗的敏感性。这些有助于我们探索DLBCL细胞耐药性中的关键作用的分子及其调控机制,而miR-148b和Ezrin有望成为DLBCL患者靶向治疗的新靶点。
