omega-3脂肪酸在围绝经期焦虑样小鼠中的抗焦虑作用及机制
2020-12-24何储君涂君雪黄婉然鲍仕慧
何储君,涂君雪,黄婉然,鲍仕慧
(温州医科大学附属第二医院 药学部,浙江 温州 325027)
围绝经期综合征又称更年期综合征(menopausal syndrome,MPS)是妇女在绝经前后由于雌激素水平波动或下降所致的以植物性神经紊乱为主,伴有神经心理症状的一组症候群,持续时间一般为8~12年。主要症状包括潮红、出汗、情绪不稳定、激动易怒、记忆力减退、工作能力下降等[1]。约85%围绝经期妇女为MPS所扰,罹患抑郁症或焦虑症的风险明显增加[2]。根据经典的单胺假说和受体假说研发的经典抗焦虑抑郁药主要有选择性5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂、去甲肾上腺素(noradrenaline,NE)再摄取抑制剂和单胺氧化酶抑制剂等。然而,这些经典药物只对60%的焦虑抑郁症患者有效,且疗效有限,至多改善50%的症状。此外,需服药2~6周才能发挥药效,且长期使用伴有严重的不良反应[3]。因此,寻找更安全、有效,且不良反应小的抗焦虑抑郁药物显得尤为必要。
omega-3脂肪酸(omega-3 polyunsaturated fatty acids,n-3 PUFA)是一种从深海鱼类中提取出来的多不饱和脂肪酸,因其第一个不饱和键出现在碳链甲基端的第3位而得名,主要包括α-亚麻酸(α-linolenic acid,ALA)、二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),具有显著的抗炎和降低三酰甘油的作用,可能在相关疾病的发病机制中发挥作用。有研究发现,在啮齿动物饮食中长期加入n-3 PUFA可以诱导出抗抑郁行为,并且同时增加海马的体积、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的表达量和新生神经细胞的数量[4]。有研究表明,n-3 PUFA的摄入量同焦虑抑郁症的发生率和严重性有着不同程度的相关性,n-3 PUFA有助于抑郁症的治疗[5-6]。因此,本研究采用双侧卵巢摘除术联合慢性应激建立围绝经期焦虑模型,研究n-3 PUFA对围绝经期焦虑模型小鼠行为学的影响,并探讨其可能的作用机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康雌性ICR小鼠,体质量22~26(24±1)g,购自上海斯莱克实验动物有限公司。饲养于温州医科大学动物实验中心SPF级动物房,动物许可证号:SYXK(浙)2010-0150。饲养条件:每笼5只,室温(22±1)℃,湿度(50±10)%,昼夜节律,自然光照,自由摄食饮水。所有动物适应环境5 d后进行手术。
1.1.2 药品及试剂:n-3 PUFA购于上海展望集团;水合氯醛、高氯酸、枸橼酸钾、乙二胺四乙酸、枸橼酸-枸橼酸钠、辛烷基磺酸钠、甲醇、盐酸丙咪嗪、二氢溴犬脲胺、4-羟基喹啉、氯吉兰、盐酸司立吉林、NE、多巴胺(dopamine,DA)、5-HT、5-羟吲哚乙酸(5-hydroxy-indoleacetic acid,5-HIAA)、3,4-二羟基苯乙酸(dopac)、氟西汀均购于美国Sigma公司。每次实验前n-3 PUFA需用花生油配成所需要浓度。
1.1.3 主要仪器:动物行为学分析系统购自中国科学院上海药物研究所;JY92-2D超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;Eppendorf 5417R高速冷冻离心机购自德国Eppendorf公司;Bio-Rad 680酶标仪购自美国伯乐公司;970CRT型荧光分光光度计购自美国Perkin Elmer公司;高效液相仪购自美国Agilent公司。
1.2 方法
1.2.1 动物分组和给药:采用随机数字表法将56只雌性ICR小鼠分成假手术+生理盐水组(0.9%氯化钠溶液灌胃)、双侧卵巢切除(OVX)+生理盐水组(0.9%氯化钠溶液灌胃)、OVX+慢性应激+生理盐水组(0.9%氯化钠溶液于慢性应激前30 min灌胃)、OVX+10 mg/kg n-3 PUFA组(10 mg/kg n-3 PUFA于慢性应激前30 min灌胃)、OVX+20 mg/kg n-3 PUFA组(20 mg/kg n-3 PUFA于慢性应激前30 min灌胃)、OVX+60 mg/kg n-3 PUFA组(60 mg/kg n-3 PUFA于慢性应激前30 min灌胃)、OVX+10 mg/kg氟西汀组(10 mg/kg氟西汀于慢性应激前30 min灌胃),每组8只。每天给药1次,连续2周。
1.2.2 围绝经期模型的建立:在BEKKU等[7-8]建立的方法的基础上进行改良。除假手术+生理盐水组外所有小鼠在适应环境5 d后进行双侧卵巢手术摘除。卵巢摘除术:采用10%的水合氯醛(5 mL/kg)腹腔注射麻醉小鼠,取俯卧位皮洁后乙醇棉球消毒背部皮肤,在小鼠大腿根部稍上方水平,脊柱侧方不到1 cm处用眼科剪剪开一个与脊柱平行的长约5 mm皮肤切口,仔细剪开下方腰肌,仔细寻找包绕卵巢的脂肪组织,见到粉红色的卵巢后将其拉出切口,在卵巢两侧结扎并摘除卵巢。假手术+生理盐水组不切除卵巢,仅摘取旁边少许脂肪组织。
1.2.3 慢性应激模型建立:选择围绝经期模型小鼠,参照文献[9-10]进行改良以建立慢性应激模型,方案如下:禁食(24 h)、禁水(24 h)、束缚(4 h)、夹尾(1 min)、常温强迫游泳(5 min)、潮湿垫料(24 h)、冰水强迫游泳(10 ℃,5 min)、束缚(6 h)。每日2个不同应激,不同应激交替进行,共计14 d。
1.2.4 高架十字迷宫实验:高架十字迷宫装置由具有2个开臂和2个闭臂(高40 cm)的4个分支臂(50 cm×10 cm)组成。开臂和闭臂通过中心平台(10 cm×10 cm)连接。迷宫装置处于地面上方50 cm处。在给药后第14天,将小鼠单独放置在高架十字迷宫的中心,面向开臂。记录5 min内小鼠分别进入开臂和闭臂的时间和次数。只有当前爪都通过分界线,小鼠才算进入开臂或闭臂。进入开臂次数百分比和在开臂的时间百分比,开臂次数(%)=进入开臂次数/进入开臂和闭臂总次数×100%;开臂时间(%)=在开臂花费的时间(s)/在开臂和闭臂的总时间(s)×100%。为了消除气味对测试结果的干扰,在每次实验结束后用乙醇清洁装置,彻底干燥后再进行下一个实验。
1.2.5 大理石掩埋实验:按照旺建伟等[11]所描述的方法进行大理石掩埋实验。在正式实验开始时,将小鼠单独放在一个箱子(40 cm×24 cm×20 cm)中,其箱子底部铺上一层5 cm的垫料,在箱子的垫料上摆放9颗玻璃珠子(直径为2.3 cm),记录小鼠10 min内掩埋玻璃珠子的颗粒数,其玻璃珠子被掩埋入二分之一视为被掩埋。
1.2.6 自主活动实验:在给药后第14天,慢性应激30 min后开始实验。按陈松芳等[12]所描述的方法稍作修饰。采用自动化活动监测系统测量小鼠的自发活动。将小鼠置于正方形开野实验箱(80 cm×80 cm×75 cm),底板用笔画成10 cm×10 cm的方格。室内隔音,小鼠经过5 min的适应期后,通过自动图像分析系统自动记录10 min内小鼠在开场箱内活动的数据即移动的距离。
1.2.7 单胺类神经递质及其代谢产物的检测:在行为学结束后,小鼠断头取脑,迅速剥离全脑,分离出前额叶皮层,下丘脑和海马,称质量后储存于-80 ℃中。根据NITTA等[13]所描述的方法稍作修饰,用高效液相电化学检测法检测5-HT、NE、DA、5-HIAA、dopac的浓度。每个组织在200 μL冰冷的溶液A(0.4 mol/L的高氯酸)中超声匀浆。匀浆液在冰上避光放置1 h,离心20 min(12 000×g,4 ℃),丢弃沉淀。取160 μL的上清液加入80 μL的B液(0.2 mol/L枸橼酸钾、0.2 mol/L EDTA、0.3 mol/L K2HPO4),混合液在冰上静置1 h,再次离心20 min(12 000×g,4 ℃)。取20 μL的混合上清液直接加入到装有C18反相柱(150 mm×4.6 mm,5 μm)和电化学检测器的高效液相色谱中,流动相成分为:125 mmol/L(pH=4.3)枸橼酸-枸橼酸钠缓冲液、0.1 mmol/L EDTA、1.2 mmol/L辛烷基磺酸钠、16%甲醇。流速:1.0 mL/min,5个峰全出时间为32 min。检测器工作电压分别为:50、100、200、300、400、500 mV。脑组织中的单胺类神经递质及其代谢产物浓度用ng/g湿组织表示。
1.3 统计学处理方法 采用SPSS16.0软件包进行分析。计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett’s t检验。P<0.05为差异有统计学意义。
2 结果
2.1 高架十字迷宫和大理石掩埋实验 在给药后第14天,高架十字迷宫实验结果显示,相比于OVX+生理盐水组,OVX+慢性应激+生理盐水组小鼠进入开臂的次数明显减少,在开臂的时间也明显减少,差异均有统计学意义(P<0.01)。这表明卵巢摘除慢性应激小鼠出现焦虑样症状。然而,在给予n-3 PUFA后产生了逆转作用,与OVX+慢性应激+生理盐水组相比,OVX+20 mg/kg n-3 PUFA组和OVX+60 mg/kg n-3 PUFA组及OVX+10 mg/kg氟西汀组小鼠进入开臂的次数和时间均明显上升,差异均有统计学意义(P<0.05)。见图1A-B。
在大理石掩埋实验中得到类似的实验结果,相比于OVX+生理盐水组,OVX+慢性应激+生理盐水组小鼠大理石掩埋数量明显增加,差异均有统计学意义(P<0.01)。给予n-3 PUFA后,与OVX+慢性应激+生理盐水组相比,OVX+20 mg/kg n-3 PUFA组和OVX+60 mg/kg n-3 PUFA组及OVX+10 mg/kg氟西汀组小鼠大理石掩埋数显著降低(P<0.05)。见图1C。
2.2 自主活动实验 为了验证n-3 PUFA的抗焦虑作用,排除给药后药物带来的神经兴奋性或抑制性作用,本研究检测了小鼠的自主活动。结果表明给予n-3 PUFA不同剂量(10、20、60 mg/kg),以及是否卵巢摘除及慢性应激,与假手术相比,均未对小鼠的自发活动总路程造成影响,差异均无统计学意义(P>0.05),见图2。
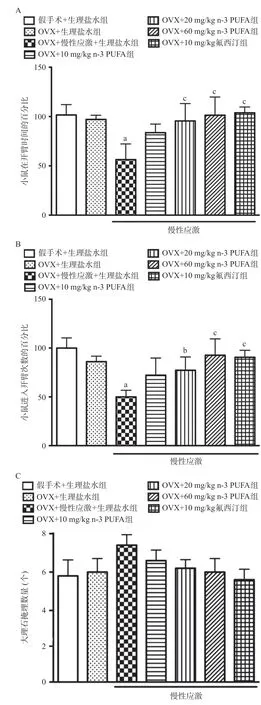
图1 各组小鼠高架十字迷宫和大理石掩埋实验结果

图2 各组小鼠自主活动的总路程
2.3 小鼠各脑区单胺类神经递质及其代谢产物的检测 相比于OVX+生理盐水组,OVX+慢性应激+生理盐水组小鼠前额叶皮层、下丘脑和海马组织里的5-HT含量显著降低(P<0.05)。然而,给予n-3 PUFA后产生了逆转作用,其中20、60 mg/kg组在3处脑组织中5-HT的含量显著上升,与阳性对照药氟西汀给药组结果类似(P<0.05)。各组小鼠前额叶皮层、下丘脑和海马组织中5-HIAA的含量差异无统计学意义(P>0.05)。OVX+慢性应激+生理盐水组小鼠前额叶皮层和海马组织中的5-HIAA/5-HT比值较假手术+生理盐水组升高,给予60 mg/kg n-3 PUFA治疗后显著下降(P<0.05)。见表1-3。
OVX+慢性应激+生理盐水组小鼠3个脑组织中NE含量较OVX+生理盐水组显著降低,经n-3 PUFA治疗后显著增加(P<0.05)。前额叶皮层中,OVX+慢性应激+生理盐水组相比于OVX+生理盐水组DA水平降低,给予n-3 PUFA(20、60 mg/kg)后DA水平显著升高(P<0.05)。dopac的含量在前额叶皮层、下丘脑和海马组织中差异均无统计学意义(P>0.05)。见表1-3。
3 讨论
自然或手术更年期导致雌激素和其他激素水平下降,同时影响其他生理和心理变化[14]。长期处于雌激素水平低下的女性易患各类疾病如皮肤萎缩[15]、记忆改变[16]、骨质疏松症、心血管疾病[17]以及焦虑和抑郁[18]。缺乏n-3 PUFA可诱发可逆的重症抑郁症疾病,更值得关注的是,女性群体中n-3 PUFA与抑郁症的相关性是男性的2倍,且饮食中缺乏n-3 PUFA摄入会增加女性的抑郁症风险,而对男性无影响[19]。大鼠卵巢切除术被用作手术绝经模型(相当于女性双侧卵巢切除术)。研究发现,大鼠卵巢摘除12周后,明显表现出焦虑样行为[20]。临床上采用激素替代治疗法改善围绝经期引发的相关疾病,但是长期使用此法会产生明显的不良反应,如增加脑血管病发生率,形成静脉血栓栓塞和激素依赖性乳腺癌,因此雌激素替代法治疗受到限制[21],寻找理想的药物显得尤为迫切。
表1 n-3 PUFA对前额叶皮层神经递质及其代谢产物浓度的影响(每组n=8,
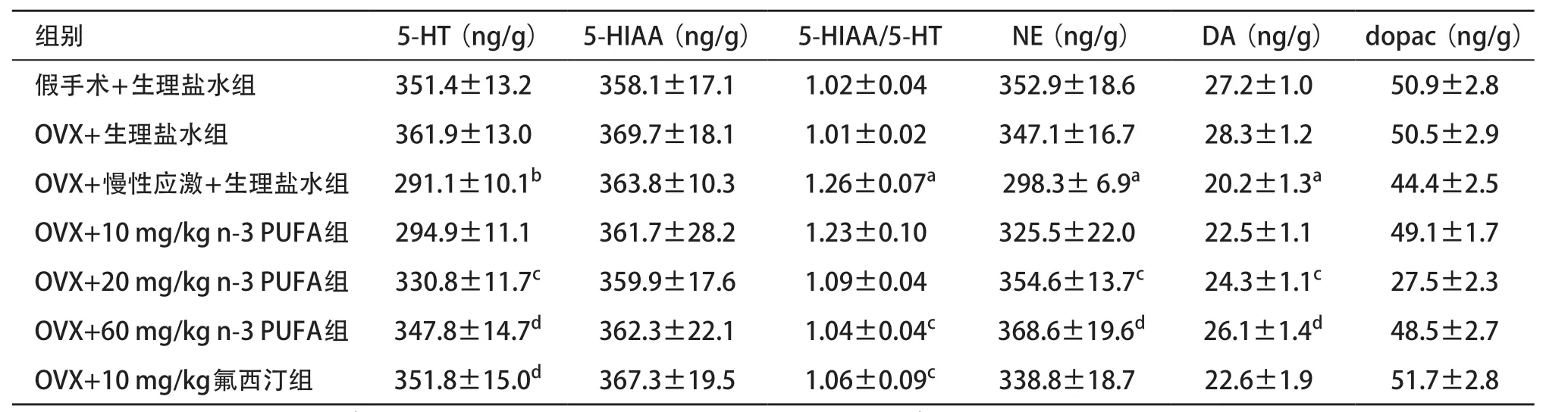
表1 n-3 PUFA对前额叶皮层神经递质及其代谢产物浓度的影响(每组n=8,
与OVX+生理盐水组比:aP <0.05,bP <0.01;与OVX+慢性应激+生理盐水组比:cP <0.05,dP <0.01
组别 5-HT(ng/g) 5-HIAA(ng/g) 5-HIAA/5-HT NE(ng/g) DA(ng/g) dopac(ng/g)假手术+生理盐水组 351.4±13.2 358.1±17.1 1.02±0.04 352.9±18.6 27.2±1.0 50.9±2.8 OVX+生理盐水组 361.9±13.0 369.7±18.1 1.01±0.02 347.1±16.7 28.3±1.2 50.5±2.9 OVX+慢性应激+生理盐水组 291.1±10.1b 363.8±10.3 1.26±0.07a 298.3± 6.9a 20.2±1.3a 44.4±2.5 OVX+10 mg/kg n-3 PUFA组 294.9±11.1 361.7±28.2 1.23±0.10 325.5±22.0 22.5±1.1 49.1±1.7 OVX+20 mg/kg n-3 PUFA组 330.8±11.7c 359.9±17.6 1.09±0.04 354.6±13.7c 24.3±1.1c 27.5±2.3 OVX+60 mg/kg n-3 PUFA组 347.8±14.7d 362.3±22.1 1.04±0.04c 368.6±19.6d 26.1±1.4d 48.5±2.7 OVX+10 mg/kg氟西汀组 351.8±15.0d 367.3±19.5 1.06±0.09c 338.8±18.7 22.6±1.9 51.7±2.8
表2 n-3 PUFA对下丘脑神经递质及其代谢产物浓度的影响(每组n=8,
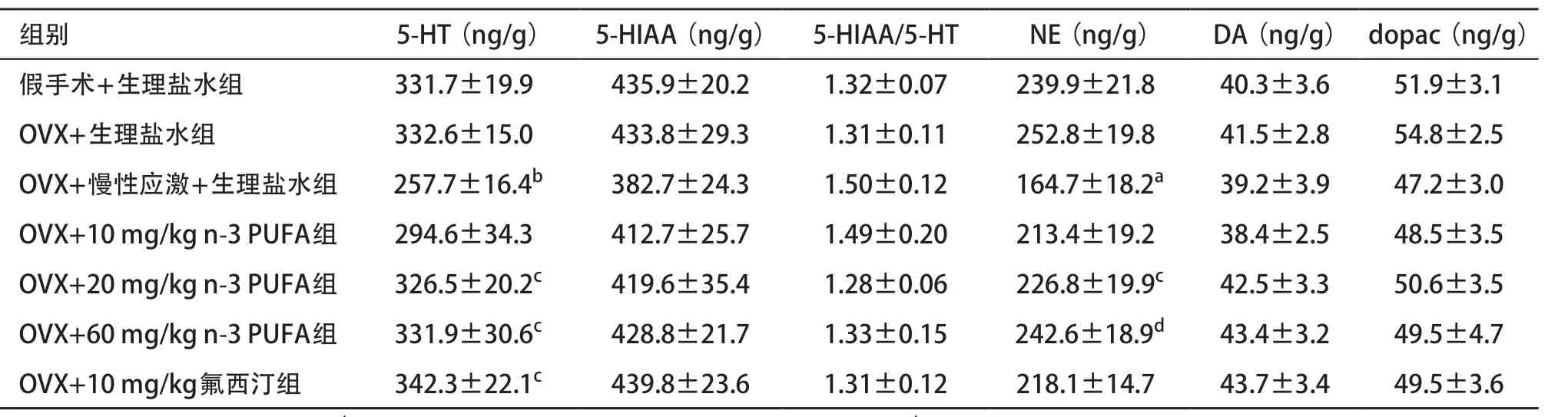
表2 n-3 PUFA对下丘脑神经递质及其代谢产物浓度的影响(每组n=8,
与OVX+生理盐水组比:aP <0.05,bP <0.01;与OVX+慢性应激+生理盐水组比:cP <0.05,dP <0.01
组别 5-HT(ng/g) 5-HIAA(ng/g) 5-HIAA/5-HT NE(ng/g) DA(ng/g) dopac(ng/g)假手术+生理盐水组 331.7±19.9 435.9±20.2 1.32±0.07 239.9±21.8 40.3±3.6 51.9±3.1 OVX+生理盐水组 332.6±15.0 433.8±29.3 1.31±0.11 252.8±19.8 41.5±2.8 54.8±2.5 OVX+慢性应激+生理盐水组 257.7±16.4b 382.7±24.3 1.50±0.12 164.7±18.2a 39.2±3.9 47.2±3.0 OVX+10 mg/kg n-3 PUFA组 294.6±34.3 412.7±25.7 1.49±0.20 213.4±19.2 38.4±2.5 48.5±3.5 OVX+20 mg/kg n-3 PUFA组 326.5±20.2c 419.6±35.4 1.28±0.06 226.8±19.9c 42.5±3.3 50.6±3.5 OVX+60 mg/kg n-3 PUFA组 331.9±30.6c 428.8±21.7 1.33±0.15 242.6±18.9d 43.4±3.2 49.5±4.7 OVX+10 mg/kg氟西汀组 342.3±22.1c 439.8±23.6 1.31±0.12 218.1±14.7 43.7±3.4 49.5±3.6
表3 n-3 PUFA对海马神经递质及其代谢产物浓度的影响(每组n=8,

表3 n-3 PUFA对海马神经递质及其代谢产物浓度的影响(每组n=8,
与OVX+生理盐水组比:aP <0.05,bP <0.01;与OVX+慢性应激+生理盐水组比:cP <0.05
组别 5-HT(ng/g) 5-HIAA(ng/g) 5-HIAA/5-HT NE(ng/g) DA(ng/g) dopac(ng/g)假手术+生理盐水组 576.2±42.6 489.7±39.9 0.86±0.06 363.2±27.5 15.6±1.3 44.7±1.9 OVX+生理盐水组 555.8±36.2 494.2±32.6 0.90±0.08 366.4±25.9 16.0±1.7 43.2±3.6 OVX+慢性应激+生理盐水组 373.9±38.9b 451.6±15.1 1.25±0.12a 279.2±22.0a 11.7±1.0 39.2±2.0 OVX+10 mg/kg n-3 PUFA组 432.0±27.9 432.1±24.1 1.03±0.12 298.1±16.5 12.2±0.8 39.3±2.8 OVX+20 mg/kg n-3 PUFA组 459.4±16.2c 479.6±18.2 1.05±0.06 329.2±14.1 13.9±1.3 38.3±3.6 OVX+60 mg/kg n-3 PUFA组 484.6±24.2c 452.0±18.5 0.94±0.04c 345.0±19.5c 14.6±1.3 40.2±2.3 OVX+10 mg/kg氟西汀组 481.0±29.8c 489.3±11.8 1.04±0.09 321.8±15.1 14.7±0.8 42.8±2.7
日常生活压力是焦虑症发病的一个促发因素。慢性不可预知性应激模拟日常生活所面对的各种压力,是一种经典的动物焦虑模型且已被广泛应用[22]。应激期间变化的、不可预知的应激诱发焦虑,且应激可以诱发焦虑样动物模型出现行为缺陷。而且,抗焦虑药物可以逆转行为学结果和由不可预测的慢性压力引起的神经和神经内分泌系统异常。本研究采用小鼠双侧卵巢摘除恢复1周后,慢性应激2周,每天进行2种不同类型的应激,建立围绝经期焦虑样模型,之后采用高架十字迷宫实验和大理石掩埋实验检验焦虑样行为。OVX+慢性应激+生理盐水组小鼠掩埋大理石的数量显著高于OVX+生理盐水组小鼠,呈现焦虑不安状态,持续给予n-3 PUFA(20、60 mg/kg)可显著逆转此现象。同样在高架十字迷宫中,OVX+慢性应激+生理盐水组小鼠进入开臂的时间和次数显著少于n-3 PUFA治疗组。以上结果表明,持续给予n-3 PUFA可以改善围绝经期焦虑样小鼠行为。该结果与一项Meta分析结果相符,此Meta分析统计了11个国家的2 240例患者发现,相比于安慰组,n-3 PUFA治疗组能显著改善患者的焦虑症状;与亚临床患者相比,n-3 PUFA抗焦虑作用在临床患者上的效果更加明显[23]。SONG等[24-25]发现,饮食中增加EPA含量可以降低大鼠焦虑症行为。综上,我们认为n-3 PUFA对围绝经期女性的焦虑症可能具有调节作用。
焦虑症与5-HT、NE和DA通路的递质传递损伤有关。5-HT涉及多种与情绪、睡眠、学习、记忆和性行为有关的神经精神疾病[26]。5-HT的代谢产物5-HIAA与5-HT的比值是作为衡量神经递质在体内代谢的指标,5-HIAA/5-HT比值下降表明了神经递质代谢减慢。本研究发现围绝经期焦虑症模型组小鼠脑内5-HT含量下降,5-HIAA/5-HT比值增加;持续给予n-3 PUFA 14 d可逆转上述变化,由此可知,n-3 PUFA通过抑制单胺氧化酶的活性来调节体内单胺类神经递质的释放,从而改善焦虑样症状。众所周知,NE在侵略、焦虑、奖赏及其他应激相关的行为中起着重要的作用[27]。本研究结果显示,OVX+慢性应激+生理盐水组小鼠海马、前额叶皮层和下丘脑内NE含量显著下调,持续给予n-3 PUFA 14 d可逆转上述变化。因此,n-3 PUFA改善焦虑症状态与影响NE递质有关。有研究指出,DA通路在精神恍惚的抑郁样患者作用更明显[28]。然而n-3 PUFA在本研究中对下丘脑和海马中的DA含量没有影响,对前额叶皮层有作用。其可能解释为,海马、前额叶皮层和下丘脑都参与了抑郁、焦虑、学习记忆在内的多种重要行为的改变[29],然而主流研究认为边缘系统在焦虑症方面有着重要的作用,特别是前额叶皮层和海马。重症抑郁症患者尸检发现,n-3 PUFA的主要组成物质DHA在女性前额叶皮层中的含量显著降低[30]。由此我们推测,前额叶皮层对于n-3 PUFA在情绪调节方面(特别是抑郁和焦虑症)的作用更加敏感。总之,n-3 PUFA能调节脑内单胺类神经递质与其代谢产物的含量,有望成为具有一定前景的抗焦虑药物。
