PD-L1在结直肠癌组织中的表达及临床意义
2020-12-24杜舟黄萍黄国裕韩少良左志贵
杜舟,黄萍,黄国裕,韩少良,左志贵
(1.温州医科大学附属第一医院 疝与腹壁外科,浙江 温州 325015;2.温州医科大学 发展规划处,浙江温州 325035;3.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015;4.温州医科大学附属第一医院 结直肠肛门外科,浙江 温州 325015)
结直肠癌是全球最常见的消化道恶性肿瘤之一,每年有近102万的新发病例以及约53万的死亡病例,位居世界恶性肿瘤发病率和病死率第3位[1]。我国的结直肠癌多见于中年人,因其在临床上常缺乏较为典型的症状和体征,发现及确诊时多已进入癌症中晚期,导致了我国结直肠癌第5位的高病死率,并呈现持续上升的趋势[2-3]。免疫逃逸是肿瘤发生发展的重要机制之一,它是一个需要协同刺激分子参与的肿瘤抗原性特异性T细胞诱导凋亡和无反应性的过程[4]。程序性死亡配体-1(programmeddeathligand 1,PD-L1)是重要的协同刺激分子B7家族的成员之一,因此也称B7-H1。研究发现,PDL1在肺癌、肝癌、乳腺癌、鳞状细胞癌及卵巢癌等多种癌组织内[5]以及多种肿瘤细胞内均存在高度表达[6],升高的PD-L1与程序性死亡受体-1(programmed death I,PD-1)相结合,从而减弱组织的抗肿瘤免疫反应。然而,其在结直肠癌中的表达情况鲜有报道。本研究通过检测PD-L1在结直肠癌组织、相应癌旁正常组织中的表达情况,观察PD-L1的表达与结直肠癌患者临床病理特征之间的相关性,探讨其潜在的临床意义。
1 资料和方法
1.1 一般资料 随机选取2016年1月至2017年1月温州医科大学附属第一医院50 例结直肠癌手术患者,所有纳入实验的患者均经病理学确诊为结直肠癌,且直至术前均未接受放/化疗,各项临床检测指标完整无缺失。纳入实验的50例结直肠癌患者在术中获取肿瘤组织用以后续实验,并获取在距离肿瘤组织5 cm以上的癌旁组织作为对照。纳入实验的患者,男33例,女17例,年龄(63±12)岁。入组的患者均在住院期间完成常规术前检查,记录肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原199(carbohydrate antigen 199,CA199)水平,术中对癌组织进行病理切片明确癌组织分化程度,淋巴结转移情况,并且追踪并记录是否进行化疗。本研究经本院伦理委员会批准,所有入组患者均知情同意。
1.2 方法
1.2.1 RT-qPCR:使用TRIzol试剂(美国Promega公司)从组织中提取总RNA并进行定量。将1 μg RNA进行反转录(反转录试剂盒购自美国Promega公司)以合成cDNA。随后,在基因特异性引物的存在下,用SYBR Premix ExTq(日本Takara公司)对cDNA和ROX II的混合物进行实时定量PCR。下一步,在CFX96实时PCR检测系统(美国Bio-RAD公司)中根据PCR标准化方案定量转录PD-L1。采用管家基因β-actin作为内部对照。引物序列见表1[7]。

表1 PCR引物序列
1.2.2 Western blot:将组织进行匀浆并使用裂解缓冲液[50 mmol/L Tris,150 mmol/L NaCl,0.5%Nonidet-40,5 mmol/L EDTA,1 mmol/L PMSF(pH 8.0)]进行裂解,然后在13 000×g、4 ℃下离心30 min。通过BCA蛋白质测定试剂盒(上海碧云天公司)确定上清液中的蛋白质浓度。随后,通过在4×nuPAGE上样缓冲液(美国Life Technologies公司)中加入20 μg在100 ℃下加热5 min后变性的等量蛋白质,通过10% SDS-聚丙烯酰胺凝胶(美国Life Technologies公司)电泳进行跑胶,并将蛋白转膜至PVDF膜(美国Millipore公司)上。用含有0.05% Tween-20的Tris缓冲液(TBST)配制5%脱脂牛奶进行封闭,随后用抗体(英国Abcam公司)PD-L1(1:10 000)、β-actin(1:5 000)在4 ℃下孵育过夜。第2天使用二抗孵育,并使用Image Lab软件(美国Bio-Rad公司)进行扫描和半定量分析。
1.3 统计学处理方法 采用SPSS22.0统计学软件进行数据分析。计量资料用表示,2组间比较采用两独立样本t 检验,计数资料分析采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 PD-L1在结直肠癌组织、癌旁正常组织中的表达 在50例结直肠患者中,PD-L1 mRNA水平在癌组织中显著高于癌旁正常组织(1.00±0.20 vs.1.86±0.61,P<0.05)。与癌旁组织相比,结直肠癌组织中PD-L1 蛋白表达量也显著升高(0.32±0.22 vs.1.21±0.68,P<0.05)。选取5例患者的Western blot条带图,较为典型地展示同一患者癌组织与癌旁组织PD-L1蛋白水平的差异,见图1。
2.2 结直肠癌组织中PD-L1的表达与临床病理特征的关系 在结果2.1中,将Western blot条带灰度值为0判断为PD-L1蛋白阴性(-)表达,将其余判定为PD-L1蛋白阳性(+)表达。通过统计分析,PD-L1的表达在性别、年龄、部位以及组织学分类及术前CEA、CA199水平中差异无统计学意义(P>0.05);PD-L1在中低分化的癌组织中表达阳性率高于高分化癌组织(P=0.050);PD-L1的表达与淋巴结转移与否有关,发生淋巴转移的癌组织PD-L1阳性表达率明显高于无淋巴转移者(P<0.05),见表2。
3 讨论
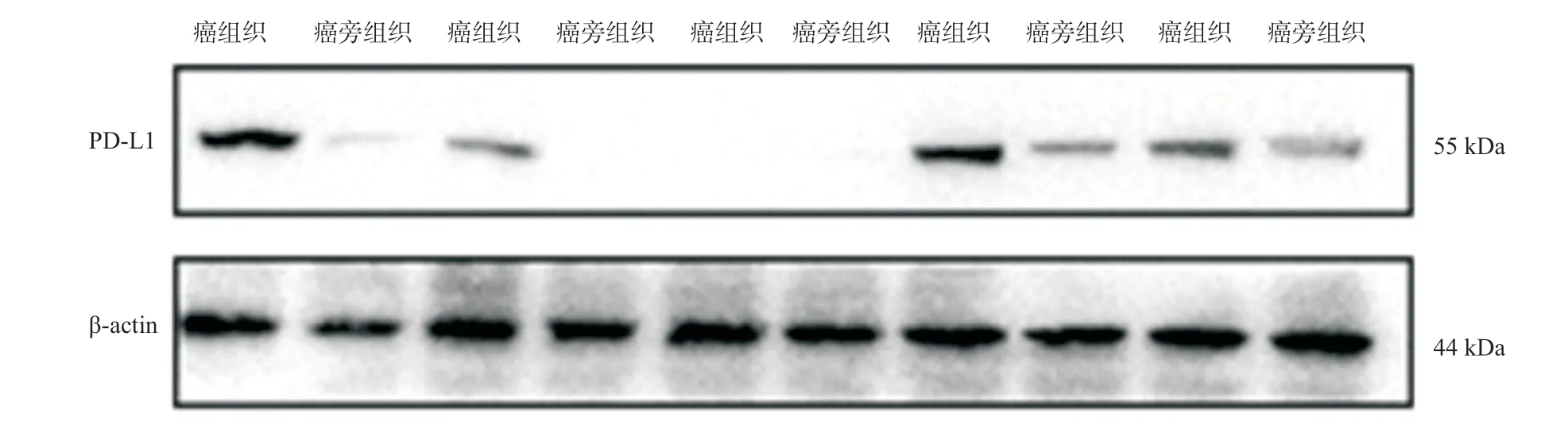
图1 结直肠癌患者PD-L1蛋白条带图
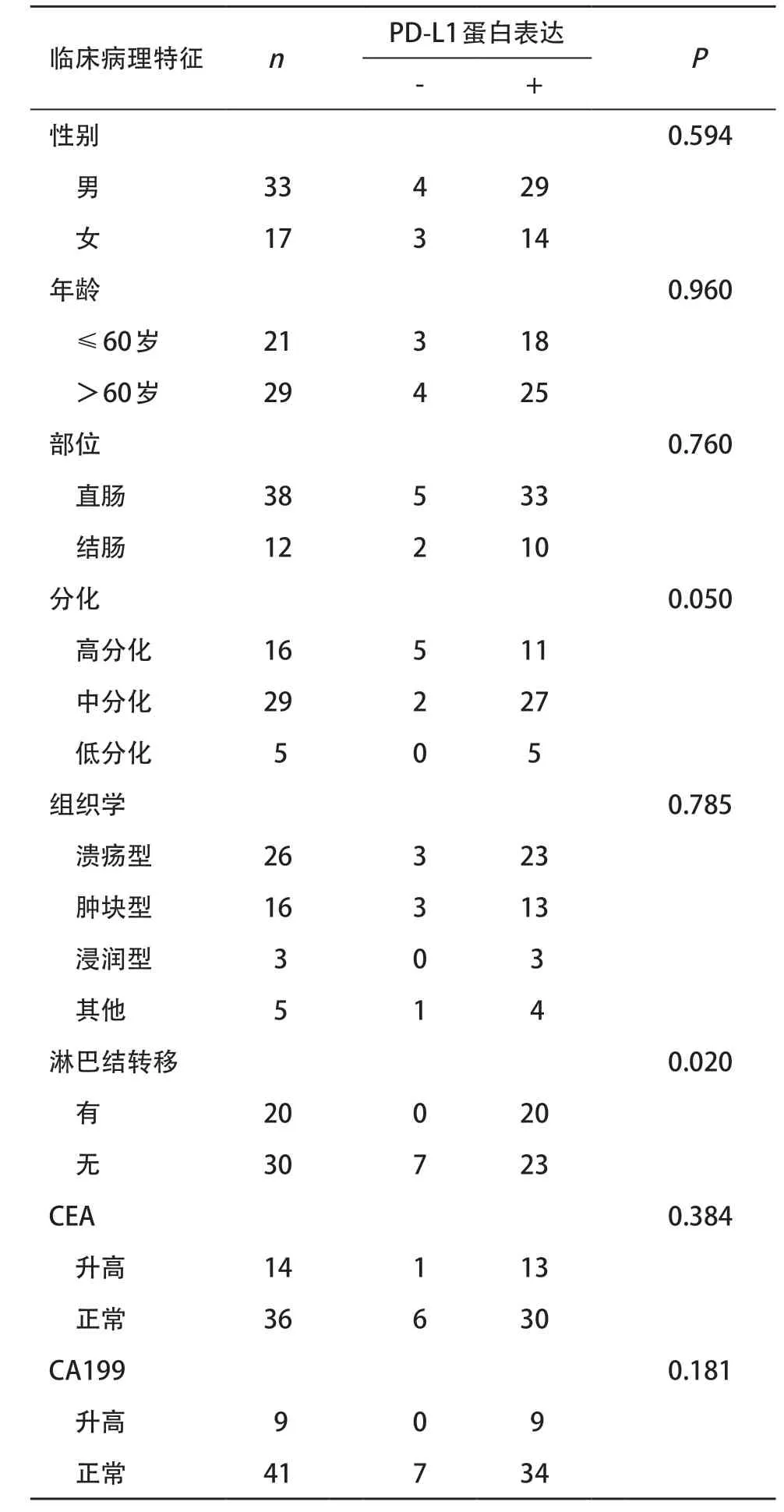
表2 结直肠癌患者基本特征与临床病理特征(例)
随着我国人民生活水平不断提高,国民饮食结构发生了较大的变化,结直肠癌发生率逐年升高[8]。临床上普遍运用肿瘤标志物CEA和CA199联合检测来诊断结直肠癌并进行预后判断[9]。CEA的升高对诊断结直肠癌有着很大的参考价值,但缺乏较高的敏感度[10],常导致诊断及治疗最佳时期的错失。近些年随着对肿瘤免疫学研究的不断发展,免疫逃逸机制的作用越来越为众多研究者所重视。其中,CTL介导的T细胞免疫是人体抗肿瘤的主要细胞免疫之一。而协同刺激分子的缺失,将导致第二信号的缺如,从而导致肿瘤细胞逃避机体的免疫系统,不断地增殖和扩散[11]。人体的程序性死亡分子PDL1基因位于染色体9q24,可通过与CD28超家族中的受体PD-1相结合,调节机体的免疫反应。
本研究通过基因水平及蛋白表达水平对50例结直肠癌患者进行观察,结果显示:在基因水平,结直肠癌组织中的PD-L1水平显著高于癌旁组织,这一结果与SASIDHARAN等[7]的研究结果相一致。在蛋白质水平,PD-L1蛋白在结直肠癌组织中的阳性表达率比癌旁正常组织高,且PD-L1在中低分化癌组织中的阳性率明显高于高分化癌组织,相似的实验结果在胃癌组织的PD-L1检测中也有报道[12]。HUA等[13]研究表明33例结直肠癌患者中PD-L1的表达明显高于正常组织。已有研究报道PD-L1在多种实体肿瘤组织中呈现表达上调,如乳腺癌[14]、肾癌[15]、肺癌[16]等。但国内外有关PD-L1的高表达现象与癌症患者临床病理特征的相关性尚未达成共识[17]。PD-L1/PD-1信号通路通过诱导T细胞凋亡或无能、促进免疫抑制因子的产生等机制削弱机体抗肿瘤免疫应答,促进肿瘤的免疫逃逸,与肿瘤的高侵袭性及不良预后相关[18]。本研究显示PD-L1在肿瘤组织中的表达还与淋巴结转移有关,有淋巴结转移的患者PD-L1阳性率显著高于无淋巴结转移患者,我们推测PD-L1表达越强的患者,肿瘤转移可能性越大,其预后越差。这也进一步表明PD-L1可能参与肿瘤免疫逃逸机制。LIN等[19]研究表明肺癌组织PD1、PD-L1阳性表达与肿瘤直径、淋巴结转移及组织学分级有关。TOPALIAN等[20]研究发现肿瘤细胞表达的PD-L1过程中下调了肿瘤细胞和基质细胞微环境中浸润型T细胞的数量,认为肿瘤细胞表达PD-L1在抵抗肿瘤的免疫反应过程中发挥着重要的作用。张占芳等[21]通过流式细胞学技术检测75 例患者骨髓原始细胞中PD-L1的表达情况发现,PD-L1在白血病细胞中表达的总体阳性率为32%,表明PD-L1可能参与白血病细胞的免疫逃逸及原发耐药机制,WANG等[22]通过对胰腺癌病例建立COX比例风险回归模型分析发现PD-L1可作为胰腺癌患者预后评价的独立指标。
综上所述,本研究中结直肠癌组织中的PD-L1表达明显高于癌旁组织,并且与肿瘤的分化程度及淋巴结转移相关,表明其可能作为判断结直肠癌患者病情进展及预后的依据之一,同时,也提示PD-L1在肿瘤的免疫逃逸中发挥一定作用。有文献报道PD-1/PD-L1信号通路通过ITSM磷酸化从而调节细胞代谢、蛋白合成、增殖与凋亡的经典通路PI3K-AKTmTOR来参与免疫应答[23]。本课题组将会在后续的实验中验证PTEN-PI3K-Akt通路对PD-L1表达调控的具体机制。
