射频消融治疗儿童房室折返性心动过速的临床评价
2020-12-23刘国林易岂建殷跃辉吕铁伟
刘国林 许 欣 易岂建 田 杰 殷跃辉 吕铁伟
1.重庆医科大学附属儿童医院心内科 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地;2.儿科学重庆市重点实验室;3.重庆医科大学附属第二医院心内科(重庆 400014)
室上性心动过速是儿童最常见的心律失常之一,其发病率约为0.1%~0.4%[1],其中以房室折返性心动过速(atrioventricular reentrant tachycardia,AVRT)最为常见。儿童室上性心动过速的临床症状不一,反复或持续性发作患儿可出现明显的血流动力学障碍,导致心动过速性心肌病、心功能不全甚至发生恶性心律失常及猝死。以往临床上主要是根据心律失常的类型选用适宜的抗心律失常药物,但是药物治疗通常只能缓解症状,而不能达到根治目的。且药物的长期使用可能出现药物相关的不良反应及致心律失常。同时,电复律治疗虽能治疗疾病但不能有效防止心律失常复发。射频消融(radiofrequency catheter ablation,RFCA)从根本上解决了室上性心动过速的发生机制,因而已经成为根治儿童各类快速性心律失常的一线根治方案。但目前国内儿童领域能开展此项技术的医疗中心不多,临床样本量不大,需要积累更多的治疗经验促进技术的推广。本文旨在重点分析AVRT患儿临床特征、旁路类型及部位,评估射频消融治疗的效果及安全性。
1 对象与方法
1.1 研究对象
回顾性分析2014年10月至2020年4月期间在重庆医科大学附属儿童医院心血管内科接受电生理检查,确诊为AVRT并接受RFCA治疗患儿的临床资料。纳入标准:①年龄4~18岁;②室上速反复或持续性发作伴心功能不良且药物治疗无效;③体质量≥15 kg,反复发作的症状性室上速;④心室预激导致预激性心肌病,药物治疗无效或不能耐受[2]。排除标准:①存在血小板减少性疾病及术前有长期服用抗血小板药物或肝素使用史;②合并心功能不全无法耐受手术。
根据电生理检查确定房室旁道数量及部位,将入选研究对象分为左侧单房室旁道组、右侧单房室旁道组以及双房室旁道组。
1.2 方法
1.2.1 临床资料收集 收集患儿入院基本病史资料,术前及术后心电图、彩色多普勒超声心动图,手术参数包括:仪器设备、手术时间、累计消融时间、消融功率(W)和消融温度(℃)。
1.2.2 术前准备 入院后仔细询问患儿病史资料,完善三大常规、肝肾功能、电解质、心肌标志物、凝血五项、肝炎标志物、梅毒、HIV和输血相关检查等,术前行12导联心电图、超声心动图和胸部X线检查,明确患儿有无器质性心脏病,除外手术相关禁忌。所有的抗心律失常药物在导管消融前停用至少5个半衰期,以实现完全的药理清除。
1.2.3 电生理检查 常规予以静脉复合麻醉。经双侧股静脉及左锁骨下静脉穿刺分别插入电极导管至高位右房、冠状静脉窦(冠状窦)、希氏束及右室心尖部,体表同步心电图和心内膜电位被记录并存储在多通道记录仪,分别在心房和心室予以S1 S1分级递增刺激和S1 S2程控刺激,观察能否诱导心动过速,进而对房室旁道进行定性及定位诊断。
1.2.4 射频消融 显性预激在窦性心律时标测心室最早激动点,隐匿性旁路予以诱发心动过速或对心室进行起搏时标测心房最早激动点,部分患儿应用Carto三维标测系统(Carto three-dimensional mapping system,CARTO),根据理想靶点图确定最佳靶点位置,消融成功后观察15分钟。消融终点:①Delta波消失,QRS波转为正常,电生理检查为房室向心性递减传导,证实旁路的前传功能丧失;②旁路逆传功能丧失,心室刺激提示房室分离或房室呈向心性递减传导;③再次诱发无心动过速发生。显性旁路应同时具备以上3条标准,隐匿性旁路只需具备后2条标准。消融结束后,在出院前对患者进行48小时的监护。出院后患儿定期门诊随访体表12导联心动及动态心电图,并电话随访患儿有无临床症状及检查结果,评估患儿RFCA后复发情况。
1.3 统计学分析
应用SPSS 26.0统计软件进行数据处理。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数范围)表示,组间比较采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
共纳入83例AVRT患儿,其中男48例、女35例;平均年龄(9.48±2.88)岁,范围4~15岁,中位体质量为31(23.5~42.5)kg;中位病程为11(5~24)月。患儿表现为心慌、心悸71例(85.5%),胸闷气短31例(37.3%),面色苍白16例(19.3%),心前区疼痛15例(18.1%),头晕11例(13.3%),呕吐3例(3.6%),无晕厥。
2.2 RFCA总体效果评价
RFCA即时成功81例,成功率为97.6%,1例因出现Ⅲ度房室传导阻滞提前终止,还有1例因旁道过于靠近希氏束而放弃RFCA。左侧旁道53例,成功消融51例(96.2%),其中49例为游离壁旁道,2例为间隔旁道。右侧旁道25例,成功消融25例(100%),其中游离壁旁道21例,间隔部旁道4例,双旁道5例,成功消融5例(100%),包括左侧双旁道2例,其中1例为左侧游离壁双旁道,1例为左侧游离壁旁道+左侧间隔旁道;右侧双旁道1例为右侧游离壁双旁道,还有左侧游离壁旁道+右侧间隔旁道2例。
83例患儿平均累计消融时间(149.8±42.2)s。左侧单房室旁道组的平均累计消融时间为(140.2±36.3)s,右侧单房室旁道组为(170.0±47.3)s,组间差异有统计学意义(P=0.003)。其余旁道电生理检查结果见表1。
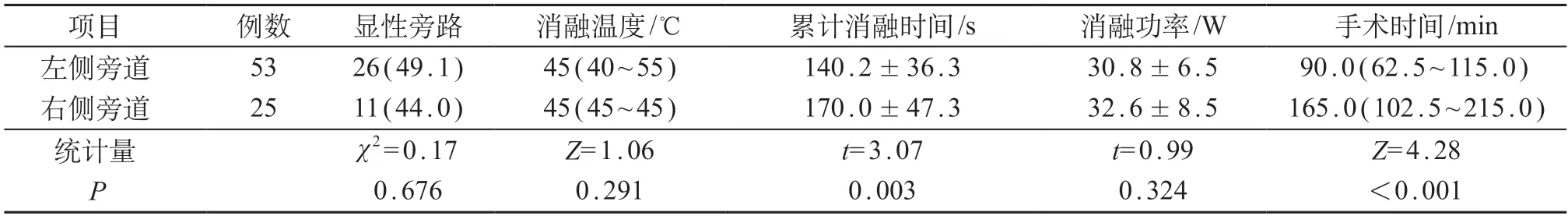
表1 旁道电生理检查结果比较
2.3 RFCA后并发症
共出现并发症5例(6.0%),其中1例术中出现I度房室传导阻滞合并右束支阻滞,放弃手术后予以白蛋白输注后恢复正常传导,考虑一过性心肌水肿可能。1例左侧后间隔旁道患儿术中消融出现房室分离的同时出现III度房室传导阻滞,停止手术予以甲基泼尼松龙抗炎后无好转,予以植入永久起搏器。还有2例患儿术后出现股动脉血栓,其中有1例术后予以尿激酶溶栓效果欠佳,再予以介入溶栓后好转。1例出现腹股沟血肿。
2.4 RFCA后随访结果
所有患儿RFCA后总共复发10例,复发率12.3%,5例二次消融成功(消融参数见表2),1例复发后因临床症状不明显,未再消融。左侧旁道复发3例(5.7%),均为游离壁旁道。右侧旁道复发6例(24.0%),其中5例为游离壁旁道,1例为间隔旁道。双旁道复发1例(20%)为左侧游离壁旁道+右侧间隔旁道。右侧旁道(24.0%,6/25)消融后的复发率高于左侧旁道(5.7%,3/53),差异有统计学意义(χ2=3.95,P=0.047)。
2.5 先天性心脏病及三维标测
83例患儿中共有10例患儿合并先天性心脏病,其中合并动脉导管未闭3例,房间隔缺损2例,室间隔缺损1例,合并主动脉病变及冠状动脉(冠脉)起源异常1例。还有3例患儿合并Ebstein畸形(Ebstein anomaly),但均在术后3个月内复发。RFCA即时成功率为100%,复发率为30%。

表2 重复射频消融参数
本研究中共有13例患儿使用Carto系统,左侧单房室旁道4例,右侧单房室旁道7例,双房室旁道2例;并且其在右侧单房室旁道组中的使用比例(28.0%,7/25)明显大于左侧单房室旁道组(0.08%,4/53),差异有统计学意义(χ2=4.30,P=0.038)。即时成功率为100%,复发率为15.4%(2/13)。
3 讨论
AVRT是儿童最常见的快速性心律失常,在儿童中可伴有不同程度的临床症状,严重时可出现恶性心律失常甚至猝死。本组患儿以男性居多,这与相关研究结果一致[3]。本组患儿大多以心慌、心悸为主要临床表现,有3.6%患儿合并有呕吐症状。研究显示,呕吐症状是儿童室上速中鉴别AVRT的最佳症状指标,但不除外可能是某特定年龄段的特征表现[3]。既往常予以抗心律失常药物治疗,包括洋地黄、普罗帕酮、维拉帕米、腺苷、胺碘酮及索他洛尔等,但不良反应使其在儿科领域的使用受到局限。但近期研究发现,静脉注射索他洛尔对儿童AVRT转复为窦性心律的速度明显快于其他类型的心动过速,且患儿有良好的耐受性,但由于其负性肌力作用目前仅用于左室射血分数≥50%的患儿[4]。既往认为,对于无症状的预激综合征不需要治疗,但最新研究显示,儿童预激综合征的危险程度主要取决于房室旁道的电生理特性,而并非有无临床症状。电生理检查时房室旁道顺行有效不应期(anterograde effective refractory period of the accessory pathway,AP-AERP)≤240 ms均为室颤或者恶性心律失常的高危人群,即使无临床症状也建议行RFCA[5]。
消融时旁道定位是否准确以及是否彻底阻断旁道是减少术后复发的关键。本研究显示左侧旁道的发生率高于右侧旁道,消融右侧旁道的手术时间及累计放电时间均长于左侧旁道,且右侧旁道消融后的复发率高于左侧旁道,这与本中心既往研究报道相符[6]。复发原因主要考虑为下列几点:①标测右侧旁道时缺乏冠状窦电极类似参照物,且右侧间隔解剖较复杂(冠状窦憩室),旁道插入点位置变异大,可以在瓣环靠房侧或者靠室侧,不易准确、有效地进行标测;②由于三尖瓣环的解剖特点导致消融导管贴靠不稳定,消融电极不能持续有效地放电;③右前、中间隔旁道靠近房室结,消融时易损伤房室结导致Ⅲ度房室传导阻滞而放弃手术,且右侧纤维组织较厚,心肌含水量更高,易导致消融不完全;④右侧旁道的发生率较高,对设备及术者的技术要求都较高。此外,儿童双房室旁道发生率高于成人[7]。本组患儿双房室旁道发生率为6.0%,国外大样本回顾性研究报道约为10%[8]。考虑到本组患儿中双旁道患儿数量较少,还需扩大样本量进一步针对性研究。并且,相关研究报道旁道的数量以及存在间歇性预激也是RFCA后复发的高危因素[9]。
本组患儿中有1例因旁道过于靠近希氏束而放弃RFCA,主要原因为在间隔部分进行消融时易损伤希氏束而发生房室传导阻滞,这在技术和设备上都具有挑战性。国外推荐对过于靠近正常房室传导系统的旁路使用冷冻消融,它的优点在于导管有更好的稳定性以及可以在病变可逆的情况下评估消融的结果,并且国外汇总研究报道冷冻消融在儿童间隔旁道的总成功率在89%左右[10]。当右侧前间隔多次消融仍不能阻断旁道时,考虑旁道位于组织深层,射频能量难以侵入深层组织阻断旁路传导,可考虑经主动脉逆行途径从无冠状窦内或者无冠状窦与右冠状窦之间的移行区进行标测消融,这是一种可行、有效、安全的消融策略[11]。
值得注意的是,本组患儿中有3例合并Ebstein畸形,因其组织解剖特点,大约30%儿童可合并一条或多条旁道,并且出现恶性心律失常及心力衰竭的风险高[12]。研究发现,沿房室沟的嵴状突出是Ebstein畸形的常见特征,并且与房室旁路的存在有相关性,这一隆起对导管操作和消融能量的传输造成了潜在的障碍[13]。尽管目前射频消融的成像、标测和能量输送技术取得了重大进展,但Ebstein畸形患儿RFCA后的复发率仍然相对较高。还有1例患儿为后间隔心外膜旁道,予以冠脉造影提示冠脉起源异常,相关研究显示后间隔心外膜旁道消融更加复杂,并且有更高的复发率、房室传导阻滞以及潜在的冠脉损伤风险,冠脉损伤的主要危险原因是由于儿童心腔小,冠状动脉离消融点较近[14-15]。研究表明,冠脉损伤风险与冠状窦内射频能量传递部位到冠脉之间的距离直接相关[16]。因此,儿童AVRT合并复杂性先天性心脏病不仅增加手术的困难性,而且容易出现各种并发症,对术后复发率也造成一定的影响,所以需要高水平专业知识和经验丰富的术者以及更加先进的设备才能最大限度地提高成功率并且将并发症发生率降至最低。
目前,RFCA最常见的并发症包括房室传导阻滞、急性心包填塞、外周血管损伤和出血、气胸和血栓栓塞等。本研究中并发症发生率约为6%,其中包括Ⅲ度房室传导阻滞以及动脉血栓等严重并发症。因此,对于儿童RFCA后并发症的检测及处理不容忽视,监测白细胞介素-6和超敏C-反应蛋白水平有助于评估RFCA后心肌损伤和炎性反应情况,并且监测D二聚体、血小板膜蛋白-140和凝血酶-抗凝血酶Ⅲ复合物水平有助于诊断和预防血栓栓塞[17-18]。此外,RFCA后常规予以超声心动图检查心包积液,心室功能恶化和瓣膜损伤等无症状性并发症也有重要意义[19-20]。
美国心脏病学会建议将辐射剂量保持在尽可能低的水平——ALARA原则(As Low As Reasonably Achievable)[21]。有研究已经证实,在RFCA中可降低透视X射线参数来减少辐射暴露的可行性,且未改变RFCA成功率[22]。同时近几年已将非荧光系统(EnSite NavX系统或3 D Carto系统)引入RFCA应用于儿童心律失常的治疗,有助于快速准确地标测到房室旁路 靶点,对缩短曝光时间、提高成功率和安全性有重要临床意义[23-24]。虽然本研究中Carto相关 复发率较高,其原因主要考虑本研究中心既往多将其用于右侧旁道、合并复杂先天性心脏病或者术后复发再次消融的患儿,但随其近年在国内儿科领域应用的进一步扩展,将更广泛的应用于儿童快速性心律失常中。
综上所述,RFCA治疗儿童AVRT是安全、有效的,并且通过不断积累经验,提高操作技术,可使儿童AVRT的射频消融治疗更加规范化、客观化和流程化,进一步提高RFCA的安全性及有效性。
