肺炎支原体肺炎患儿支气管肺泡灌洗液细胞因子特点及相关性分析
2020-12-23谢晓虹王崇杰张光莉骆学勤罗征秀刘恩梅
谢晓虹 王崇杰 张光莉 骆学勤 罗征秀 刘恩梅 罗 健
重庆医科大学附属儿童医院呼吸中心 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地 儿科学重庆市重点实验室(重庆 400014)
肺炎支原体(Mycoplasma pneumoniae,MP)是儿童社区获得性肺炎的常见呼吸道病原体,肺炎支原体肺炎(Mycoplasma pneumoniaepneumonia,MPP)通常具有自限性,阿奇霉素治疗有效且预后良好。近年来儿童重症MPP发病率增高,对于阿奇霉素治疗不敏感的难治性MPP病例增多。这部分患儿急性期治疗棘手,后期可能出现支气管扩张、闭塞性细支气管炎等后遗症,因此寻找早期识别重症MPP和难治性MPP的生物学标志物是目前的研究热点。外周血乳酸脱氢酶(lactic dehydrogenase,LDH)可作为评估MPP病情和预判是否难治的重要指标[1-2],但不能反映肺部感染灶的真实炎症状态。支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)来自于病变部位,BALF中细胞因子表达情况和细胞学分类能直接反映局部炎症情况。已有研究发现,重症和轻症MPP患儿BALF前炎症细胞因子表达量有显著差异,且对病情有一定预测作用[3-4]。但MPP炎症应答是机体和MP共同作用的结果,镜检时的病程、肺内病变类型和MP载量均可能引起BALF细胞因子水平的差异。本研究回顾总结122例MPP患儿BALF细胞因子特点,及外周血生化指标(D-二聚体、LDH和白蛋白)与BALF各细胞因子相关性,并分析发热症状、镜检时是否持续发热、MP载量、肺内病变类型和阿奇霉素治疗对BALF细胞因子检测的影响,为临床评判和治疗提供参考。
1 对象与方法
1.1 研究对象和分组
研究对象为2019年7月至2020年1月重庆医科大学附属儿童医院呼吸中心确诊的MPP患儿。入选标准:符合MPP诊断标准且年龄<18岁[5],重症MPP符合国内儿童重症社区获得性肺炎(CAP)诊断标准[6]。排除标准:①鼻咽抽吸物(nasopharyngeal aspiration,NPA)和BALF检出除MP以外的其他病原体;②有原发性免疫缺陷、先天性心脏病和支气管哮喘等基础疾病者。
研究对象根据病情分为重症组和普通组;根据临床症状是否有发热分为有热组和无热组;根据支气管镜检时间与发热的关系分为持续发热镜检组(起病至支气管镜检期间每天至少发热1次)和热退镜检组(起病时有发热,但支气管镜检时体温正常至少24小时);根据BALF标本MP拷贝数分为高拷贝组(≥106copies/mL)和低拷贝数组(<106copies/mL);根据患儿胸部CT影像特点分为实变组(影像报告为单个或多个肺叶大片状致密影)和斑片影组(影像报告为沿支气管血管束分布的斑片致密影,无大片状致密影);根据阿奇霉素起效时间分为单一阿奇霉素有效组(阿奇霉素起效时间≤7天,阿奇霉素起效时间为单一阿奇霉素治疗后体温正常时的用药天数)与单一阿奇霉素无效组(阿奇霉素治疗7天仍有发热);根据出院后4周胸部影像学吸收情况分为完全吸收组(影像学报告为肺内病变基本吸收或较前次明显吸收)和部分吸收组(影像学报告为肺内病变较前次略吸收或改变不明显)。
1.2 方法
1.2.1 一般临床资料收集 回顾性收集研究对象一般资料、临床表现、实验室检查、支气管镜检查结果、胸部影像结果和住院用药情况等数据。实验室检查数据包括C-反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、D-二聚体、LDH;NPA和BALF病原学检测(直接免疫荧光法检测呼吸道合胞病毒、腺病毒、流感病毒A和B型、副流感病毒1~3型,培养法检测细菌,聚合酶链反应法检测MP、肺炎衣原体、腺病毒和结核分支杆菌);BALF行细胞学分类,BALF用流式细胞因子微球检测法(cytometric beard assay,CBA)检测细胞因子,包括白细胞介素-2(interleukin-2,IL-2)、IL-4、IL-6、IL-10、肿瘤坏死因子α(tumour necrosis factor-α,TNF-α),干扰素-γ(interferon-γ,IFN-γ)和IL-17A;BALF样本用荧光探针聚合酶链反应法检测肺炎支原体耐大环内酯类基因A2063G和A2064G表达。实验室和支气管镜检查数据均为入院后首次检查结果。住院用药情况为口服和/或静脉输注阿奇霉素时间。胸部影像学包括住院期间胸部CT、出院后胸部CT或胸部X片结果,均由相应资质的放射科医师审核报告。首次随访时间为出院后2周。
1.2.2 BALF收集方法 采用Olympus BF-P260F(外径4.0 mm)或Olympus BF-XP260F (外径2.8mm)支气管镜经鼻咽部、会厌、声门、气管到达各段支气管,根据胸部CT病变选择灌洗部位。每位患儿给予37 ℃生理盐水0.5~1 mL/kg,不超过20 mL/次进行灌洗。按照欧洲呼吸病学会推荐[7],收集第1管灌洗液送病原学检测,第2和第3管灌洗液合并送细胞学和细胞因子检测。
1.3 统计学分析
采用SPSS 24.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2或校正χ2检验。两变量间相关性检验采用Spearman秩相关分析。以P<0.05为差异有统计学意 义。
2 结果
2.1 一般情况
共收集MPP患儿122例,男62例、女60例,男女比例1.03:1;中位年龄4岁(范围1~14岁),<3岁29例、~6岁46例、≥6岁47例;支气管镜检灌洗平均时间为发病后(11.5±0.4)天。重症MPP患儿37例,包括持续无创正压通气32例,机械通气1例,胸腔积液行胸腔穿刺检查6例。
发热患儿97例,其中重症占33.0%,平均镜检灌洗时间为发病后(10.5±0.3)天;无热患儿25例,重症占20.0%,平均镜检灌洗时间为发病后(15.3±1.2)天;两者灌洗时间差异有统计学意义(t=5.61,P<0.001)。发热患儿分为持续发热组25例,重症占44.0%;热退组72例,重症占29.2%,其中热退1~3天行镜检灌洗50例,热退3~5天行镜检灌洗22例。持续发热组平均镜检灌洗时间为发病后(10.3±0.4)天,热退组平均镜检灌洗时间为发病后(10.6±0.3)天,两组差异无统计学意义(t=0.41,P=0.683)。
NPA或BALF标本检测MP高拷贝数患儿86例,29例重症(33.7%)。64例MPP患儿行肺炎支原体耐大环内酯类药物基因检测,44例阳性(68.8%),重症MPP耐药基因阳性率为60.0%(18/30),普通MPP耐药基因阳性率76.5%(26/34)。胸部影像学以肺叶实变影为主要特点的MPP患儿51例(41.8%),15例重症(29.4%);以斑片影为主要特点的MPP患儿71例(58.2%),22例重症(31.0%)。97例发热MPP患儿中有7例未用阿奇霉素治疗发热自行缓解,单一阿奇霉素治疗7天仍发热14例(15.6%),其中重症MPP占71.4%(10/14)。72例MPP患儿出院后4周内至少完成1次胸部影像学随访,25例为重症MPP(34.7%),58例病变完全吸收(80.6%)。
2.2 不同分组MPP患儿BALF细胞因子、细胞学和生化指标比较
122例MPP患儿BALF中细胞因子I L-6、TNF-α、IL-10、IFN-γ、IL-17 A、IL-2和IL-4表达水平依次为159.7(51.3~386.2)pg/mL、8.5(2.5~25.8)pg/mL、5.0(2.5~14.3)pg/mL、4.8(2.5~23.7)pg/mL、4.6(2.5~16.9)pg/mL、2.5(2.5~2.5)pg/mL和2.5(2.5~2.5)pg/mL;BALF细胞总数(3 673.1±377.9)×106/L,巨噬细胞比例(23.6±17.6)%,淋巴细胞(22.1±16.2)%,中性粒细胞(46.5±24.8)%。
BALF细胞因子IL-6、TNF-α、IL-10和IFN-γ水平在有热组和无热组、持续发热和热退镜检组、阿奇霉素有效和无效组之间差异有统计学意义(P<0.05)。重症MPP组IL-6、TNF-α、IFN-γ 和IL-17 A水平较普通MPP组明显增高,高拷贝数组TNF-α、IL-10和IFN-γ水平较低拷贝数组明显增高,差异均有统计学意义(P<0.05)。BALF细胞总数、吞噬细胞和中性粒细胞比例在有热组和无热组、高拷贝数组和低拷贝数组之间差异有统计学意义(P<0.05)。外周血D-二聚体在重症和普通组、有热和无热组、持续发热和热退镜检组、高拷贝数和低拷贝数组、阿奇霉素无效和有效组之间的差异均有统计学意义(P<0.05)。LDH在重症和普通组、有热和无热组、持续发热和热退镜检组、高拷贝数和低拷贝数组、阿奇霉素无效和有效组之间差异有统计学意义(P<0.05)。外周血白蛋白在有热和无热组、持续发热和热退镜检组、高拷贝数和低拷贝数组、阿奇霉素无效和有效组之间的差异有统计学意义(P<0.05)。见表1~5。
实变组(51例)IL-6为252.8(73.6~561.7)pg/mL,斑片影组(71例)为120.7(32.5~317.1)pg/ mL;实变组TNF-α为16.6(3.0~47.3)pg/ mL,斑片影组为5.7 (2.5~19.1)pg/mL,两组间IL-6和TNF-α水平差异有统计学意义(Z=2.64、2.39,P均<0.05)。实变组D-二聚体为0.9(0.5~2.0)pg/mL,斑片影组为0.5(0.4~0.9)mg/L;部分吸收组(14例)D-二聚体为1.9(0.8~3.4)mg/L,完全吸收组(58例)为0.6(0.5~1.1)mg/L,差异均有统计学意义(Z=2.63、2.94,P均<0.05)。实变组血白蛋白为(40.8±1.0)g/L,斑片影组为(43.4±0.5)g/L,差异有统计学意义(t=2.42,P=0.016)。

表1 重症和轻症MPP组BALF细胞因子、细胞学和血生化指标比较
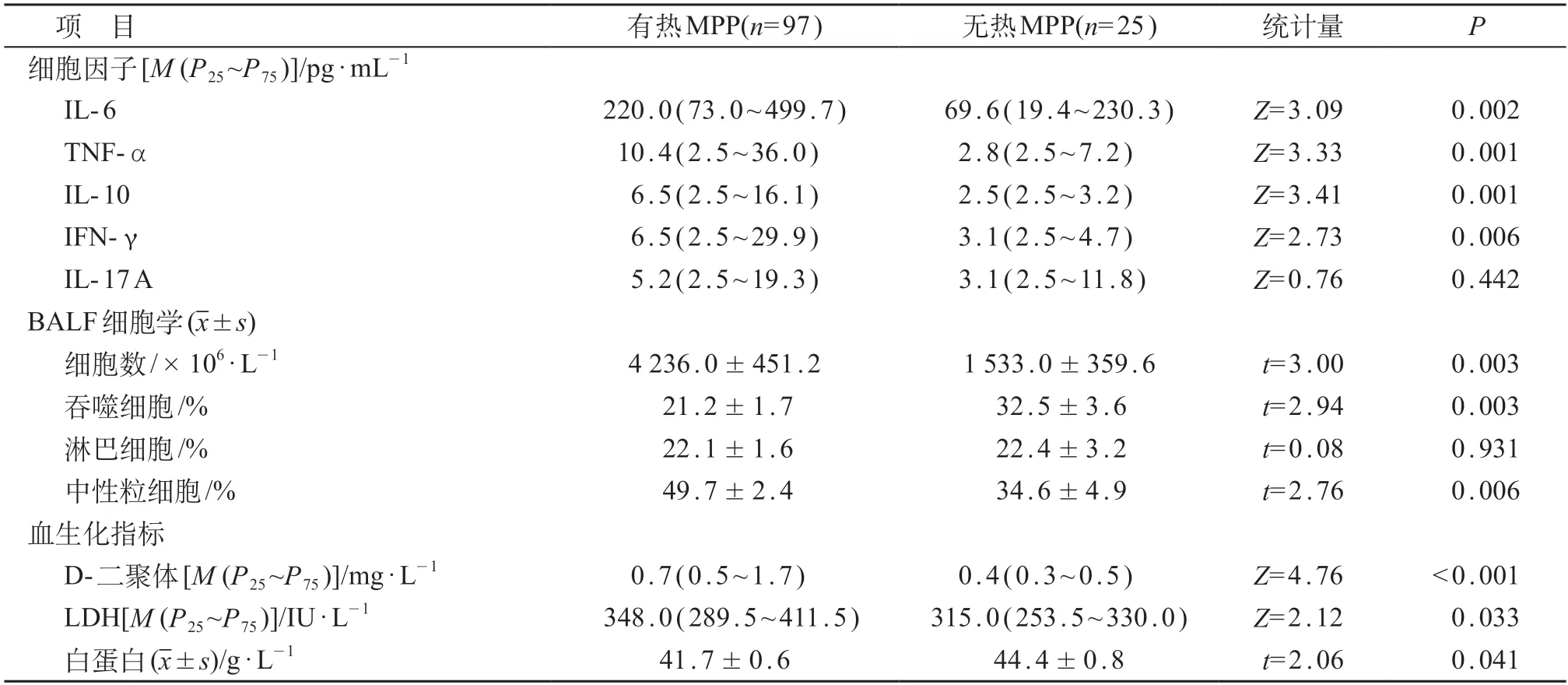
表2 有热和无热组BALF细胞因子、细胞学和血生化指标比较
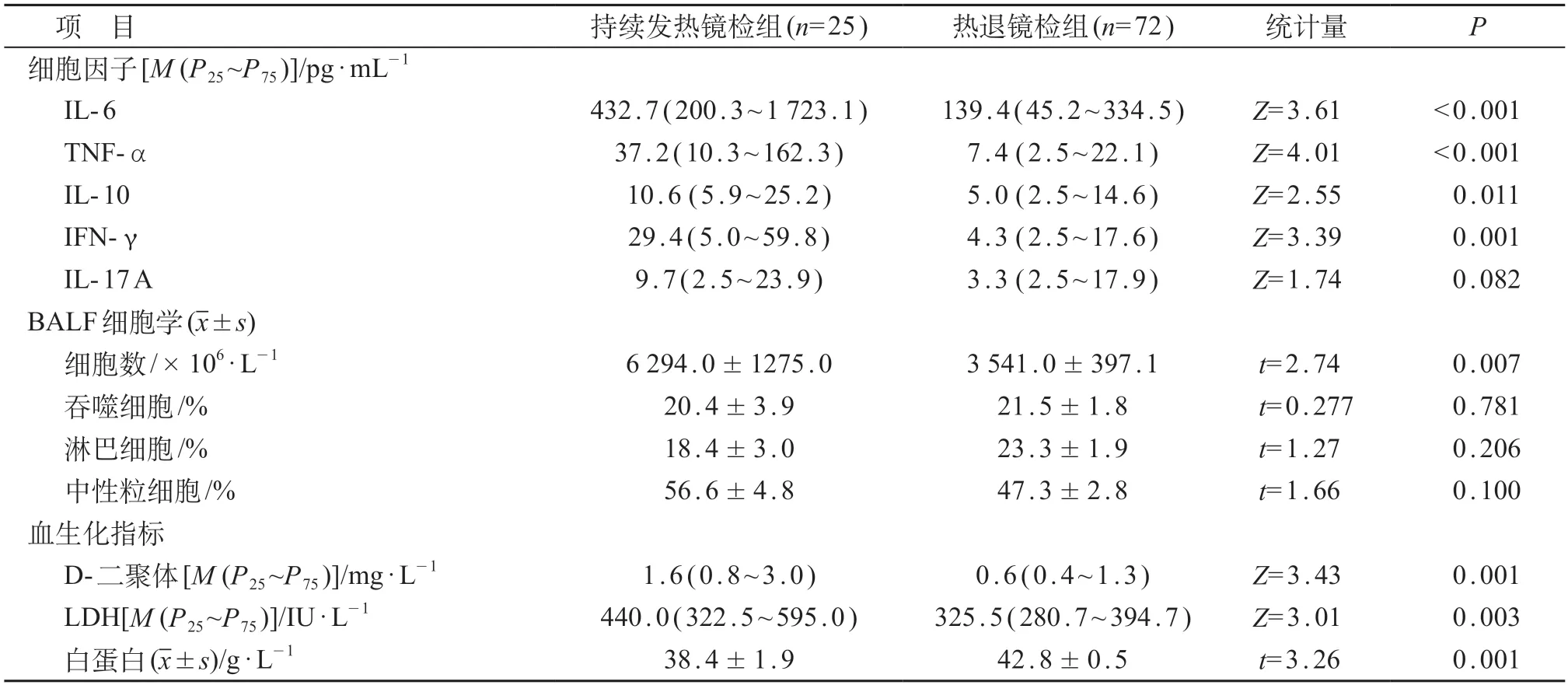
表3 不同发热时间MPP患儿BALF细胞因子、细胞学和血生化指标比较

表4 不同MP拷贝数MPP患儿BALF细胞因子、细胞学和血生化指标比较
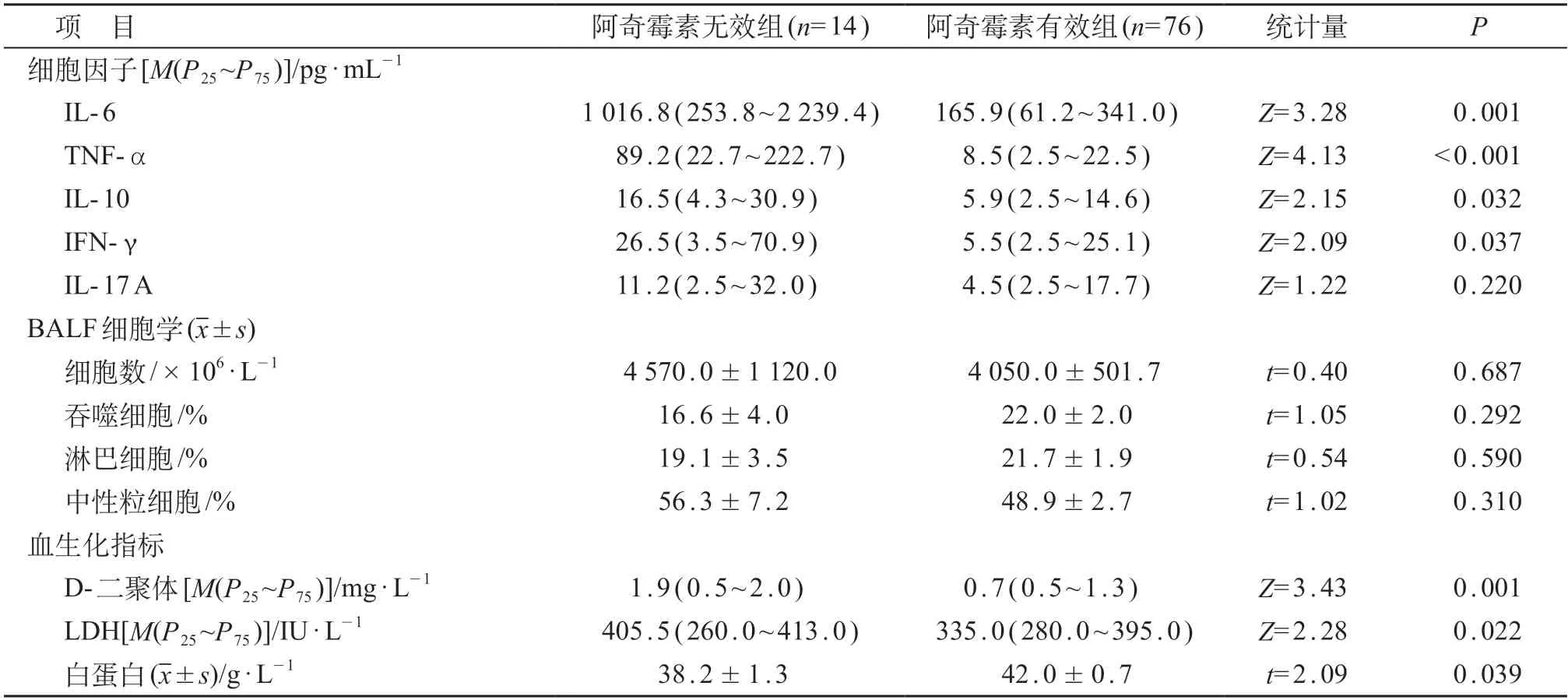
表5 不同阿奇霉素治疗应答患儿BALF细胞因子、细胞学和血生化指标比较
单一阿奇霉素无效组重症MPP比例(10/14对19/76,χ2=9.64)和热程>10天比例(11/14对14/76,χ2=18.43)均明显高于单一阿奇霉素有效组,差异有统计学意义(P<0.01)。
2.3 BALF各细胞因子之间及血生化指标与BALF各细胞因子相关性分析
122例MPP患儿BALF细胞因子I L-6与IL-10、TNF-α、IFN-γ、IL-17 A呈显著正相关(r=0.384~0.719,P均<0.001)。外周血D-二聚体与BALF细胞因子IL-6、IL-10、IFN-γ、TNF-α 呈显著正相关(r=0.323~0.452,P均<0.001)。外周血LDH与BALF细胞因子IL-6、TNF-α、IFN-γ 呈正相关(r=0.229~0.347,P均<0.01)。外周血白蛋白与BALF细胞因子IL-6、IL-10、TNF-α、IFN-γ呈负相关(r=-0.260~-0.214,P均<0.05)。实变组D-二聚体与TNF-α呈正相关(r=0.542,P<0.001)。单一阿奇霉素无效组LDH与IL-6、IFN-γ 呈正相关(r=0.732、0.587,P均<0.05)。
3 讨论
BALF细胞因子检测对了解MPP局部炎症应答特点和评估病情有重要作用。相关研究发现,与对照组相比,MPP患儿BALF中13种细胞因子明显增高,前四位分别是单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、白细胞介素-1β(interleukin-1β,IL-1 β)、IL-6和TNF-α,再加上IL-10、IFN-γ 和IL-4共7种细胞因子,在重症MPP组表达量显著高于轻症MPP组[3]。本研究显示,MPP患儿BALF中细胞因子增高前四位分别是IL-6、TNF-α、IL-10和IFN-γ,重症组和普通组的细胞因子表达差异与上述文献报道相符。另有研究发现MPP急性期淋巴细胞比例较恢复期明显下降,且轻重症之间无差异[8]。本研究中MPP患儿IL-2和IL-4表达不仅基数小且整体变化幅度不大,说明淋巴细胞来源的IL-2和IL-4对MPP急性期炎症反应影响不大。
除了病情严重度,临床是否有发热症状、热程、呼吸道标本MP载量、胸部影像学病变和阿奇霉素治疗效果不同,MPP患儿BALF细胞因子水平表达也有所不同,并伴随外周血D-二聚体、LDH和白蛋白水平出现差异。本研究发现,有发热症状、热程超过10天、MP高载量、胸部影像学提示实变和单一阿奇霉素治疗无效的患儿BALF中IL-6、TNF-α、IL-10和IFN-γ 有不同程度增高,外周血D-二聚体表达均增高,部分亚组LDH增高和白蛋白水平降低。IL-6和TNF-α 属于内源性致热源,可导致MPP患者出现发热,而无发热患儿急性期行BALF细胞因子检测临床意义不大。有发热症状的患儿平均镜检灌洗时间在病程10天左右,因此持续发热镜检的实质是热程超过10天,热程长可能提示局部炎症因子增高持续存在。MP高拷贝数患儿BALF细胞因子和细胞学与低拷贝数组相比均存在显著性差异,提示高载量MP患儿细胞因子增高可能与MP免疫病理损伤作用有关。胸部CT实变影和斑片影提示MP是直接损伤肺泡还是沿支气管树蔓延至肺泡,实变组增高的细胞因子仅有IL-6和TNF-α,说明两者可能主要来源于肺泡上皮细胞或者巨噬细胞。上述亚组各分组之间重症病例比例无显著差异,说明各因素对BALF细胞因子的影响可能与病情严重度无关,意味着有发热症状、呼吸道标本检出高载量MP或者出现肺实变的MPP患儿,即使是轻症,BALF都可能出现各类细胞因子显著增高的现象。本研究中单一阿奇霉素治疗无效患儿,合并重症和热程超过10天患儿比例显著增高,与其本质为难治性支原体肺炎(refractoryMycoplasma pneumoniaepneumonia,RMPP)相一致。该组中IL-6和TNF-α 不仅基础水平最高,且与治疗有效组之间相差接近10倍,说明这部分患儿病变肺组织炎症应答最强烈。
MPP病变部位炎症是MP与机体气道上皮细胞、肺泡上皮细胞和肺泡巨噬细胞相互作用的结果,募集至局部的中性粒细胞和淋巴细胞同样参与炎症应答过程。体外人气道上皮细胞和A 549细胞株实验数据显示,MP感染或者MP来源的丙酮酸生成酶可刺激细胞释放IL-6和TNF-α[9-10]。MP社区获得性呼吸窘迫综合征(community-acquired respiratory distress syndrome,CARDS)毒素刺激RAW 267.4巨噬细胞株可产生TNF-α[11]。MP或MP相关抗原刺激小鼠模型后的研究数据提示IL-10、IFN-γ 和IL-17 A可能来源于淋巴细胞[12-13]。本研究MPP患儿BALF中上皮细胞来源的IL-6与上皮细胞和巨噬细胞来源的TNF-α,淋巴细胞来源的IL-10、IFN-γ 和IL-17呈高度正相关,表明MPP患儿局部炎症反应是机体天然免疫应答调控获得性免疫应答的过程。血清D-二聚体、LDH与灌洗液各细胞因子呈正相关,白蛋白水平与各细胞因子呈负相关,表明上述生化指标变化在一定程度上能够反映局部病变炎症应答的强弱,便于基层医师在疾病早期评判MPP患儿肺部炎症情况。而在无热组上述相关性则消失,提示评估对象具有选择性。肺实变组血清D-二聚体与灌洗液TNF-α表达量明显高于斑片影组,且呈正相关关系。有研究发现,血清D-二聚体水平高的肺炎患者胸部影像学病变更广泛[14],且MPP患儿外周血TNF-α水平比健康人群明显增高[15],因此血清D-二聚体与肺内病变范围的关系可能通过血清D-二聚体与血清TNF-α水平的内在联系来解释。少数重症MPP患儿肺大片实变同时伴D-二聚体>500 μg/L,此时还应考虑实变病因是否为肺栓塞,血清D-二聚体联合TNF-α可能有助于了解抗凝治疗效果[16]。单一阿奇霉素治疗无效组中血清LDH与BALF中IL-6水平呈显著正相关,表明RMPP患儿肺泡上皮细胞和/或肺泡巨噬细胞持续损伤破坏,不仅释放IL-6还可能是LDH的来源之一,可同步行BALF和外周血LDH同工酶检测来明确。其次研究发现LDH同工酶预测RMPP的敏感性更高[17],因此动态监测血清LDH同工酶水平可能具有间接反映RMPP患儿肺部炎症变化的价值。
总之,MPP患儿局部炎症应答以IL-6和TNF-α为代表的前炎症细胞因子增高为主。重症MPP,或MPP患儿有发热症状、支气管镜检时已发热10天以上、MP高载量感染、胸部影像以肺实变为主和单一阿奇霉素治疗无效时,BALF细胞因子水平均明显增高。因此病情严重度不是影响BALF细胞因子水平的唯一因素,需要严格把握和评估MPP患儿行BALF细胞因子检测的指征。MPP患儿外周血D-二聚体、LDH和白蛋白水平与BALF各细胞因子之间存在一定的相关性,在没有支气管镜检条件时,可结合临床表现和外周血生化指标推测MPP肺部炎症情况。血清D-二聚体与灌洗液TNF-α,血清LDH与灌洗液IL-6分别在肺实变组和单一阿奇霉素治疗无效组明显增高,并呈显著正相关,这可为进一步研究MPP肺内病变性质及预后和RMPP肺部炎症变化提供线索。
